
- •Неорганические соединения
- •Простые вещества Сложные вещества
- •Металлы Неметаллы
- •Оксиды Гидроксиды Соли
- •Кислоты Основания
- •Амфолиты
- •Глава 1. Простые вещества
- •Металлы проявляют только восстановительные свойства.
- •Благородные
- •Получение оксидов
- •Химические свойства оксидов
- •Заряд внутренней сферы комплексного соединения определяется суммой зарядов всех составляющих её частиц:
- •Закончите уравнения реакций:
- •Самостоятельная работа
- •Глава 3. Гидроксиды
- •Гидроксиды
- •Кислотные гидроксиды, или кислоты Основные гидроксиды, или основания
- •Амфотерные гидроксиды, или амфолиты
- •Исключениями являются гидроксиды двухвалентных металлов:
- •Сводная таблица классификации гидроксидов имеет вид:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Напишите графические формулы кислот:
- •Самостоятельная работа
- •Химические свойства кислот
- •Закономерности изменения кислотных свойств
- •Закончите уравнения реакций:
- •Самостоятельная работа
- •Амфолиты
- •Химические свойства амфолитов
- •Самостоятельная работа
- •Закончите уравнения реакций:
- •Химические свойства гидроксидов
- •Глава 4. Соли
- •Диссоциация солей в водных растворах
- •Напишите названия солей:
- •Самостоятельная работа
- •Решение
- •Задача 2
- •Решение
- •Решите задачи.
- •Самостоятельная работа
- •Задача 1
- •Решение
- •Решите задачи.
- •Самостоятельная работа
- •Для проведения расчетов могут потребоваться следующие количественные соотношения, связанные с формулой (1), или из неё вытекающие:
- •Задача 1
- •Решение
- •Задача 2
- •Решение
- •Задача 3
- •Решение
- •Задача 4 Рассчитать объем водорода (н.У.), выделившийся при взаимодействии цинка с 3 л сантимолярного раствора соляной кислоты.
- •Решение
- •Самостоятельная работа
- •Глава 1. Основные понятия и определения
- •Окислительно-восстановительные реакции (овр) – это реакции, при протекании которых некоторые элементы изменяют свои степени окисления
- •Степень окисления — это условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер.
- •Исклю-чения
- •Фтор проявляет единственную степень окисления -1.
- •Элементы побочных подгрупп (d-металлы) могут проявлять различные степени окисления.
- •Вещества окислители восстановители
- •Глава 2. Типы окислительно-восстановительных реакций
- •Глава 3. Метод полуреакций – метод уравнивания овр
- •Щелочная среда
- •Получим
- •Получим
- •Самостоятельная работа
- •Реакций
- •Наименьшее общее кратное для 2 и 6
- •Восстановитель окислитель
- •Почему дихромат калия и соляная кислота в растворе с концентрацией
- •1 Моль/л (м) не взаимодействуют друг с другом?
- •Но, если к 1м раствору дихромата калия прилить более концентрированный, например, 2м раствор соляной кислоты, то начинается самопроизвольная реакция.
- •Объяснение
- •Вернемся к поставленному вопросу:
- •Почему дихромат калия и соляная кислота в растворе с концентрацией 1 моль/л (м) не взаимодействуют друг с другом?
- •Вспомним вторую часть вопроса:
- •Почему 1м раствор дихромата калия реагирует с 2м раствором соляной кислоты?
- •Конкретизируем уравнение Нернста:
- •Концентрация молекул воды не входит в уравнение
- •Глава 1. Гидролиз солей
- •Можно условно – он-.
- •Образуется гидроксокатион, заряд которого на 1 меньше заряда исходного катиона металла.
- •Глава 2 .Типы гидролиза солей
- •Гидролиз Mn(no3)2
- •Гидролиз CuSo4
- •Самостоятельная работа
- •Гидролиз по аниону
- •Примеры таких солей: Na2SiO3, Na3po4, k2so3, NaCn, ch3cook и т.Д.
- •Гидролиз Na3po4
- •Примеры таких солей: Al2s3, Al3(co3)3, Cr2s3 и т.Д.
- •Мы рассмотрели три вида гидролиза солей: по катиону, по аниону и необратимый по катиону и аниону. Но есть соли, которые гидролизу не подвергаются.
- •Гидролиз солей, образованных многозарядными катионами металлов
- •Глава 3. Гидролиз гидридов
- •Глава 4. Гидролиз солеподобных соединений
- •Глава 5. Смещение равновесия гидролиза
- •Глава 6. Количественные характеристики гидролиза
- •Краткий итог
- •Краткий итог
- •Самостоятельная работа
- •Глава 1. Теория Аррениуса
- •Библиографический список
- •Оглавление
Глава 1. Гидролиз солей
Гидролиз является результатом поляризационного взаимодействия ионов соли с их гидратной оболочкой в водном растворе. Каждая молекула воды представляет собой диполь с высоким дипольным моментом μ = 1,87 дебая (Дебай – внесистемная единица дипольного момента равная 3,33·1030 Кл·м). За счет воздействия полярных молекул воды в 80 раз уменьшаются силы межатомного или межмолекулярного взаимодействия погруженного в воду вещества. Таким образом, вода имеет самую высокую из всех известных соединений диэлектрическую проницаемость. Процесс растворения соли в воде состоит из нескольких стадий:
диссоциация вещества на ионы (a);
гидратация ионов (б);
взаимодействие молекул воды с ионами:

Условно молекулу воды можно представить в виде диполя
Нδ+–ОНδ-, в котором на атоме водорода имеется частично положительный заряд, а на гидроксо-группе – частично отрицательный.
Катионы металлов, обладающие большой поляризующей способностью, поляризуют связь Н–ОН в молекуле воды, разрывают её и присоединяют к себе ОН-группу:

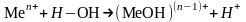
Чем больше заряд катиона и меньше его радиус, тем значительнее поляризующее действие Кn+ на молекулу воды. Чем значительнее это воздействие, тем интенсивнее протекает гидролиз. Сильное поляризующее действие оказывают катионы слабых оснований.
Взаимодействие сильно поляризуемых анионов с молекулами воды также приводит к разрыву связи Н–ОН. Отрицательно заряженный анион присоединяет к себе положительно заряженный катион водорода, в результате чего образуется новая частица (гидроанион либо молекула кислоты, если заряд аниона был равен –1).

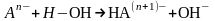
Взаимодействие анионов с молекулами воды тем интенсивнее, чем больше поляризуемость аниона. Большой поляризуемостью обладают анионы слабых кислот.
Таким образом, чем сильнее поляризующее действие катионов и больше поляризуемость анионов, тем в большей степени протекает гидролиз.
Сделаем вывод:
гидролиз идет либо по катиону слабого основания, либо по аниону слабой кислоты.
Можно привести множество примеров слабых кислот и оснований, но проще перечислить сильные кислоты и основания:
По катионам сильных оснований и анионам сильных кислот гидролиз не идет!
Сильные кислоты
H2SO4
– серная
HNO3 – азотная
HClO4 – хлорная
HCl, HBr, HI
А также все кислоты с общими формулами
Н2ЭО4, НЭО3, НЭО4
Сильные основания
LiOH 
NaOH
KOH Ca(OH)2
RbOH Sr(OH)2
CsOH Ba(OH)2
FrOH Ra(OH)2
Взаимодействие катионов с молекулами воды
Итак, взаимодействовать с молекулами воды могут только катионы слабых оснований и анионы слабых кислот. Такое взаимодействие приводит к разрыву связи Н–ОН в молекуле воды и присоединению противоположно заряженной частицы: либо Н+, либо ОН–, соответственно, к катиону или аниону соли.
Рассмотрим, какие катионы, из приведенных ниже, могут поляризовать связь Н–ОН в молекуле воды. Помним, что это способны делать катионы слабых оснований (смотри таблицу со смайлом ).

Fe3+, Mn2+, Na+, Mg2+, Cr3+
Катион |
Соответствующее основание |
Наличие в таблице со смайлом |
Вывод о силе основания |
Вывод о возможности гидролиза |
Fe3+ |
Fe(OH)3 |
нет |
слабое |
да |
Mn2+ |
Fe(OH)3 |
нет |
слабое |
да |
Na+ |
Fe(OH)3 |
есть |
сильное |
нет |
Mg2+ |
Fe(OH)3 |
нет |
слабое |
да |
Cr3+ |
Fe(OH)3 |
есть |
сильное |
нет |
Напишем уравнение взаимодействия катиона Fe3+ с водой, учитывая, что оно приводит к разрыву связи в молекуле воды и образованию новых частиц:
