
- •Неорганические соединения
- •Простые вещества Сложные вещества
- •Металлы Неметаллы
- •Оксиды Гидроксиды Соли
- •Кислоты Основания
- •Амфолиты
- •Глава 1. Простые вещества
- •Металлы проявляют только восстановительные свойства.
- •Благородные
- •Получение оксидов
- •Химические свойства оксидов
- •Заряд внутренней сферы комплексного соединения определяется суммой зарядов всех составляющих её частиц:
- •Закончите уравнения реакций:
- •Самостоятельная работа
- •Глава 3. Гидроксиды
- •Гидроксиды
- •Кислотные гидроксиды, или кислоты Основные гидроксиды, или основания
- •Амфотерные гидроксиды, или амфолиты
- •Исключениями являются гидроксиды двухвалентных металлов:
- •Сводная таблица классификации гидроксидов имеет вид:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Напишите графические формулы кислот:
- •Самостоятельная работа
- •Химические свойства кислот
- •Закономерности изменения кислотных свойств
- •Закончите уравнения реакций:
- •Самостоятельная работа
- •Амфолиты
- •Химические свойства амфолитов
- •Самостоятельная работа
- •Закончите уравнения реакций:
- •Химические свойства гидроксидов
- •Глава 4. Соли
- •Диссоциация солей в водных растворах
- •Напишите названия солей:
- •Самостоятельная работа
- •Решение
- •Задача 2
- •Решение
- •Решите задачи.
- •Самостоятельная работа
- •Задача 1
- •Решение
- •Решите задачи.
- •Самостоятельная работа
- •Для проведения расчетов могут потребоваться следующие количественные соотношения, связанные с формулой (1), или из неё вытекающие:
- •Задача 1
- •Решение
- •Задача 2
- •Решение
- •Задача 3
- •Решение
- •Задача 4 Рассчитать объем водорода (н.У.), выделившийся при взаимодействии цинка с 3 л сантимолярного раствора соляной кислоты.
- •Решение
- •Самостоятельная работа
- •Глава 1. Основные понятия и определения
- •Окислительно-восстановительные реакции (овр) – это реакции, при протекании которых некоторые элементы изменяют свои степени окисления
- •Степень окисления — это условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер.
- •Исклю-чения
- •Фтор проявляет единственную степень окисления -1.
- •Элементы побочных подгрупп (d-металлы) могут проявлять различные степени окисления.
- •Вещества окислители восстановители
- •Глава 2. Типы окислительно-восстановительных реакций
- •Глава 3. Метод полуреакций – метод уравнивания овр
- •Щелочная среда
- •Получим
- •Получим
- •Самостоятельная работа
- •Реакций
- •Наименьшее общее кратное для 2 и 6
- •Восстановитель окислитель
- •Почему дихромат калия и соляная кислота в растворе с концентрацией
- •1 Моль/л (м) не взаимодействуют друг с другом?
- •Но, если к 1м раствору дихромата калия прилить более концентрированный, например, 2м раствор соляной кислоты, то начинается самопроизвольная реакция.
- •Объяснение
- •Вернемся к поставленному вопросу:
- •Почему дихромат калия и соляная кислота в растворе с концентрацией 1 моль/л (м) не взаимодействуют друг с другом?
- •Вспомним вторую часть вопроса:
- •Почему 1м раствор дихромата калия реагирует с 2м раствором соляной кислоты?
- •Конкретизируем уравнение Нернста:
- •Концентрация молекул воды не входит в уравнение
- •Глава 1. Гидролиз солей
- •Можно условно – он-.
- •Образуется гидроксокатион, заряд которого на 1 меньше заряда исходного катиона металла.
- •Глава 2 .Типы гидролиза солей
- •Гидролиз Mn(no3)2
- •Гидролиз CuSo4
- •Самостоятельная работа
- •Гидролиз по аниону
- •Примеры таких солей: Na2SiO3, Na3po4, k2so3, NaCn, ch3cook и т.Д.
- •Гидролиз Na3po4
- •Примеры таких солей: Al2s3, Al3(co3)3, Cr2s3 и т.Д.
- •Мы рассмотрели три вида гидролиза солей: по катиону, по аниону и необратимый по катиону и аниону. Но есть соли, которые гидролизу не подвергаются.
- •Гидролиз солей, образованных многозарядными катионами металлов
- •Глава 3. Гидролиз гидридов
- •Глава 4. Гидролиз солеподобных соединений
- •Глава 5. Смещение равновесия гидролиза
- •Глава 6. Количественные характеристики гидролиза
- •Краткий итог
- •Краткий итог
- •Самостоятельная работа
- •Глава 1. Теория Аррениуса
- •Библиографический список
- •Оглавление
Задача 4 Рассчитать объем водорода (н.У.), выделившийся при взаимодействии цинка с 3 л сантимолярного раствора соляной кислоты.
Решение
-
Дано:
Vр = 3 л
С(HCl) = 0,01 моль/л
Напишем уравнение реакции:
Zn + 2HCl = ZnCl2 + H2
Рассчитаем количество серной кислоты по формуле (3.2):
n (H2SO4) = cV = 0,01 3 = 0,03 (моль)
V(H2) – ?
Из уравнения реакции видно, что количество выделившегося водорода в 2 раза меньше количества прореагировавшей соляной кислоты, т.е.
n (H2) = 0,015 моль
Рассчитаем объем водорода:
V (H2) = nVm = 0,015 22,4 = 0,336 (л)
Самостоятельная работа
Рассчитайте объем углекислого газа, выделившегося при взаимодействии карбоната кальция с 800 мл 2 н раствора соляной кислоты.
Рассчитайте объем 0,5 М раствора соляной кислоты, необходимый для полной нейтрализации 370 г гидроксида кальция.
Рассчитайте объем сантимолярного раствора нитрата серебра, необходимый для взаимодействия со 100 мл 10%-го раствора бромоводородной кислоты с плотностью равной 1,07 г/мл.
Сколько граммов цинка потребуется для полного восстановления 600 мл 0,5 М раствора соляной кислоты равной 1,07 г/мл?
Какой объем 0.2 М раствора серной кислоты необходим для полного растворений 108 г алюминия?
Рассчитайте молярную концентрацию, молярную концентрацию эквивалентов ортофосфорной кислоты, титр, молярные доли растворенного вещества и растворителя, а также моляльность 36%-го раствора серной кислоты с плотностью 1,23 г/мл.
РАЗДЕЛ 4
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Глава 1. Основные понятия и определения
Окислительно-восстановительные реакции (овр) – это реакции, при протекании которых некоторые элементы изменяют свои степени окисления
При протекании ОВР всегда один из элементов реакции повышает свою степень окисления – окисляется, а дугой её понижает – восстанавливается.
Окислитель - вещество, в состав которого входит элемент, понижающий свою степень окисления в ходе реакции
Восстановитель - вещество, в состав которого входит элемент, повышающий свою степень окисления в ходе реакции
Например, в реакции взаимодействия цинка с серной кислотой:

Zn является восстановителем, а серная кислота – окислителем.
Степень окисления
Степень окисления — это условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер.
Степени окисления могут иметь положительное, отрицательное или нулевое значение. Для того чтобы определить степень окисления элемента в соединении, нужно помнить, что алгебраическая сумма степеней окисления всех элементов с учётом числа их атомов в молекуле (формульной единице вещества) равна нулю. Например, для расчета степени окисления марганца в соединении K2MnO4 составим уравнение, учитывая, что степень окисления калия равна +1, а кислорода –2:
2(+1) + х + 4(–2) = 0. Отсюда х = +6.
Характерные степени окисления элементов можно определить исходя из их расположения в Периодической системе (ПС). Элементы, расположенные в первых трёх группах (главных подгруппах) ПС, имеют постоянную степень окисления, которая совпадает с номером группы. Например, Li, Na, K проявляют в соединениях степень окисления +1; Be, Mg, Ca – элементы второй группы – проявляют степень окисления +2; степень окисления элементов третьей группы B, Al и т.д. в соединениях равна +3.
Набор характерных степеней элементов всех последующих групп определяется следующими правилами:
высшая
степень окисления совпадает с номером группы;
низшая
степень окисления равна номеру группы минус 8,
промежуточные степени окисления,
как правило, равны четным числам для элементов групп с четными номерами и нечетным числам – для элементов групп с нечетными номерами.
Возможные степени окисления элементов главных подгрупп приведены в таблице:
I группа |
II группа |
III группа |
IV группа |
V группа |
|||||||||
Li |
+1 |
Be |
+2 |
B |
+3 |
C |
–4,+2,+4 |
N |
–3,–2,–1, +1,+2,+3,+4,+5 |
||||
Na |
+1 |
Mg |
+2 |
Al |
+3 |
Si |
–4, +2, +4 |
P |
–3, +1, +3, +5 |
||||
K |
+1 |
Ca |
+2 |
Ga |
+3 |
Ge |
–4, +2, +4 |
As |
–3, +3, +5 |
||||
Rb |
+1 |
Sr |
+2 |
In |
+3 |
Sn |
–4,+2, +4 |
Sb |
–3, +3, +5 |
||||
Cs |
+1 |
Ba |
+2 |
Tl |
+1,+3 |
Pb |
(-4),+2, +4 |
Bi |
(–3), +3, +5 |
||||
-
VI группа
VII группа
O
–2, –1, + 1, +2
F
–1
S
–2, +4, +6
Cl
–1, +1, +3, +5, +7
Se
–2, +4, +6
Br
–1, +1, +3, +5, +7
Te
-2, +4, +6
I
–1, +1, +3, +5, +7
Po
+2, +4
At
–1, +1, +3, +5
К
Водород
в большинстве соединений проявляет
степень окисления +1,
но в гидридах, соединениях водорода с
металлами, его степень окисления равна
-1, например,
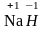 .
.
Для кислорода характерной степенью окисления является –2. Однако возможны -1 (Н2О2 – пероксиды), –1/2 (КО2 – надпероксиды), –1/3 (КО3 – озониды), +1 (O2F2) и +2 ( OF2).
