
- •Неорганические соединения
- •Простые вещества Сложные вещества
- •Металлы Неметаллы
- •Оксиды Гидроксиды Соли
- •Кислоты Основания
- •Амфолиты
- •Глава 1. Простые вещества
- •Металлы проявляют только восстановительные свойства.
- •Благородные
- •Получение оксидов
- •Химические свойства оксидов
- •Заряд внутренней сферы комплексного соединения определяется суммой зарядов всех составляющих её частиц:
- •Закончите уравнения реакций:
- •Самостоятельная работа
- •Глава 3. Гидроксиды
- •Гидроксиды
- •Кислотные гидроксиды, или кислоты Основные гидроксиды, или основания
- •Амфотерные гидроксиды, или амфолиты
- •Исключениями являются гидроксиды двухвалентных металлов:
- •Сводная таблица классификации гидроксидов имеет вид:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Напишите графические формулы кислот:
- •Самостоятельная работа
- •Химические свойства кислот
- •Закономерности изменения кислотных свойств
- •Закончите уравнения реакций:
- •Самостоятельная работа
- •Амфолиты
- •Химические свойства амфолитов
- •Самостоятельная работа
- •Закончите уравнения реакций:
- •Химические свойства гидроксидов
- •Глава 4. Соли
- •Диссоциация солей в водных растворах
- •Напишите названия солей:
- •Самостоятельная работа
- •Решение
- •Задача 2
- •Решение
- •Решите задачи.
- •Самостоятельная работа
- •Задача 1
- •Решение
- •Решите задачи.
- •Самостоятельная работа
- •Для проведения расчетов могут потребоваться следующие количественные соотношения, связанные с формулой (1), или из неё вытекающие:
- •Задача 1
- •Решение
- •Задача 2
- •Решение
- •Задача 3
- •Решение
- •Задача 4 Рассчитать объем водорода (н.У.), выделившийся при взаимодействии цинка с 3 л сантимолярного раствора соляной кислоты.
- •Решение
- •Самостоятельная работа
- •Глава 1. Основные понятия и определения
- •Окислительно-восстановительные реакции (овр) – это реакции, при протекании которых некоторые элементы изменяют свои степени окисления
- •Степень окисления — это условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер.
- •Исклю-чения
- •Фтор проявляет единственную степень окисления -1.
- •Элементы побочных подгрупп (d-металлы) могут проявлять различные степени окисления.
- •Вещества окислители восстановители
- •Глава 2. Типы окислительно-восстановительных реакций
- •Глава 3. Метод полуреакций – метод уравнивания овр
- •Щелочная среда
- •Получим
- •Получим
- •Самостоятельная работа
- •Реакций
- •Наименьшее общее кратное для 2 и 6
- •Восстановитель окислитель
- •Почему дихромат калия и соляная кислота в растворе с концентрацией
- •1 Моль/л (м) не взаимодействуют друг с другом?
- •Но, если к 1м раствору дихромата калия прилить более концентрированный, например, 2м раствор соляной кислоты, то начинается самопроизвольная реакция.
- •Объяснение
- •Вернемся к поставленному вопросу:
- •Почему дихромат калия и соляная кислота в растворе с концентрацией 1 моль/л (м) не взаимодействуют друг с другом?
- •Вспомним вторую часть вопроса:
- •Почему 1м раствор дихромата калия реагирует с 2м раствором соляной кислоты?
- •Конкретизируем уравнение Нернста:
- •Концентрация молекул воды не входит в уравнение
- •Глава 1. Гидролиз солей
- •Можно условно – он-.
- •Образуется гидроксокатион, заряд которого на 1 меньше заряда исходного катиона металла.
- •Глава 2 .Типы гидролиза солей
- •Гидролиз Mn(no3)2
- •Гидролиз CuSo4
- •Самостоятельная работа
- •Гидролиз по аниону
- •Примеры таких солей: Na2SiO3, Na3po4, k2so3, NaCn, ch3cook и т.Д.
- •Гидролиз Na3po4
- •Примеры таких солей: Al2s3, Al3(co3)3, Cr2s3 и т.Д.
- •Мы рассмотрели три вида гидролиза солей: по катиону, по аниону и необратимый по катиону и аниону. Но есть соли, которые гидролизу не подвергаются.
- •Гидролиз солей, образованных многозарядными катионами металлов
- •Глава 3. Гидролиз гидридов
- •Глава 4. Гидролиз солеподобных соединений
- •Глава 5. Смещение равновесия гидролиза
- •Глава 6. Количественные характеристики гидролиза
- •Краткий итог
- •Краткий итог
- •Самостоятельная работа
- •Глава 1. Теория Аррениуса
- •Библиографический список
- •Оглавление
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
«НАУЧНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Е.М. Князева
ОБЩАЯ ХИМИЯ:
УЧЕБНОЕ ПОСОБИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ
Рекомендовано в качестве учебного пособия Редакционно-издательским советом Научно-исследовательского Томского политехнического
университета
Издательство
Научного исследовательского Томского
политехнического университета
2012
УДК 546(076.5)
ББК 24.1 Я73
К54
Князева Е.М.
К54 Общая химия: учебное пособие для самостоятельной работы студентов / Е.М. Князева. – Томск: Изд-во Научно-исследовательского Томского политехнического университета, 2011. – 86 с.
Учебное пособие предназначено для самостоятельной работы студентов химических направлений и специальностей. Пособие содержит теоретический материал, изложенный в сжатой, но доступной форме, примеры решения задач, а также задания для самостоятельной работы, выполнение которых поможет студенту в подготовке к экзамену.
УДК 546(076.5)
ББК 24.1 Я73
Рекомендовано к печати Редакционно-издательским советом
Научно-исследовательского Томского политехнического
университета
Рецензенты
Доктор технических наук, профессор
Северской технологической академии
А.С. Буйновский
Доктор химических наук, профессор ТГУ
Л.Н. Курина
© Князева Е.М., 20112
© Научно-исследовательский Томский политехнический университет, 2012
© Оформление. Издательство научно-исследова-
тельского Томского политехнического университета, 2012
ПРЕДИСЛОВИЕ
Успешность обучения студентов в высшем учебном заведении обуславливается несколькими составляющими. Во-первых, это осознанный выбор будущей специальности и отсюда мотивационная настроенность на процесс получения образования. Во-вторых, качество полученных школьных знаний и умения учиться и, в-третьих, собственные природные способности. Если студент первокурсник обладает всеми тремя составляющими, то сам процесс обучения не представляет собой никаких сложностей и студент получает удовольствие, проходя поэтапно все его ступени. Если же какая-либо из составляющих отсутствует, то начинаются сбои, сложности, перерастающие порой в непреодолимые препятствия. Особенно важно помочь студенту именно на первом этапе его обучения, то есть на первом курсе. Самое главное, нужно понимать, что нет ничего невозможного. Ошибочный, на первый взгляд, выбор специальности впоследствии может оказаться судьбоносным. Недостаток природных способностей можно преодолеть усердием и целеустремленностью, а пробелы школьного образования могут быть восполнены благодаря самообразованию.
Данное пособие предназначено студентам, желающим быть успешными и не боящимся трудностей. Действительно, химия – это сложная наука, но её красота, логика, и, поистине, всеобъемлющее окружение, делает её привлекательной и постижимой.
Пособие состоит из 5 разделов. В первом разделе, посвященном основным классами неорганических соединений, изложены принципы классификации простых веществ, оксидов, гидроксидов и солей. Сформулированы подходы к формированию названий и графических формул различных соединений. Подробно описаны химические свойства и способы получения представителей основных классов неорганических веществ.
Во втором разделе: «Количественные расчеты» сформирован алгоритм решения задач по уравнениям реакций, разобраны примеры решений, приведено уравнение Клапейрона-Менделеева и показано его применение при осуществлении стехиометрических расчетов.
В третьем разделе приведены определения, формулы и примеры применения в решении расчетных задач основных способов выражения концентрации растворов.
В четвертом разделе подробно рассмотрены теоретические основы метода полуреакций.
Пятый и шестой разделы посвящены теме растворы.
РАЗДЕЛ 1
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
В настоящее время известно более 500 тысяч неорганических соединений и современный подход к их классификации, состоит в объединении веществ, сходных по определенным признакам, например, по составу и свойствам, в отдельные группы. Если вещество состоит из атомов одного химического элемента, т.е. является формой существования этого элемента в свободном виде, то его называют простым веществом; если же вещество из атомов двух или большего числа элементов, то его называют сложным веществом. Все вещества (кроме одноатомных) принято называть химическими соединениями, так как в них атомы одного или разных элементов соединены между собой химическими связями.
Все химические соединения можно классифицировать следующим образом:
Неорганические соединения
Простые вещества Сложные вещества
Металлы Неметаллы
Оксиды Гидроксиды Соли
Кислоты Основания
Амфолиты
Рассмотрим получение и характерные свойства основных представителей каждого класса неорганических соединений.
Глава 1. Простые вещества
Простое вещество – это вещество, состоящее из атомов одного и того же химического элемента. При этом атомы могут быть не связанными между собой (He, Ne …), связанными в молекулы (O2, H2, S8, P4) или кристаллы (все металлы).
Простые вещества делят на металлы и неметаллы. Из 118 известных на сегодня элементов только 22 являются неметаллами.
Причиной многочисленности простых веществ (элементов – 118, простых веществ – более 300) является аллотропия.
Аллотропия – способность атомов одного и того же химического элемента образовывать несколько простых веществ. Аллотропные модификации образуют: O, S, P, C, Si и др.
Явление аллотропии вызывается двумя причинами:
1) различным числом атомов в молекуле, например, O2 и O3;
2) образованием различных кристаллических форм, например, алмаз и графит.
-
Элемент
Аллотропные модификации
Кислород
Кислород (О2) и озон (О3)
Сера
Ромбическая (S8), моноклинная (S8), пластическая


Углерод
Алмаз, графит, карбин, фуллерен


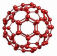
Фосфор
Белый, красный, черный, фиолетовый и т.д.

К металлам относятся: все s-элементы (кроме водорода и гелия), все d-элементы, все f-элементы, кроме того, среди р-элементов – большинство металлов. В периодической системе все неметаллы сгруппировались компактно в правой части, как это показано ниже:
-
I
II
III
IV
V
VI
VII
VIII
-
-
B
C
N
O
F
Ne
Si
P
S
Cl
Ar
As
Se
Br
Kr
Te
I
Xe
At
Rn
Кроме перечисленных элементов неметаллами являются также водород (Н) и гелий (He).
Металлы – это вещества, обладающие металлическим блеском, пластичностью, тепло- и электропроводностью, уменьшающейся с увеличением температуры. При обычных условиях металлы – твердые вещества (кроме ртути).
Общие свойства металлов
Общие свойства неметаллов
Металлы проявляют только положительные степени окисления.
Неметаллы проявляют как положительные, так и отрицательные степени окисления.
Металлы способны к образованию простых катионов: Fe2+, Fe3+
Неметаллы не образуют простых катионов.
