
Билеты_буракова
.pdfБилет №1 ................................................................................................. |
2 |
Билет №2 ................................................................................................. |
3 |
Билет №3 ................................................................................................. |
5 |
Билет №4 ................................................................................................. |
6 |
Билет №5 ................................................................................................. |
8 |
Билет №6 ............................................................................................... |
10 |
Билет № 7 .............................................................................................. |
12 |
Билет №8 ............................................................................................... |
13 |
Билет №9 ............................................................................................... |
15 |
Билет №10 ............................................................................................. |
18 |
Билет №11 ............................................................................................. |
19 |
Билет №12 ............................................................................................. |
20 |
Билет №13 ............................................................................................. |
22 |
Билет №14 ............................................................................................. |
24 |
Билет №15 ............................................................................................. |
27 |
Билет №1
1. Что такое генетическая трансформация?
Генети́ческая трансформа́ция — изменение наследственных свойств клетки в результате внесения в нее генетической информации при помощи чужеродной изолированной дезоксирибонуклеиновой кислоты (ДНК). Трансформация приводит к появлению у трансформированной клетки (трансформанта) и ее потомства новых признаков, характерных для объекта
— источника ДНК. Явление трансформации было открыто в 1928 году британским ученым Ф. Гриффитом, который показал возможность превращения непатогенных штаммов вирусов Streptococcus pneumoniae в патогенные штаммы, в результате взаимодействия с убитыми клетками патогенных штаммов. В 1944 году американец О. Эйвери установил, что трансформацию обеспечивают молекулы ДНК, которые являются носителями наследственной информации.
2.Какие вещества и в каких случаях используют для регуляции экспрессии гена целевого белка в бактериальных экспрессионных системах?
Сlac-опероном связываются репрессоры в отсутствии лактозы. Включение lac-оперона или происходит при добавлении в среду лактозы или ИПТГ, т.е. возобновляется транскрипция.
•Многие промоторы, особенно промоторы оперонов с генами, кодирующими белки метаболизма сахаров, регулируются как отрицательно, так и положительно. Подобный двойной контроль характерен, например, для lacпромотора оперона кишечной палочки, контролирующего экспрессию белков метаболизма лактозы. Репрессорный белок LacI связывается после lac-промотора (в положении от +1 до +21) при отсутствии лактозы и ингибирует транскрипцию генов lacZYA . В присутствии аллолактозы, которая синтезируется из лактозы ферментом бета-галактозидазой, (LacZ) или в присутствии негидролизуемого синтетического аналога (ИПТГ) белок-репрессор теряет аффинность к оператору. Ввиду того, что ИПТГ не подвержена гидролизу ферментами клетки E. coli, для индукции требуется меньшая концентрация этого вещества по сравнению с лактозой. Помимо отрицательного контроля, транскрипция положительно контролируется белком-активатором катаболитных оперонов, CAP-белком (англ. Catabolite activator protein). Эффективная транскрипция возможна только в присутствии активирующего комплекса CAP-белка и циклического AMФ. AMФ достаточно высока для инициации транскрипции только в условии отсутствии глюкозы. Таким образом, для э ной инициации транскрипции отсутствие глюкозы (к (или его негидролизируемого . Схема отрицательной регуляции лактозного оперона Активирующий комплекс перед началом
последо уменьшения зависимости инициации транскрипции от полной утил
. В свою очередь, концентрация циклического AMФ достаточно высока для инициации транскрипции только в условии отсутствии глюкозы. Таким образом, для э ной инициации транскрипции необходимо сочетание двух факторов глюкозы (катаболитная репрессия) и наличие негидролизируемого аналога ИПТГ). Триптофановый промотор является сильным промотором, при индукции экспрессии уровень транскрипции гена повышается примерно в 70 раз, и содержание рекомбинантного белка может составлять до 30 % всех белков клетки. В отличие от lac-промотора, trp-промотор контролирует экспрессию анаболических ферментов метаболизма триптофана − белков, катализирующих биосинтез триптофана. Когда содержание триптофана высоко, клетка не нуждается в его биосинтезе, и промотор репрессируется. L-арабиноза
может использоваться клетками кишечной палочки в качестве единственного источника углерода. Арабинозный оперон регулируется наличием или отсутствием глюкозы. низкий уровень глюкозы повышает уровень экспрессии, а высокий понижает Это потому, что арабиноза может использоваться клетками кишечной
палочки в качестве единственного источника углерода
3. Рассчитайте эффективность трансформации, если для нее использовали 1 мкл ДНК с концентрацией 60 мкг/мл, 50 мкл суспензии компетентных клеток и 200 мкл среды, на чашку Петри было высеяно 50 мкл культуры, в результате чего выросло 600 колоний бактерий.
Всего в пробирке: 1 мкл ДНК+ 50 мкл суспензии клеток+ 200 мкл среды= 251 мкл На чашку вылили только 50 мкл полученного раствора. Считаем сколько
ДНК содержится в этом объеме: 251 мкл-60мкг 50мкл-х мкг
Х= 11,952 мкг ДНК в 50 мкл (На одну чашку попало 11,952 мкг ДНК) Эффективность трансформации = число колоний на чашке / на кол-во ДНК на чашку (мкг) Эффективность трансформации = 600/11,952=50,2
Билет №2
1. Какими свойствами обладают компетентные клетки и для чего они используются?
Компетентная клетка – это те клетки, которые способны поглощать извне чужеродную ДНК. Например, состояние бактерии, при котором она может включать в себя экзогенные молекулы ДНК, т. е. быть реципиентом ДНК при трансфекции.
Компетентные клетки у различных видов бактерий отличаются от некомпетентных не только способностью к поглощению ДНК, но и другими
свойствами:
•обладают сниженным уровнем метаболизма;
•более устойчивы к пенициллину, чем остальные клетки в популяции;
•сниженным темпом репликации ДНК или вообще ее отсутствием;
•меньшими размерами, чем некомпетентные;
•изменением наружных слоев, наличием обнаженных участков цитоплазматической мембраны;
•повышенной чувствительностью к осмотическому шоку, тепловой обработке;
•сниженным поверхностным зарядом.
Компетентные клетки широко используются в генной инженерии в качестве реципиентов векторных плазмид.
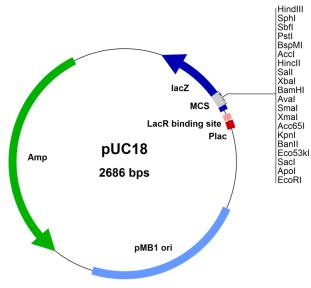
2. Опишите структуру плазмиды, изображенной на рисунке: За какие функции отвечает каждый из ее участков?
PUC18 является широко используемым вектором клонирования плазмиды в E. coli . Молекула представляет собой двухцепочечную кольцевую ДНК (длина 2686 пар оснований). Благодаря небольшому размеру pUC18 позволяет успешно клонировать крупные фрагменты ДНК .
Amp- Селективный маркер (ген устойчивости к антибиотику ампициллину, данный ген обеспечивает негативную селекцию нетрансформированных
клонов. Клетки, не содержащие плазмидную конструкцию, не способны расти на среде с антибиотиками и погибают.)
pMB1 ori- Ориджин репликации ( поддерживает репликацию 15-50 копий)
Plac- Промотор (обеспечивает связывание с РНК-полимеразой и факторами
Транскрипции)
LacR binding site- сайт связывания (влияет на уровень трансляции целевого гена)
MCS- Сайт множественного клонирования находится в пределах гена β- галактозидазы и содержит уникальные сайты для 13 различных ферментов рестрикции (Acc I, BamH I, EcoR I, Hinc II, Hind III, Kpn I, Pst I, Sac I, Sal I, Sma I, Sph I, Xba I и Xma I)
.lacZ- ген β-галактозидазы (При вставке в плазмиду целевого гена последовательность гена lacZ нарушается и клетка, трансформированная данной плазмидой, теряет способность к модификации субстрата и остается неокрашенной, так называемая способность трансформированных штаммов гидролизовать хромогенный субстрат (сине-белый тест))
3. Как приготовить 300 мл буфера, содержащего 10 мМ Трис-HCl pH 7.0, 1 мМ ЭДТА, 0.1 М NaCl, если имеется 1 М раствор Трис-HCl pH 7.0, 0.5 М раствор ЭДТА и 5 М раствор NaCl?
Для того, чтобы приготовить 300 мл 10мМ Трис-HCl pH 7.0,
1 мМ ЭДТА, 0.1 М NaCl, нужно:
•взять 3 мл 1М раствора Трис-HCl pH 7.0
•0,6 мл 0.5 М раствора ЭДТА
•6 мл 5 М раствора NaCl
•И довести водой до 300 мл
Билет №3
1.Какие организмы используются в биотехнологии в качестве клетокхозяев для биосинтеза белка?
Микроорганизмы – бактериальные клетки(бактерии)
2.Для чего в состав ПААГ и разделяемых образцов вводят ДСН?
ДСН – додецилсульфат натрия, анионный детергент. Он позволяет разделять белки с молек. массой от 20 до 200 кДа.(для разделения нукл. к-т среднего размера обычно применяют агарозные гели).
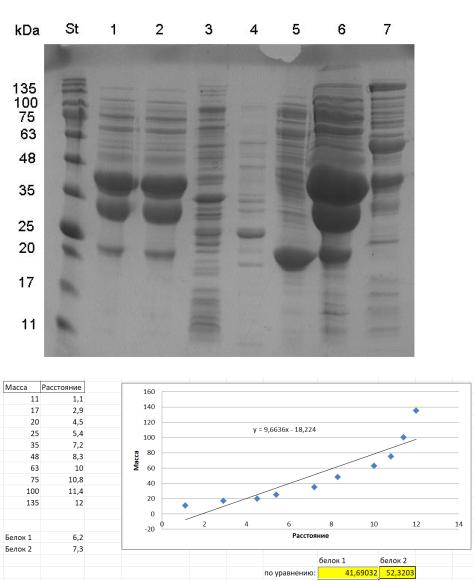
3. Определите молекулярную массу мажорных белков на треке 1 электрофореграммы с помощью калибровочного графика.
Билет №4
1.От чего зависит эффективность трансформации? Как ее рассчитать?
Эфф. трансф. = число колоний на чашке / кол-во ДНК на чашку (мкг)
2.Что происходит в трансформированных клетках после добавления индуктора в культуральную среду?
После добавления индуктора запускается процесс синтеза целевого белка, а деление клеток при этом замедляется, постепенно выходя в
стационарную фазу. Если индуктор добавлять сразу, то клеток в культуре будет мало, что снизит выход белка, если же добавить в позднюю фазу роста, то прибольшом количестве клеток белка будет мало, так как ресурсы питательной среды уже будут истощены и их будет недостаточно для синтеза
3.Как приготовить 200 мл раствора, содержащего 50 мМ фосфатного буфера рН 7.0, 0.3 М NaCl и 10 мМ имидазола, если имеется 2М фосфатный буфер рН 7.0, 5М раствор NaCl и сухой имидазол с Мw=68 г/моль.
1)Чтобы приготовить 200 мл раствора 50мМ фосфатного буфера рН 7.0 необходимо 5 мл 0,5М фосфатного буфера рН 7.0, 12 мл 5М раствора
NaCl
2)Теперь рассчитаем количество сухого имидазола: m=n*M=0,01*68=0,68 г сухого имидазола ( в 1 л раствора) 0,68*0,2=0,136г

Билет №5
1.Опишите структуру и принцип работы арабинозного оперона.
2.Какие соли можно использовать для создания градиента в анионообменной хроматографии?
NaCl (хлорид натрия), KCl (хлорид калия)
3.Рассмотрите профиль элюции. Что можно сказать об условиях проведенного хроматографирования, если для элюирования целевого продукта использовали градиент концентраций имидазола?
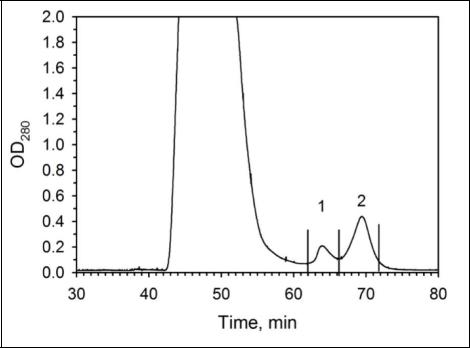
Это МЕТАЛЛ-ХЕЛАТНАЯ ХРОМАТОГРАФИЯ
Белок содержит His-tag. Колонка мб никелевая
Белки с His-тагом (например, образующие тельца включения при синтезе в E. coli) можно растворить в буферах, содержащих 8 М мочевины,6 М гуанидин гидрохлорида, 1% лаурил-саркозина. рН белкового раствора должен быть в районе 7−8, для лучшего растворения возможно кратковременно повысить pH детергентов, денатурирующих агентов и pH должны быть подобраны). Колонку перед нанесением на неё растворённого белка необходимо уравновесить в том же буфере, что использовался при растворении, прокачав через неё около 5-ти объёмов буфера. После нанесения белка необходимо промыть сорбент буфером, использованным растворения, и далее при элюции также должны использоваться буферы, содержащие подобранное количество детергента.
Мембранные белки с His-тагом солюбилизируются в буферах, содержащих детергент (часто это 1% DDM) или систему детергентов (например, DDM/CHS 5/1). рН белкового раствора обычно выбирают в районе 7−8, (точные концентрации детергентов и pH должны быть подобраны). Колонку перед нанесением на неё солюбилизированного белка необходимо уравновесить в буфере с тем же содержанием детергента, что использовался при растворении мембранной фракции, прокачав через неё около 5-ти объёмов буфера. После нанесения белка необходимо растворения, далее применяют промывку колонки 8 мМ ATФ, промывают колонку буфером с меньшим содержанием детергента, но большим, чем CMC (для DDM это 0.01%). Элюцию белка проводят прокачивая через сорбент буфер с добавлением 300 мМ имидазола (в случае наличия 10 His), после чего удаляют имидазол из фракций диализом или гель-фильтрацией, так как

имидазол дестабилизирует мембранные белки. Все буфера кроме буфера для элюции могут содержать 5-30 мМ имидазола для исключения неспецифического связывания хелатным сорбентом белков.
Билет №6 1.Что такое селективный скрининг? Для чего его применяют?
Применяют для отбора трансформированных клеток, содержащих экспрессионную плазмиду, и для поддержания стабильности плазмидной ДНК во время культивирования. В первом случае важно идентифицировать клетки, содержащие плазмиды с целевым геном, и отделить их от нетрансформированных клеток и клеток, несущих «пустую» плазмиду.
Маркером может служить устойчивость к антибиотикам. Клетки, не содержащие плазмидную конструкцию, не способны расти на среде с антибиотиками и погибают. Этот метод позволяет эффективно отделить трансформированные клетки от нетрансформированных, но не позволяет отделить клетки, несущие плазмиду с целевым геном, от клеток с «пустой» плазмидой.
Посмотрите на всякий случай табличку, мало ли, может спросит, какие антибиотики используют. Всем хорошего вечера))))))))))
