
15 Билет
Описать свойства серной кислоты и перечислить правила работы с кислотами.
Физические свойства:
Чистая серная кислота или моногидрат - это бесцветная маслянистая жидкость, которая застывает в кристаллическую массу при температуре +10°С. Серная кислота - это один из самых основных продуктов в химической промышленности. Она предназначена для производства минеральных удобрений (сульфат аммония, суперфосфат), разнообразных солей и кислот, моющих и лекарственных средств, искусственных волокон, красителей, взрывчатых веществ. Также серная кислота имеет применение в металлургии (например, разложение урановых руд), для очистки нефтепродуктов, для осушки газов и так далее.
Химические свойства серной кислоты:
Взаимодействие с металлами:
а) разбавленная кислота растворяет только те металлы, которые стоят левее водорода в ряду напряжений:
H2+1SO4+ Zn0 = H2O + Zn+2SO4;
б) окислительные свойства серной кислоты велики. При взаимодействии с различными металлами (кроме Pt, Au) она может восстанавливаться до H2S-2 , S+4O2 или S0, например:
2H2+6SO4 + 2Ag0 = S+4O2 + Ag2+1SO4 + 2H2O;
5H2+6SO4 +8Na0 = H2S-2 + 4Na2+1SO4 + 4H2O;
Концентрированная серная кислота H2S+6O4 также реагирует (при нагревании) с некоторыми неметаллами:
2H2S+6O4 + С0 = 2S+4O2 + C+4O2 + 2H2O;
2H2S+6O4 + S0 = 3S+4O2 + 2H2O;
С основными оксидами:
H2SO4 + CuO = CuSO4 + H2O;
С гидроксидами:
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O;
2NaOH + H2SO4 = Na2SO4 + 2H2O;
Взаимодействие с солями при обменных реакциях:
H2SO4 + BaCl2 = 2HCl + BaSO4;
Правила работы с кислотами:
1.При разбавлении крепких кислот надо вливать к-ту в воду, а не наоборот.
2. Если на лицо или на руку попадут растворы кислот или щелочей, то пораженный участок необходимо немедленно промыть большим кол-вом воды, затем протереть слабым раствором соды для нейтрализации к-ты или слабым раствором уксусной к-ты для нейтрализации щелочи.
3. Пролитую кислоту следует засыпать песком. После уборки песка, место, где была разлита кислота, посыпают известью или содой, а затем промывают водой.
4. Работать в лаборатории необходимо в халате, защищая одежду и кожу от попадания и разъедания реактивами.
5. Необходимо быть предельно внимательными при транспортировке сосудов с кислотами. Склянку с кислотой нельзя прижимать руками к груди. Т.к. возможно расплескивание и ожоги. Наливать кислоту нужно в сосуды объемом не более 1л.
6. При работе с дымящей азотной кислотой, олеумом, смесью кислот следует надевать также длинный резиновый фартук.
7.При работе с концентрированными и кислотами необходимо соблюдать следующие меры предосторожности:
- все работы проводить в вытяжном шкафу или под местным вытяжным устройством;
- для переноса малых количеств следует использовать пипетки с резиновыми грушами; засасывать растворы в пипетки ртом запрещается.
Рассчитать, какой объем серной кислоты с массовой долей H2SO4 25% и плотностью 1,18 г/мл необходимо взять для нейтрализации гидроксида калия, объемом 50 мл, с массовой долей КОН 12 % и плотностью 1,1г/мл.
Дано:
ω (H2SO4 ) = 25%
ρ (H2SO4 ) =1.18 г/мл
Vp-pa(KOH)-50 мл
ω (KOH)- 12%
 ρ
(KOH)-
1.1 г/мл
ρ
(KOH)-
1.1 г/мл
Vp-pa(H2SO4 )-?
H2SO4+2KOH = K2SO4 +H2O
1 моль 2 моль
m(KOH)=
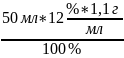 =
6,6 г.
=
6,6 г.
М(KOH)= 56 г/моль
 (KOH)=
(KOH)=
 = 0,118 моль
= 0,118 моль
По уравнению реакции:
(H2SO4
)=
![]() (KOH)=
0,118 моль
*
(KOH)=
0,118 моль
*
 0,06
моль
0,06
моль
М(H2SO4 )=98 г/моль
m(H2SO4 )=98 г/моль * 0,06 моль = 5,77 г
Vр-ра=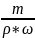 *100%
*100%
Vp-pa(H2SO4
)=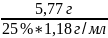 *100%=19,6
мл
*100%=19,6
мл
Ответ: Vp-pa(H2SO4 )= 19,6 мл
3.Истинные растворы, определение, основные понятия, сущность процесса растворения. Диффузия. Осмос. Осмотическое давление.
Истинный раствор - это разновидность раствора в котором размеры частиц растворенного вещества предельно малы и сопоставимы с размером частиц растворителя.
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более составных частей.
Всякий раствор состоит из дисперсной фазы, или растворенных веществ и дисперсионной (непрерывной) фазы, или растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде частиц, молекул или ионов.
Растворителем в большинстве случаем является вода. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. Например, в случае водного раствора соли растворителем является вода. Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Сущность процесса растворения состоит в отделении молекул от поверхности твердого вещества под влиянием их собственного колебательного движения, а также притяжения со стороны молекул растворителя.
Растворы имеют огромное биологическое значение, поскольку являются средой для протекания сложных физико-химических процессов в живых организмах. Растворами являются физиологические жидкости – плазма крови, лимфа, желудочный сок и др. В медицине применяют водные растворы солей, которые по составу соответствуют плазме крови (физиологический раствор). Многие медицинские препараты являются растворами различных веществ в воде или спирте.
Диффу́зия (лат. diffusio — распространение, растекание, рассеивание, взаимодействие) распространение молекул или атомов одного вещества между молекулами или атомами другого, приводящее к самопроизвольному выравниванию их концентраций по всему занимаемому объёму. В некоторых ситуациях одно из веществ уже имеет выравненную концентрацию и говорят о диффузии одного вещества в другом. При этом перенос вещества происходит из области с высокой концентрацией в область с низкой концентрацией.
О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества из объёма с меньшей концентрацией растворенного вещества.
Более широкое толкование явления осмоса основано на применении Принципа Ле Шателье — Брауна: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
