
метода фотометр
.pdfГосударственное бюджетное образовательное учреждение высшего профессионального образования
«Санкт-Петербургская государственная химико-фармацевтическая академия»
Министерства здравоохранения и социального развития Российской Федерации
ФОТОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Методические указания
Санкт-Петербург «Изд-во СПХФА»
2012
УДК 543.061
Ч16
Рецензент
д-р хим. наук К. Н. Зеленин (СПбВМА)
Ч16 Чакчир, Б. А., Алексеева Г. М.
Фотометрические методы анализа : методические указания. — СПб. : Изд-во СПХФА, 2012. — 40 с.
Приведены методические указания по изучению спектрофотомет- риче-ского и фотоколориметрического методов анализа, использованию их для ка-чественного и количественного исследования различных соединений, в том чис-ле и фармацевтических препаратов.
Указания предназначены для студентов фармацевтического факультета и факультета промышленной технологии лекарств.
Рекомендовано методической комиссией фармацевтического факультета
© Санкт-Петербургская государственная химико-фармацевтическая академия, 1999
ВВЕДЕНИЕ
Все химические соединения взаимодействуют с электромагнитным излучением, уменьшая интенсивность его потока.
Абсорбционная спектроскопия основана на измерении умень-шения интенсивности излучения, прошедшего через раствор анализируемого вещества.
Из методов абсорбционной спектроскопии наибольшее распространение получил фотометрический метод анализа. Эффективность его использования обусловлена рядом обстоятельств, важнейшими из которых являются:
—наличие разнообразных фотометрических методик анализа практически на все элементы периодической системы и многочис-ленные органические вещества;
—возможность использования относительно недорогой и доступной аппаратуры;
—возможность фотометрических определений соединений в интервале от 100 до 10–6 %, включая анализ веществ высокой степени очистки.
Специфичность, чувствительность, относительная простота и точность определений, достигаемая с помощью современной аппаратуры, обеспечивает широкое использование метода в раз-личных областях науки и практики.
Фотометрический метод, в частности, успешно применяется для контроля качества лекарственных средств при их производстве и хранении.
3
ФОТОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
1. ОБЩАЯ ХАРАКТЕРИСТИКА МЕТОДА
Фотометрический метод анализа основан на способности определяемого вещества поглощать электромагнитное излучение оптического диапазона. Концентрацию поглощающего вещества определяют, измеряя интенсивность поглощения. Поглощение при определенной длине волны является информацией о качественном и количественном составе определяемого вещества и состав¬ляет аналитический сигнал.
Фотометрический анализ относится к молекулярному абсорбционному анализу, т. е. анализу основанному на поглощении света молекулами анализируемого вещества и сложными ионами в ультрафиолетовой (УФ), видимой и инфракрасной (ИК) областях спектра.
В настоящих указаниях рассматриваются метода анализа, основанные на избирательном поглощении электромагнитного излучения в видимой и ультрафиолетовой областях спектра: фотоколориметрия и спектрофотометрия.
Спектрофотометрический метод анализа — основан на поглоще-
нии монохроматического излучения, т. е. излучения с одной длиной волны в видимой и УФ областях спектра.
Фотоколориметрический метод анализа — основан на поглощении полихроматического (немонохроматического) излучения, т. е. пучка лучей с близкими длинами волны в видимой области спектра. Фотоколориметрию используют в основном для анализа окрашенных растворов.
Оба метода основаны на общем принципе — пропорцио-нальной зависимости между светопоглощением и концентрацией определяемых веществ.
С помощью фотометрического анализа можно определять малые количества вещества, например, содержание примесей не ниже 5 × 10–5 % (спектрофометрически) и 1 × 10–4 % (фотоколо-риметрически) при погрешности определения 1—3 %.
2.СПЕКТРЫ ПОГЛОЩЕНИЯ
2.1.Происхождение молекулярных спектров поглощения
Как известно, внутренняя энергия молекулы складывается из трех основных составляющих: энергии движения электронов (Еэл.), энергии колебаний атомов молекулы (Екол.) и энергии вращения молекулы (Евр.).
4

Е = Еэл. + Екол. + Евр.
При поглощении излучения в видимой и УФ областях спектра происходит изменение электронной составляющей общей энергии. Поэтому мы будем рассматривать энергию движения электронов. Если излучение определенной длины волны проходит через веществ и не поглощается, то энергическое состояние молекулы остается без изменения. Если же излучение поглощается, то молекулы вещества переходят из одного энергетического состояния с меньшей энергией (Е1) в другое энергетическое состояние с большей энергией (Е2). Этот процесс сопровождается поглощением кванта энергии:
Е = Е2 – Е1 = h • ν = h λc |
|
|
, |
(2.1) |
|||
= h c ν |
|||||||
где h — постоянная Планка (6,62 × 10–34 Дж • с), |
|
||||||
ν — частота излучения (с–1, Гц), |
|
||||||
с — скорость света (3 × 1010 см/с), |
|
||||||
λ—длинаволны,нм(1нм=10–9миливмикронах1мк= |
=1•10–6 м), |
||||||
– |
–1 |
). |
|
|
|
|
|
υ — волновое число (см |
|
|
|
|
|
|
|
ν = λ1
Энергия кванта определяет длину волны, а число поглощенных квантов — интенсивность излучения. Обычно энергию электронного перехода относят к молю вещества и выражают в кДж/моль. Зная длину волны и волновое число можно рассчитать энергию электронного перехода.
|
|
|
|
Таблица 1 |
|
Основные области электромагнитного излучения |
|||
№ |
Область электромаг- |
Длина |
Волновое число |
Энергия Е, |
п/п |
нитного излучения |
волны λ, нм |
ν ,см–1 |
кДж/моль |
1. |
Ультрафиолетовая |
|
|
|
|
(УФ) |
|
|
|
|
вакуумная |
100—200 |
(10—5) • 104 |
1200—600 |
|
ближняя |
200—400 |
(5—2,5) • 104 |
600—300 |
2. |
Видимая |
400—750 |
(2,5—1,3) • 104 |
300—160 |
3. |
Инфракрасная (ИК) |
|
|
|
|
ближняя |
750—1560 |
(1,3—0,66) • 104 |
160—80 |
|
|
|
|
|
Изучая поглощение излучения веществом различных длин волн в видимой и УФ областях спектра можно получить электронный спектр поглощения.
5
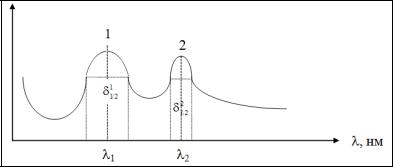
Спектром поглощения называют графическую зависимость интен-
сивности поглощения от длины волны (λ) или волнового числа ( ν). Для каждого поглощающего вещества имеется определенное распределение интенсивности поглощения по длинам волн, при этом на кривой поглощения имеются один или несколько максимумов. Область интенсивного поглощения называется полосой поглощения (рис. 2.1).
По спектру поглощения можно определить состав и строение соединений, т. к. различные функциональные группы характеризуются определенными полосами поглощения в спектре.
2.2. Основные характеристики полосы поглощения
Рис. 2.1. Электронный спектр поглощения молекулы
К основным характеристикам полосы поглощения относятся: длина волны в максимуме поглощения (λмакс), интенсивность поглощения в максимуме εmax, полуширина полосы (δ1/2), которая равна ширине полосы в единицах длин волн или волнового числа при значении интенсивности, составляющей половину интенсивности поглощения в максимуме.
2.3. Основной закон светопоглощения
При прохождении электромагнитного излучения интенсивностью I0 через частично поглощающую среду, например, через раствор с концентрацией поглощающего вещества С (моль/л) и толщиной поглощающего слоя l, часть этого излучения будет поглощаться (In), небольшая часть излучения отражается от стенок кюветы (Iотр.), и часть проходит через раствор (I). Таким образом, интенсивность падающего излучения равна сумме трех составляющих:
I0 = I + Iотр. + In. |
(2.2) |
6
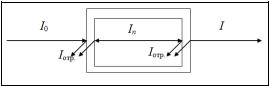
Значение Iотр. очень мало, поэтому это значение можно не учитывать.
Рис. 2.2. Схема поглощения света раствором
Связь между интенсивностями световых потоков I0, I с концентрацией поглощающего вещества и толщиной слоя раствора устанавливает объединенный закон Бугера-Ламберта-Бера. Этот закон выведен для монохрамотического излучения.
I = I0 • 10–ελ • c • l |
(2.3) |
где I0 — интенсивность падающего излучения, |
|
I — интенсивность прошедшего излучения, |
|
с — концентрация поглощающего вещества (моль/л), |
|
l — толщина поглощающего слоя (см), |
|
ελ — молярный коэффициент поглощения (моль–1 л • см–1).
В логарифмической форме закон будет иметь следующий вид:
|
|
lgI = lgI0 – ελ • l • c, |
|
||||||
|
|
lg |
I0 |
|
= ε |
|
• l • c. |
(2.4) |
|
|
|
|
λ |
||||||
|
I0 |
I |
|
|
|
||||
Величину lg |
называют оптической плотностью и обозначают А. |
||||||||
I |
|||||||||
Оптическая плотность характеризует поглощательную способность ве- |
|||||||||
щества. |
|
|
|
А = ελ • l • c |
(2.5) |
||||
При соблюдении основного |
|||||||||
закона светопоглощения, |
оптическая |
||||||||
плотность раствора прямо пропорциональна молярному коэффициенту поглощения, концентрации вещества и толщине поглощающего слоя.
Из выражения (2.5) видно, что если l= 1 см и с= 1 моль/л, то А= ε. Это равенство отражает физический смысл молярного коэффициента поглощения. Молярный коэффициент поглощения характеризует внутренние свойства вещества и зависит от температуры, длины волны электромагнитного излучения и природы вещества. ε не зависит от толщины слоя, концентрации вещества и интенсивности падающего излучения.
В фармацевтической практике часто пользуются значением удельного
коэффициента поглощения Eñ1ì% , что соответствует поглощению 1 %-го раствора вещества при l = 1 см.
7

При этом ε = Eñ1ì% |
Ì |
, |
(2.6) |
10 |
|||
где М — молярная масса вещества. |
|
||
Для характеристики поглощения используют также величину, которая
называется пропусканием, эта величина равна отношению |
|
I |
. |
|
|
|
|||
I |
|
I0 |
||
Т = I0 |
• 100 % |
(2.7) |
||
Связь между значением оптической плотности и пропусканием опре- |
||||
деляется следующей зависимостью: lgT = lg + 2 = 2 – A, |
|
|
|
|
A = 2 – lgT . |
(2.8) |
|||
Величины А и Т меняются в следующих пределах: А = 0, Т = 100 %
до А = ∞, Т = 0. (Например, А = 1, Т = 10 %, А = 2, Т = 1 %.) Отклоне-
ние от закона Бугера-Ламберта-Бера могут быть вызваны физическими и химическими причинами. К физическим причинам относятся: высокая концентрация раствора (> 0,01 моль/л), недостаточная монохроматизация света и рассеивание света. К химическим причинам относятся: процессы ассоциации, диссоциации, протонирования, комплексообразования, которые могут протекать в растворе.
3. АППАРАТУРА И ТЕХНИКА ФОТОМЕТРИЧЕСКИХ ИЗМЕРЕНИЙ
Фотометрические методы определения концентрации веществ в растворах основаны на сравнении поглощения или пропускания света стандартными и исследуемыми растворами. Степень поглощения света фотометрируемыхрастворомизмеряютспомощьюфотоэлектроколориметров и спектрофотометров. Измерение оптической плотности производят по отношению к раствору сравнения (нулевого раствора). В качестве раствора сравнения чаще всего используют растворитель.
3.1. Основные узлы приборов для фотометрических измерений
Независимо от области спектра приборы для измерения пропускания или поглощения света раствором состоят из следую-щих пяти основных узлов (рис. 3.1):
Рис. 3.1. Основные узлы приборов для абсорбционных измерений
8
Источника излучения (1), монохроматора (2), устройства, кото-рое позволяет выделить ограниченную область длин волн, кювет с исследуемым раствором и раствором сравнения (3 и 3’) (приборы комплектуются набором кювет с l= 10 – 0,1 см), преобразователя (4), который превращает энергию излучения в электрический сигнал (фотоэлемент), индикатора сигнала (5) (регистрирующее устройство).
Приборы, применяемые для измерения поглощения растворов, можно классифицировать следующим образом:
1.Поспособумонохроматизациилучевогопотока:приборыспризменным или решетчатым монохроматорами, которые позволяют достигнуть высокой степени монохроматизации рабочего излучения называют спектрофотометрами; приборы, в которых монохроматизация достигается с помощью светофильтров, называют фотоэлектроколориметрами.
2.По способу измерения: однолучевые с прямой схемой измерения, и двулучевые с компенсационной схемой измерения.
3.По способу регистрации измерений: регистрирующие и нерегистрирующие.
3.2.Фотоэлектроколориметры
Фотоэлектроколориметрыпредназначеныдляизмеренияпропускания
или оптической плотности растворов в диапазоне 315—630 нм и определения концентрации растворов фотоколориметрическим методом.
Все приборы снабжены набором узкополосных светофильтров, спектральные характеристики которых приведены в табл. 3.1, которые поглощают большую часть излучения и пропускают ограниченный участок длин волн.
Таблица 3.1
|
Характеристики светофильтров |
||
Маркировка светофильтра |
Длина волны, соответствующая |
||
максимальному пропусканию, нм |
|||
|
|
||
1 |
|
315 + 5 |
|
2 |
|
364 + 5 |
|
3 |
|
400 + 5 |
|
4 |
|
440 + 10 |
|
5 |
|
490 + 10 |
|
6 |
|
540 + 10 |
|
7 |
|
572 + 10 |
|
8 |
|
590 + 10 |
|
9 |
|
630 + 10 |
|
9
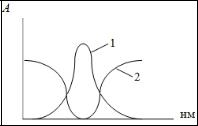
Перед началом проведения измерений необходимо выбрать светофильтр. Светофильтры нужно выбирать так, чтобы максимум пропускания и минимум поглощения светофильтра совпадали бы с максимумом поглощения определяемого вещества (рис. 3.2).
Рис. 3.2. Поглощение излучения: 1 — раствором, 2 — светофильтром
Фотоколориметры применяют в основном для измерения поглощений в видимой области спектра. Если вещество не поглощает электромагнитное излучение в этой области, то его путем химической реакции можно перевести в окрашенный продукт. Кюветы, используемые в фтоколориметрии изготавливают из стекла.
По чувствительности, селективности и точности фотоколориметрические измерения несколько уступают спектрофотометрическим, так как определяется поглощение не монохроматического света, а пучка лучей с определенным интервалом длин волн.
3.3. Спектрофотометры
Спектрофотометры предназначены для измерения пропускания или оптической плотности в диапазоне 190—110 нм. Источником УФ излучения служат водородная или дейтеривая лампа. Данные источники излучают сплошной спектр в интервале 180—375 нм. В одинаковых рабочих условиях дейтеривая лампа дает излучение большей интенсивности, чем водородная.
Для измерения оптической плотности или пропускания в УФ области спектра требуются кюветы из кварцевого стекла, т. к. обычное стекло сильно поглощает это излучение.
Источникомвидимогоизлученияслужитлампанакаливаниясвольфрамовой нитью, излучающая сплошной спектр в области 315—1100 нм.
В спектрофотометрах в качестве устройства для выделения части излучения применяют монохроматоры двух типов: призму и дифракционную решетку, которые позволяют непрерывно менять длину волны.
10
