
метода фотометр
.pdfВЫБОР ОПТИМАЛЬНЫХ УСЛОВИЙ
4. ЧУВСТВИТЕЛЬНОСТЬ ФОТОМЕТРИЧЕСКОГО МЕТОДА. ПОГРЕШНОСТЬ ОПРЕДЕЛЕНИЯ
Дляхарактеристикичувствительностивметодефотометриичащевсего используют минимальную определяемую концентрацию (Сmin, моль/л) и открываемый минимум (m, мкг).
Сmin — это минимальная концентрация элемента вещества в растворе, которую можно определить фотометрическим методом:
Сmin = Аmin/εmax • l, моль/л |
(4.1) |
где Аmin — это минимальное значение оптической плотности, которое можно измерить с помощью приборов, используемых для фотометрических определений.
Чувствительность будет в основном определяться величиной молярного коэффициента поглощения εmax. Если при спектрофотометрическом определении принять ε = 104 моль–1 • л • см–1, толщину слояl= 1 см и минимальное значение оптической плотности 0,01, тоСmin = 0,01/104 • 1 = 10–6 моль/л.
Открываемый минимум (m) — это наименьшее массовое содержание вещества (мкг), которое еще может быть количественно определено данным методом, в определенном объеме (мл).
m = Cmin • V • M = 103 • M • Amin/ εmax • l |
(4.2) |
|||
Обозначим V/l = g — эффективное сечение кюветы (см2) |
|
|||
m = A |
min |
· g · M · 103/ε |
max |
(4.3) |
|
|
|
||
Если принять ε = 104 моль–1 · л · см–1, Amin = 0,01, g = 1 см2, а среднюю молярную массу 100 (г/моль), то получим значение m = 0,1 мкг.
Чувствительность и погрешность фотометрического определения зависит от выбранного интервала длин волн поглощаемого излучения. Чем больше значение молярного коэффициента поглощения, тем больше чувствительность определения. Согласно закону Бугера-Ламберта-Бера наибольшее значение молярный коэффициент поглощения имеет при длине волны (λmax), для которой наблюдается максимальное поглощение.
Следовательно, если проводить определение вещества, при длине волны λmax мы достигнем большей чувствительности.
Для получения хорошо воспроизводимых результатов анализа необходимо правильно выбрать оптимальное значение оптической плотности.
11
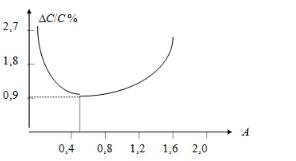
Оптимальной оптической плотностью Аопт. называется та плотность, при которой относительная погрешность в определении концентрации вещества будет минимальна.
Зависимость относительной погрешности определения от оптической плотности представлена на рис. 4.1.
Рис. 4.1. Зависимость относительной погрешности измерения концентрации от оптической плотности раствора
Приведенная кривая показывает, что при А= 0,434 относительная погрешность в определении концентрации составляет ~ 0,9 %, а в интервале оптической плотности от 0,2 до 0,8 — относительная погрешность не превышает 3 %. Значение А = 0,434 называют оптимальной оптической плотность (Аопт.). Следовательно для более точных определений рекомендуется подобрать концентрацию раствора и толщину поглощающего слоя так, чтобы измерения проводились в интервале оптической плотности 0,2—0,8. Однако, толщина поглощающего слоя не должна превышать 5 см, так как с увеличением толщины слоя увеличивается рассеивание света. Чаще всего используют кюветы с l = 1 см. Если вещества очень сильно поглощают, то пользуются разнообразными кюветами с вкладышем, позволяющим уменьшить толщину слоя до 0,01 см.
В реальных условиях погрешность фотометрического определения может достигнуть 5 % из-за погрешностей, возникающих при приготовлении растворов, проведения измерения на приборе и др.
При проведении фотометрического анализа большее значение имеет выбор растворителя. Выбор растворителя должен определяться растворимостью анализируемого вещества и его способностью к поглощению излучения. Растворитель не должен поглощать в исследуемом интервале длин волн. В табл. 4.1 приведены некоторые растворители, используемые в спектрофотометрических методах и их нижний предел пропускания.
12
Таблица 4.1
Предел пропускания излучения некоторых растворителей
Растворители |
Нижний предел пропускания, |
|
(при l = 1 см) |
||
|
||
Вода |
185 |
|
Метанол |
210 |
|
Изопропанол |
210 |
|
Циклогексан |
210 |
|
Ацетонитрил |
212 |
|
Этанол |
220 |
|
Хлороформ |
240 |
|
Бензол |
280 |
|
Толуол |
285 |
|
Ацетон |
330 |
Например, предел пропускания ацетона 330 нм, поэтому нельзя снять спектр вещества в ацетоне, поглощающего при λ < 330 нм.
Таким образом для проведения фотометрического анализа необходимо правильно подобрать условия его проведения. К таким условиям относятся выбор растворителя, длины волны, оптической плотности и связанных с ней толщины поглощающего слоя и концентрации раствора.
5. КАЧЕСТВЕННЫЙ АНАЛИЗ МЕТОДОМ ФОТОМЕТРИИ
Молекулы различных веществ характеризуются своей системой энергетических уровней, поэтому спектры поглощения их будут различаться по числу полос поглощения, их положению в шкале длин волн и интенсивности. Этот факт используют для идентификации и проведения качественного анализа веществ, используя для этого значения λmax и ε max, которые зависят от природы вещества.
Ультрафиолетовые спектры поглощения обычно имеют две-три и более полос поглощения. Для идентификации исследуемого вещества записывают его спектр поглощения в различных растворителях и сравнивают полученные данные с соответствующими спектрами исходных веществ известного состава. Если спектры поглощения исследуемого вещества в разных растворителях совпадают со спектром известного вещества, то делают заключение об идентичности химического состава этих соединений.
При идентификации вещества следует также обратить внимание на интенсивность поглощения. Очень многие органические вещества имеют
13
полосы поглощения, максимумы которых расположены при одинаковой длине волны, но интенсивности их различны. Например, в спектре фенола наблюдается полоса поглощения при λ = 255 нм, для которой ε = 1450. При той же длине волны ацетон имеет полосу поглощения, для которой ε = 17.
Появление полос поглощения в электронных спектрах обусловлено переходами электронов в молекуле вещества между электронными уровнями из основного — в возбужденное состояние.
5.1.Основные типы электронных переходов
Вмолекуле различают:
а) связывающие σ и π-электроны, которые находятся на связывающих σ и π-орбиталях;
б) разрыхляющие σ* и π*-электроны, которые находятся на разрыхляющих орбиталях;
в) несвязывающие n-электроны, которые находятся на несвязывающих п-орбиталях.
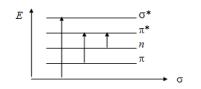
На рис. 5.1 изображены основные типы электронных переходов.
Рис. 5.1. Основные типы электронных переходов в молекуле
Различные электронные переходы требуют неодинаковой энергии и поэтому могут наблюдаться при различных длинах волн и иметь различные значения молярного коэффициента поглощения. Для возбуждения σ → σ* переходов требуется значительная энергия (УФ в вакуумной области, λ = 100—150 нм), т. к. σ — электроны прочно связаны в молекуле. Такие переходы редко реализуются и характеризуются большой интенсивностью. Значительно меньше энергии требуется для осуществления π → π*-перехода. Они наблюдаются в области 200—250 нм и характерны для молекул ароматических соединений с сопряженными связями. Значение коэффициента молярного поглощения для этих переходов равно ~104 л · моль-1 · см-1.
Еще легче возбуждаются наименее прочно связанные п-электроны, поэтому п-π* переходам соответствуют полосы поглощения в области λ = 250—300 нм. Такие переходы характерны для соединений имеющих атомы с неподеленными парами электронов (N, S, O, галогены). Значение
ε ≈ 100 л · моль-1 · см-1.
14
При исследовании электронных спектров поглощения органических молекул — чаще всего имеют место переходы π → π* и п → π*. Все указанные переходы можно отличить друг от друга, исследуя влияние кислотности и природы растворителя на спектр поглощения. Так, например, протонирование затрагивает неподеленную пару электронов, что приводит к исчезновению полосы поглощения п → π* перехода и абсолютно не влияет на полосу поглощения π → π* переходов. При увеличении полярности растворителя полоса п → π* перехода, которая сопровождается увеличением дипольного момента молекул, смещается в область коротких длин волн (гипсохромное смещение), а полоса π → π*, которая сопровождается уменьшением дипольного момента, смещается в длинноволновую область (батохромное смещение).
Многие неорганические соединения, которые имеют d-электро ны (преимущественно комплексные соединения), дают в спектре поглощения малоинтенсивные полосы d → d переходов, которые наблюдаются в видимой области спектра, коэффициенты молярного поглощения, которых составляют ε ~ 10—15 л · моль-1 · см-1. Переходами между d или f- орбиталями обусловлена окраска соединений.
Из изложенного следует, что анализ спектров поглощения веществ в видимой и УФ областях позволяет сделать заключение относительно их строения.Однаконаиболееполнаяиоднозначнаяинформацияостроении соединений может быть получена путем исследования их ИК-спектров.
6. КОЛИЧЕСТВЕННЫЙ ФОТОМЕТРИЧЕСКИЙ АНАЛИЗ
Концентрация исследуемого вещества может быть определена методом фотометрии в том случае, если в спектре поглощения раствора этого вещества имеются ясно выраженные полосы поглощения в УФ и видимой областях спектра.
В основе количественного определения лежит закон Бугера — Ламберта — Бера, который устанавливает прямопропорциональную зависимость между оптической плотностью и концентрацией вещества в исследуемом растворе. С помощью фотометрии можно проводить анализ как индивидуальных веществ, так и их смесей.
6.1.Методы определения индивидуальных веществ
6.1.1.Метод градуировочного графика
Записывают спектр поглощения раствора вещества и находят длину волны, соответствующую максимуму поглощения. Затем готовят серию стандартных растворов с различным содержанием определяемого компо-
15
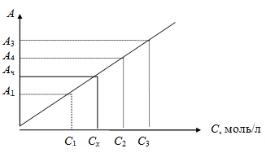
нента и измеряют их оптическую плотность при выбранной длине волны и толщине слоя. Необходимо, чтобы выбранный интервал концентрации соответствовал области возможных изменений концентраций анализируемых растворов. Строят градуировочный график в координатах А ÷ C. В случае подчинения закону Бугера — Ламберта — Бера и при измерении оптической плотности относительно растворителя, график представляет собой прямую (рис. 6.1), проходящую через начало координат. Измеряют оптическую плотность исследуемого раствора Ах и по графику находят концентрацию Сх вещества в растворе.
Рис. 6.1. Градуировочный график
Более точные результаты получают при построении графика методом наименьших квадратов.
При построении градуировочного графика различают три варианта:
—график для стандартных растворов, не содержащих посторонние вещества, построенный при оптимальных условиях;
—график, построенный в присутствии отдельных посторонних компонентов;
—график, построенный по стандартным растворам, содержащим все компоненты анализируемых объектов.
6.1.2. Метод стандартного раствора (метод сравнения)
В этом методе сравнивают поглощение исследуемого раствора и стандартного Аст. с известной концентрацией. Расчет концентрации Сх проводят по формуле, исходя из закона Бугера — Ламберта — Бера:
Cx = |
Ax Cñ ò |
. . |
(6.1) |
|
Àñ ò. |
||||
|
|
|
Измерения проводят с несколькими стандартными растворами, близкими по концентрации к исследуемому, и усредняютСх. Этот способ требует строгого подчинения поглощения закону Бугера — Ламберта — Бера.
16

6.1.3. Метод добавок
В этом методе сначала измеряют оптическую плотность анализируемого раствора Ах, объем которого равен Vx, далее добавляют в раствор небольшой объем раствора того же вещества (V0) с известной концентрацией С0 и находят оптическую плотность Ах+g после добавки. При условии подчинения закону Бугера — Ламберта — Бера величину Сх рассчитывают из следующих уравнений:
|
Ax |
|
|
Cx |
; |
|
C0 V0 |
; |
|
||
|
|
=Cx +Cg |
Cg =Vx +V0 |
(6.2) |
|||||||
Ax+g |
|||||||||||
|
Cx = |
|
|
C0 |
V0 |
|
. |
|
(6.3) |
||
|
|
Ax+g |
|
|
|
|
|
||||
|
|
|
|
|
(Vx +V0 )−Vx |
|
|
||||
|
|
|
Ax |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||
Метод добавок обычно применяют для устранения мешающего действия посторонних примесей, а также в ряде случаев для оценки правильности методики определений. Этот метод позволяет создать одинаковые условия для фотометрирования исследуемого раствора и раствора с добавкой, поэтому его целесообразно применять для определения небольших количеств различных соединений в присутствии больших количеств посторонних веществ. Метод добавок требует обязательного соблюдения основного закона светопоглощения.
6.1.4. Метод дифференциальной фотометрии
Дифференциальныйметодприменяютдляповышениявоспроизводимости результатов анализа при определении больших количеств веществ, когда нарушается основной закон светопоглощения или когда значения оптических плотностей выходят за пределы шкалы прибора, а дальнейшее разбавление раствора может привести к увеличению погрешности определения.
Сущность метода состоит в том, что оптические плотности исследуемого и стандартных растворов измеряют не по отношению к чистому растворителю с нулевым поглощением, а по отношению к раствору определяемого вещества с концентрацией С0 близкой к концентрации исследуемого раствора.
Полученноезначениеоптическойплотностиназываютотносительной оптической плотностью (Аотн.).
Аотн. = Ах – А0 = ε · l (Cx – C0) (6.4)
где Аотн. — относительная оптическая плотность, Ах — оптическая плотность исследуемого раствора, А0 — оптическая плотность раствора сравнения,
Cx — концентрация вещества в анализируемом растворе, моль/л, C0 — концентрация вещества в растворе сравнения, моль/л,
ε — молярный коэффициент поглощения, А · моль–1см–1.
17
С помощью дифференциальной фотометрии анализируют концентрированные растворы, у которых оптическая плотность больше 1. Так, например, при измерении оптической плотности по отношению к растворителю получили А = 1,3, измерение такого значения оптической плотности недостаточно точно. Если мы в качестве раствора сравнения возьмем раствор анализируемого вещества с А0 = 0,8, то получим Аотн. = 0,5, что соответствует оптимальным условиям измерения (разд. 4). Метод дифференциальной фотометрии является наиболее точным методом.
Рассчитать концентрацию вещества в методе дифференциальной фотометрии можно с использованием градуировочного графика или методом стандарта.
При построении градуировочного графика в дифференциальной фотометрии различают два варианта: метод односторонней дифференци-
альной фотометрии и метод двухсторонней дифференциальной фо-
тометрии.
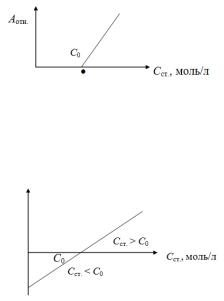
В методе односторонней дифференциальной фотометрии для построения градуировочного графика используют раствор сравнения с концентрацией меньшей, чем концентрации стандартных растворов, т. е. С0 < Cст. Графическая зависимость имеет вид, представленный на рис. 6.2.
Рис. 6.2. Градуировочный график при односторонней дифференциальной фотометрии
В методе двухсторонней дифференциальной фотометрии используют стандартные растворы с концентрацией большей и меньшей, чем концентрация раствора сравнения (рис. 6.3).
Рис. 6.3. Градуировочный график при двухсторонней дифференциальной фотометрии
18
В случае, когда концентрация раствора сравнения С0 больше, чем концентрация стандартного раствора Сст., то значения Аотн. берут со знаком минус.
Приприменениидлярасчетаконцентрациивеществавдифференциальной фотометрии метода сравнения используют следующие соотношения:
|
Aî òí,.x |
= |
|
Ñx −C0 |
|
|
|
|||
Aî òí,.ñò. |
|
|
Cñ ò. −Ñ0 |
(6.5) |
||||||
Cx =C0 + |
|
Aî òí., õ (Ññ ò. −Ñ0 ) |
(6.6) |
|||||||
|
|
|
|
Aî òí,.ñò. |
|
|||||
|
|
|
|
|
|
|
|
|||
Cñ ò. −Ñ0 |
= F |
|
|
(фактор пересчета) |
(6.7) |
|||||
Àî òí,ñ. ò. |
|
|
||||||||
|
|
|
|
|
|
|
|
|
||
Сх = С0 + F · Aотн., х |
(6.8) |
|||||||||
Готовят серию стандартных растворов и измеряют оптическую плотность каждого раствора по отношению к первому, затем всех последующих — по отношению ко второму и т. д. По формуле (6.7) вычисляют фактор F и находят его среднее значение. При определении концентрации неизвестного раствора измеряют Аотн., х этого раствора по отношению к одному из растворов стандартной серии, оптическая плотность которого наиболее близка к оптической плотности анализируемого раствора и рассчитывают концентрацию Сх по уравнению (6.8).
В дифференциальной фотометрии используют специальные приемы выбора раствора сравнения с целью повышения точности определения. Для этого готовят серию стандартных растворов с одинаковой разностью концентраций ∆С, при этом соответствующая им разность оптической плотности ∆А должны быть равны 0,3—0,4. Затем измеряют оптическую плотность каждого последующего раствора по сравнению с предыдущим и рассчитывают текущее значение
εi = Ai/∆Ci и εi · С0,
где С0 — концентрация раствора сравнения в данном измерении. Тот раствор, для которого значение εi ·С0 будет наибольшим и исполь-
зуют в качестве раствора сравнения.
Методы дифференциальной спектрофотометрии и фотоколориметрии находят все большее применение при анализе лекарственных веществ. Например, этим методом определяют спазмолитин, апрофен, анальгин, амидопирин. Погрешность определения в методе дифференциальной фотометрии составляет 0,5—1,0 %.
19
6.2.Методы определения смеси веществ
Вданном разделе будут рассмотрены примеры определения смеси веществ, состоящих из двух компонентов. Для смеси поглощающих веществ, если они не взаимодействуют друг с другом, наблюдается аддитивность оптической плотности:
Аобщ. =(А1 +А2 +А3 + ... +Ап)=(ε1 ·с1 + ε2 ·с2 + ε3 ·с3 + ... +εп ·сп) ·l (6.9)
В зависимости от поглощения компонентов, различают несколько вариантов анализа смесей.
6.2.1. Спектры поглощения определяемых компонентов накладываются друг на друга в широком интервале длин волн
Измерение оптической плотности смеси приводят при двух длинах волн и, используя свойство аддитивности оптической плотности, составляют систему из двух уравнений:
A = ελ1 |
c l+ ελ1 c l |
(6.10) |
|||||
|
λ1 |
1 |
|
1 |
2 |
2 |
|
|
|
|
c l+ ελ2 |
c l |
|
||
A = ελ21 |
|
||||||
|
λ2 |
1 |
|
1 |
2 |
2 |
|
Значение молярных коэффициентов поглощения либо берут из таблицы, либо, чаще всего определяют экспериментально при тех длинах волны, при которых проводят фотометрирование с использованием стандартных растворов индивидуальных веществ. Полученные значения коэффициентов светопоглощениея подставляют в систему уравнений (6.11) и решают ее относительно С1 и С2.
C1 |
= |
|
Aλ2 ελ1 − Aλ1 ελ2 |
|
||||
ελ1 ελ2 |
−ελ2 ελ2 |
|
||||||
|
|
|
|
1 |
|
2 |
|
|
|
|
2 |
1 |
1 |
2 |
|
|
|
C2 |
= |
|
Aλ2 ελ1 − Aλ1 ελ2 |
|
||||
|
ελ1 ελ2 |
− ελ2 ελ1 |
|
|||||
|
|
|
|
1 |
|
1 |
|
|
|
|
2 |
1 |
1 |
2 |
|
(6.11) |
|
Количественное определение смеси двух компонентов в случае налагающихся спектров можно проводить только спектрофотометрическим методом, фотоколориметрически этот анализ практически осуществить невозможно.
6.2.2. Спектры поглощения определяемых компонентов частично накладываются друг на друга
В этом случае можно найти область длин волн, где один компонент поглощает, а другой — нет.
Примером такого определения спектрофотометрическим методом является определение смеси лекарственных веществ папаверина гидрохло-
20
