- •171. Трансляция - как процесс реализации генетической информации в структурах синтезируемых на рибосомах полипептидныx цепей
- •87 Синтез гликогена и гликогенолиз-распад
- •18. Фосфопиридоксаль и его роль в клеточном метаболизме. Представление о реакциях трансаминирования.
- •2.(Хз какой вопрос такого в вопроснике нет)Зависимость скорости ферментативной реакции от концентрации субстрата.
- •133. Биосинтез кефалина и лецитина и их биологическая роль(см.135)
- •22. Пантотеновая кислота и ее роль в клеточном метаболизме.
- •4) (Хз какой)механизм действия катехоламинов на клетки-мишени
- •2.Метаболические превращения пвк.
- •5.Протеинурия
- •3. Биосинтез гема и его регуляция. Химизм реакций до порфобилиногена, представление о дальнейших путях синтеза гема. Порфирии.
- •4.Пантотеновая кислота и ее роль в клеточном метаболизме.
- •5.В норме глюкоза в моче отсутствует или обнаруживается в минимальных количествах, в общем анализе мочи не выявляющихся. Повышение уровня (глюкозурия):
2.(Хз какой вопрос такого в вопроснике нет)Зависимость скорости ферментативной реакции от концентрации субстрата.
При низких концентрациях субстрата скорость прямо пропорциональна его концентрации, далее с ростом концентрации скорость реакции увеличивается медленнее, а при очень высоких концентрациях субстрата скорость практически не зависит от его концентрации и достигает своего максимального значения (Vmax). При таких концентрациях субстрата все молекулы фермента находятся в составе фермент-субстратного комплекса, и достигается полное насыщение активных центров фермента, именно поэтому скорость реакции в этом случае практически не зависит от концентрации субстрата.

График
зависимости активности фермента от
концентрации субстрата описывается
уравнением Михаэлиса – Ментен.

где v – скорость ферментативной реакции; [S] – концентрация субстрата; KM – константа Михаэлиса. К.М-концентрация при которой скорость реакции составляет половину максимальной. характеризует каталитическую активность фермента,чем она меньше,тем выше активность фермента.
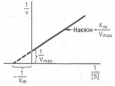
График Лайнуивера-Бэрка.
Тангенс угла наклона который будет равен величине Km/Vmax; отрезок, отсекаемый прямой от оси ординат, представляет собой l/Vmax (обратная величина максимальной скорости). Величину Km можно вычислить из данных наклона прямой и длины отрезка, отсекаемого от оси ординат, или из длины отрезка, отсекаемого от оси абсцисс в области отрицательных значений.
133. Биосинтез кефалина и лецитина и их биологическая роль(см.135)
Кефалины в тканях (главным образом в составе нервной ткани). Кефалины принимают участие в переносе жирных кислот от печени к другим органам и обратно. При недостаточном образовании кефалинов в печени возникает ее ожирение. Кефалины играют определенную роль в процессах свертывания крови, способствуя превращению протромбина в активный тромбин. Кроме того, кефалины, входя в состав цитоплазматических мембран, определяют их проницаемость для других соединений.
 Лецитин
является ПАВ(поверхностно активное
в-во). В присутствии двух несмешиваемых
жидких фаз, лецитин понижает поверхностное
натяжение и действует как эмульгатор,
содержится во всех без исключения
исследованных животных и растительных
тканях и почти во всех жидкостях
животного организма; особенно его много
в мозгу, нервах, яичном желтке, икре.
Является структурным компонентом
билипидной клеточной оболочки,
обеспечивающей гомеостаз клетки.
Липотропные
факторы
(холин, метионин, витамин В12, фолиевая
к-та) – в-ва, способствующие синтезу
ФЛ(фосолипиды) и препятствующие синтезу
ТАГ(триацилглицерины). При недостатке
липотропных факторов развивается
жировое перерождение печени.
Лецитин
является ПАВ(поверхностно активное
в-во). В присутствии двух несмешиваемых
жидких фаз, лецитин понижает поверхностное
натяжение и действует как эмульгатор,
содержится во всех без исключения
исследованных животных и растительных
тканях и почти во всех жидкостях
животного организма; особенно его много
в мозгу, нервах, яичном желтке, икре.
Является структурным компонентом
билипидной клеточной оболочки,
обеспечивающей гомеостаз клетки.
Липотропные
факторы
(холин, метионин, витамин В12, фолиевая
к-та) – в-ва, способствующие синтезу
ФЛ(фосолипиды) и препятствующие синтезу
ТАГ(триацилглицерины). При недостатке
липотропных факторов развивается
жировое перерождение печени.
22. Пантотеновая кислота и ее роль в клеточном метаболизме.
а нтидерматитный
фактор, витамин группы
В; по химической природе — дипептид,
состоящий из остатков аминокислоты
b-аланина и пантоевой кислоты. В клетках
животных и растений П. к. входит в состав
кофермента
А
(KoA), принимающего участие в важнейших
реакциях обмена веществ. П. к. содержится
в очень многих продуктах (дрожжи, икра
рыб, печень крупного рогатого скота,
яичный желток, зелёные части растений,
молоко). П. к. синтезируется также
кишечной
флорой.
нтидерматитный
фактор, витамин группы
В; по химической природе — дипептид,
состоящий из остатков аминокислоты
b-аланина и пантоевой кислоты. В клетках
животных и растений П. к. входит в состав
кофермента
А
(KoA), принимающего участие в важнейших
реакциях обмена веществ. П. к. содержится
в очень многих продуктах (дрожжи, икра
рыб, печень крупного рогатого скота,
яичный желток, зелёные части растений,
молоко). П. к. синтезируется также
кишечной
флорой.
П.к., попадая в организм, превращается в пантетин, который входит в состав кофермента А, играющий важную роль в процессах окисления и ацетилирования. Пантонетовая кислота требуется для обмена жиров, углеводов, аминокислот, синтеза жизненно важных жирных кислот, холестерина, гистамина, ацетилхолина, гемоглобина.
5. Протеинурия – это повышенное содержание белка в моче.
В почках находятся фильтры, называемые клубочками. Они фильтруют кровь и удаляют ядовитые и ненужные вещества, с последующим направлением их в мочу для последующего вывода из организма. Появление повышенного содержания белка в моче, может свидетельствовать о нарушении работы этого защитного механизма.
Иногда при протеинурии присутствуют такие симптомы, как отек, наличие крови или гноя в моче, однако в большинстве случаев протеинурия бессимптомна.
Существует несколько видов протеинурии:
Протеинурия застойная (сердечная) – вызывается застоем крови в почках при сердечной недостаточности;
Протеинурия истинная (почечная, сывороточная) – вызывается нарушением фильтрационной способности почек;
Протеинурия ложная - вызывается попаданием белка в мочу при ее прохождении по мочевым путям, пораженным воспалительным или деструктивным процессом;
Протеинурия лордотическая (ортостатическая) – вызывается поясничным лордозом, вызывающим венозный застой в почках.
Протеинурия пальпаторная – появляется после бимануальной пальпации почки;
Протеинурия пароксизмальная – кратковременное проявление протеинурии, появляющееся после гипертонического или вегетативного криза, а также эпилептического припадка;
Протеинурия спортсменов – появляется после большой физической нагрузки;
Протеинурия транзиторная (функциональная) – появляется на короткое время после мышечного напряжения или переедания;
Причинами протеинурии могут быть заболевания почек, такие как острый и хронический гломерулонефрит, пиелонефрит, нефропатия беременных и др., или заболевания мочевыводящих путей, например, воспаление мочевого пузыря, предстательной железы, мочеточников.
Протеинурия обнаруживается с помощью анализа мочи.
У здоровых людей нормой является выделение в мочу около 150 ( в некоторых случаях до 300) мг. белка в сутки. Если в моче наличествует большее количество белка, то это свидетельствует о том, что нарушена проницаемость гломерулярных мембран клубочков.
Такие виды протеинурии, как протеинурия спортсменов, пароксизмальная, транзиторная не требуют лечения и являются кратковременными. В более тяжелых случаях (протеинурия застойная, истинная, лордотическая) прежде всего, необходимо лечить причину, вызвавшую протеинурию, так как она (протеинурия) является лишь следствием болезни.
Рекомендуется регулярно сдавать анализ мочи, для раннего выявления и лечения протеинурии и заболеваний, ее вызывающих.
БИЛЕТ №6
1) (51) Представление о процессах окислительного фосфорилирования. Дыхательный контроль, разобщающие агенты. Окислительное фосфолирование - образование АТФ из аденозиндифосфорной и фосфорной к-т за счет энергии, освоб-ся при ок-ии орг. в-в в живых кл. Каждая ок. р-ция в соответствии с величиной высвобождаемой энергии «обслуживается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. Соотв-но своим ок-восст. потенциалам эти соединения в восстановленной форме подключаются к дыхат. цепи. Разобщение процессов дыхания и окислительного фосфорилирования происходит если протоны начинают проникать через внутреннюю мембрану митохондрий. В этом случае выравнивается градиент рН и исчезает движущая сила фосфорилирования. Хим. в-ва - разобщители называются протонофорами, они способны переносить протоны через мембрану. К таковым относятся 2,4 -динитрофенол, гормоны щитовидной железы и др. В норме скорость митохондриального транспорта электронов регул-ся содержанием АДФ. Выполнение кл. ф-ций с затратой АТФ приводит к накоплению АДФ, к-й в свою очередь активирует тканевое дыхание. Т. о., клеткам свойственно реагировать на интенс-ть клет. метаболизма и поддерживать запасы АТФ на необходимом уровне. Это свойство называется дыхательным контролем.
2) (107-8) Пентозофосфатный путь превращения глюкозы.
служит альтернативным путём окисления глюкозо-6-фосфата. Ссостоит из окислительной и неокислительной частей. В окислит. фазе глюкозо-6-фосфат необратимо ок. в пентозу - рибулозо-5-фосфат, и образуется восстановленный НАДФН. В неокислит. фазе рибулозо-5-фосфат обратимо превращ. в рибозо-5-фосфат и метаболиты гликолиза. Пентозофосфатный путь обеспечивает кл. рибозой для синт. пуриновых и пиримидиновых нуклеотидов и гидрированным коферментом NADPH, который используется в восст. процессах.
Суммарное уравнение пентозофосфатного пути выражается :
3 Глюкозо-6-фосфат + 6 NADP+ → 3 СО2 + 6 (NADPH + Н+) + 2 Фруктозо-6-фосфат + Глицеральдегид- 3 -фосфат.
Ферменты пентозофосфатного пути локализованы в цитозоле.Наиболее активно протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках.
Превращение глюкозо-6-фосфата в глюконолактон-6-фосфат - катал. НАДФ-зав. глюкозо-6-фосфатдегидрогеназой и сопров. окисл. альдегидной гр. у первого атома углерода и образованием одной молекулы НАДФН.
Глюконолактон-6-фосфат превращается в 6-фосфоглюконат при уч. глюконолактонгидратазы.
6-фосфоглюконатдегидрогеназа катал. реакцию в ходе которой происх дегидрир и декарбокс. и обр-ся рибулозо-5-фосфат и молекула НАДФН .
НАДФН как донор водорода участвует в анаб. пр-сах, например в синт. холестерина. Это источник восстановит. эквивалентов для цитохрома Р450, катализирующего обр. гидроксильных групп при синтезе стероидных гормонов, жёлчных к-т.
Неокислит. этап пентозофосфатного пути включает серию обратимых р-ций, в рез-те к-х рибулозо-5-фосфат превращ. в рибозо-5-фосфат и ксилулозо-5-фосфат, и далее за счёт переноса углеродных фрагментов в метаболиты гликолиза - фруктозо-6-фосфат и глицеральдегид-3-фосфат. В этих превращ. принимают участие: эпимераза, изомераза, транскетолаза и трансальдолаза. Транскетолаза в качестве кофермента использует тиаминдифосфат.
 Для
эритроцитов
единственным источником получения
НАДН служит пентозофосфатный путь.
необх. для защиты от токсич. действия
кислорода. В эритроцитах многие ферменты
имеют в актив. центрах SH-группы, к-е
могут окисляться под дейст. кислорода.
НАДФН регенер. эти гр.
Для
эритроцитов
единственным источником получения
НАДН служит пентозофосфатный путь.
необх. для защиты от токсич. действия
кислорода. В эритроцитах многие ферменты
имеют в актив. центрах SH-группы, к-е
могут окисляться под дейст. кислорода.
НАДФН регенер. эти гр.

3) (137)Химическое строение холестерина и его медико-биологическое значение. Роль холестерина и его эфиров в построении биологических мембран. Регуляция синтеза и активности ГМГ-редуктазы.
Холестерол - стероид, харак. только для жив. орг. Он синт-ся во многих тк. человека, но основное место синт. - печень. Входит в сост. всех мембран кл. и влияет на их св-ва, служит исход. субстратом в синт. жёлч. к-т и стер. гормонов. Предш. в метаболич. пути синтеза холестерола превращ. также в убихинон - комп. дыхат.й цепи и долихол, уч. в синтезе гликопрот. Этериф. холестерол преобл. в крови и запасается в небол. кол-вах в некоторых типах клеток, исп. его как субстрат для синтеза других в-в. Сод-е холестерола увелич. по напр. к наруж. стороне плазмат. мембр. Встр. между фосфолип.. гидроксильная гр. контакт. с водной фазой. Огранич. текчесть при выс. t и поддерж. текчесть при более низких t.
Холестерол и его эфиры - гидрофоб. молек., поэтому они транспорт. кровью в сост. ЛП.
Синтез холестерола можно разделить на 3 этапа. 1ый этап заканчивается образованием мевалоната. 2 мол. ацетил-КоА конденс. тиолазой с обра-м ацетоацетил-КоА. Гидроксиметилглутарил-КоА-синтаза присоединяет третий ацетильный остаток с образованием 3-гидрокси-3-метилглутарил-КоА.
Происходит восстановление ГМГ-КоА до мевалоната с исп. 2 молек. НАДФН.
На 2ом этапе синтеза мевалонат превращ. в изопентенилпирофосфат. Продукт конденсации 2 изопреновых единиц - геранилпирофосфат. Присоед. ещё 1 изопреновой ед. приводит к обр. фарнезилпирофосфата. 2 молек. фарнезилпирофосфата конденсируются с образованием сквалена - углеводорода линейной структуры, состоящего из 30 углеродных атомов.
На 3м этапе синтеза холестерола сквален через стадию образования эпоксида циклазой превращ. в молек. ланостерола, сод. 4 конденсированных цикла и 30 атомов углерода. Далее происходит 20 последовательных реакций, превращающих ланостерол в холестерол.
Регуляторной реакцией явл. превращение ГМГ-КоА в мевалонат, катализ. ГМГ-КоА-редуктазой, которая регулируется изм.кол-ва фермента, под действием инсулина ГМГ-редуктаза десфосфорилируется и активируется, под действием глюкагона происх.фосфорилирование и торможение синтеза холестерина. Экзогенный холестерол, поступающий в клетки печени, может ингибировать синтез эндогенного холестерола, замедляя скорость синтеза ГМГ-КоА-редуктазы.
4. (20) Биотин, его строение и биологические функции.
Биотин: содерж.в печени, почках и др.;синтез.микрофлорой. Недост — дерматит,поражение ногтей,волос, себоррея.содержат — дрожжи,печень,яичный белок,злаки.потребность - 150-200мкг
Антисеборейный витамин,кофермент биоцитин - участвует в переносе Со2,т.е. в карбоксилировании или транскарбоксилировании. С его участием протекают биосинтез жирных кислот, биосинтез ЩУК(из пировиноградной), превращение пропионовый кислоты в янтарную.
Биотин является кофактором в метаболизме жирных кислот, лейцина и в процессе глюконеогенеза.
5). Мочевая кислота выводит избыток азота из организма человека. Мочевая кислота синтезируется в печени и в виде соли натрия содержится в плазме крови.
За выведение мочевой кислоты из крови человека отвечают почки. При нарушении деятельности почек, происходит нарушение обмена мочевой кислоты. Как следствие — накопление в крови солей натрия, уровень мочевой кислоты растет, вызывая разнообразные повреждения органов и тканей.
Норма мочевой кислоты для детей до 14 лет — 0,120 — 0,320 ммоль/л, для взрослых женщин — 0,150 — 0,350 ммоль/л. Для взрослых мужчин норма уровня мочевой кислоты —0, 210 — 0,420 ммоль/л.
Причины повышения мочевой кислоты
Повышение мочевой кислоты или гиперурикемия — основной симптом первичной и вторичной подагры.
В диагностике подагры анализ мочевой кислоты имеет важное значение. Поскольку первичная подагра может протекать бессимптомно, проявляясь только в повышении уровня мочевой кислоты. Вторичная подагра может быть вызвана нарушениями в работе почек, злокачественными образованиями, разрушениями тканей или голоданием. Первичная подагра развивается на фоне замедления вывода мочевой кислоты из организма или при преизбыточном синтезе мочевой кислоты. Кристаллы мочевой кислоты могут откладываться в суставах, подкожной клетчатке, почках.
БИЛЕТ №8
1)(36).Особенности ферментативного катализа

1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S). 2. Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов (E-X) за одну или несколько стадий. 3. Превращение переходного комплекса в комплекс фермент-продукт (E-P). 4. Отделение конечных продуктов от фермента. Специфичность, т.е. высокая избирательность действия ферментов, основана на комплементарности структуры субстрата и активного центра фермента. Бывает стереоспецифичность – катализ только одного из стереоизомеров, Абсолютная специфичность – фермент производит катализ только одного вещества. Например,расщепление мочевины уреазой. Групповая специфичность – катализ субстратов с общими структурными особенностями, т.е. при наличии определенной связи или химической группы Механизмы катализа: 1. Кислотно-основной– в активном центре фермента находятся группы специфичных аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов.Такие группы представляют собой мощные катализаторы многих органических реакций. 2. Ковалентный – ферменты реагируют со своими субстратами, образуя при помощи ковалентных связей очень нестабильные фермент-субстратные комплексы, из которых в ходе внутримолекулярных перестроек образуются продукты реакции.
2)(94).Гликолиз– это последовательность ферментативных реакций, приводящих к превращению глюкозы в пируват с одновременным образованием АТФ.При аэробных условиях пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, как это может иметь место в активно сокращающейся мышце,пируват превращается в лактат. Анаэробный гликолиз – сложный ферментативный процесс распада глюкозы, протекающий в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется АТФ. Суммарное уравнение гликолиза можно представить следующим образом:

В анаэробных условиях гликолиз – единственный процесс в животном организме, поставляющий энергию. Именно благодаря гликолизу организм человека и животных определенный период может осуществлять ряд физиологических функций в условиях недостаточности кислорода. В тех случаях, когда гликолиз протекает в присутствии кислорода, говорят об аэробном гликолизе Последовательность реакций анаэробного гликолиза, так же как и их промежуточные продукты, хорошо изучена. Процесс гликолиза катализируется одиннадцатью ферментами, большинство из которых выделено в гомогенном, клисталлическом или высокоочищенном виде и свойства которых достаточно известны. Заметим, что гликолиз протекает в гиало-плазме (цитозоле) клетки.Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой:

Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.Наиболее важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, т.е. последний служит одновременно и продуктом реакции, и аллостерическим ингибитором. Фермент гексокиназа способен катализировать фосфорилирование не только D-глюкозы, но и других гексоз, в частности D-фруктозы, D-маннозы и т.д. В печени, кроме гексокиназы, существует фермент глюкокиназа, который катализирует фосфорилирование только D-глюкозы. В мышечной ткани этот фермент отсутствуетВторой реакцией гликолиза является превращение глюкозо-6-фос-фата под действием фермента глюкозо-6-фосфатизомеразы во фруктозо-6-фосфат:

Эта реакция протекает легко в обоих направлениях, и для нее не требуется каких-либо кофакторов.Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ:

Данная реакция аналогично гексокиназной практически необратима, протекает в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. Фактически эта реакция определяет скорость гликолиза в целом. Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АМФ . При значительных величинах отношения АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза. Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:

Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидро-ксиацетонфосфата и глицеральдегид-3-фосфата).Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой:

Равновесие данной изомеразной реакции сдвинуто в сторону дигид-роксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глице-ральдегид-3-фосфата. В последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозыди-гидроксиацетонфосфат превращается в глицеральдегид-3-фосфат. Образованием глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая стадия – наиболее сложная и важная. Она включает окислительно-восстановительную реакцию (реакция гликолитической оксидоредукции), сопряженную с субстратным фосфорилированием, впроцессе которого образуется АТФ. В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАД (НАДН). Эта реакция блокируется йод- или бромацетатом, протекает в несколько этапов

1,3-Бисфосфоглицерат представляет собой высокоэнергетическое соединение (макроэргическая связь условно обозначена знаком «тильда» ~). Механизм действия глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп последнего. Образовавшаяся связь богата энергией, но она непрочная и расщепляется под влиянием неорганического фосфата, при этом образуется 1,3-бисфосфоглицериновая кислота.Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфогли-цериновой кислоты (3-фосфоглицерат):

Таким образом, благодаря действию двух ферментов (глицеральде-гидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ. В отличие от окислительногофосфорилирования образование АТФ из высокоэнергетических соединений называется субстратным фосфорилированием. Восьмая реакция сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту (2-фосфоглицерат).Реакция легкообратима, протекает в присутствии ионов Mg2+. Кофактором фермента является также 2,3-бисфосфоглицериновая кислота аналогично тому, как в фосфоглюкомутазной реакции роль кофактора выполняет глюкозо-1,6-бисфосфат:

Девятая реакция катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится высокоэргической:

Енолаза активируется двухвалентными катионами Mg2+или Мn2+ и ингибируется фторидом.Десятая реакция характеризуется разрывом высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ (субстратное фосфорилирование). Катализируется ферментом пируваткиназой:

Для действия пируваткиназы необходимы ионы Mg2+, а также одновалентные катионы щелочных металлов (К+ или др.). Внутри клетки реакция является практически необратимой.В результате одиннадцатой реакции происходит восстановление пировиноградной кислоты и образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН, образовавшегося в шестой реакции:

Биологическое значение процесса гликолиза заключается прежде всего в образовании богатых энергией фосфорных соединений. На первых стадиях гликолиза затрачиваются 2 молекулы АТФ (гексокиназная и фосфофрук-токиназная реакции). На последующих образуются 4 молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза в анаэробных условиях составляет 2 молекулы АТФ на одну молекулу глюкозы.
3)(144 145) Образование кетоновых тел… Под термином «кетоновые (ацетоновые) тела» подразумевают ацетоук-сусную кислоту (ацетоацетат) СН3СОСН2СООН, β-оксимасляную кислоту (β-оксибутират, или D-3-гидроксибутират) СН3СНОНСН2СООН и ацетон СН3СОСН3.В здоровом организме ацетон в крови присутствует в крайне низких концентрациях, образуется в результате спонтанного декарбоксилированияацетоацетата и, по-видимому, не имеет определенного физиологического значения.Кетоновые тела образуются в печени. При голодании глюкагон(адреналин при тяж.физ.работе) ч/з аденилатциклазную с-му в жировой ткани активирует распад жира. Жир.к-ты выделяются в кровь и транспортируются в комплексе с альбуминами. Концентрация ацетил-КоА повышена в рез-те активного b-окисления, и исп.для синтеза кетоновых тел. регуляция этого синтеза осущ.за счет ГМГ-КоАсинтазы. Печень, эритроциты не окисляют кетоновые тела и исп. их только на «экспорт».При длительном головании, когда печень выраб.ок.50%жир.к-т в др.источникиобр.кетоновые тела- b-гидроксибутират, ацетоацетат, ацетон. В норме их число 1-3мг/дл. Их кл-во так же увелич. При длит.физ.нагрузке, употреблении пищи, богатой жирами, но с низким содерж.углеводов, сахарном диабете. Кет.тела-водорастворимы и могут проходить ч/з гематоэнцефалический барьер и служат ист.энергии для нервной ткани. При избытке кетоновых тел в крови развивается метаболический ацидоз. Синтез их идет в митох.печени и немного в корковом слое почек



4)
Витамины
Е и К.

Витамин К (нафтохиноны, антигеморрагический). Ист. Капуста, рябина, шпинат, печень. Синтез.микрофлорой. 3 формы витамина- К1-филлохинон, К2-менахинон, и К3-менадион. Витамин явл.коферментоммикросомальных ферментов печени, осущ.гаммакарбоксилированиеглутаминовой к-ты в составе белковой цепи. :компонентов свертывсмы крови(протромбин,проконвретин,белки костной тк,белков почек) Ф-ции: синтез факторов свертывания крови, синтез белков костной ткани. Авитоминоз:нарсвертывкрови,повыш кровоточивость при травмах,самопроиз кровотечения. Сутпотр:до 2 мг.Витамин Е. альфа гамма беттаразновид. Производные токола и токотриенола,называют их токоферолами. Один из самых сильных антиоксидантов,предохрнасыщ жирные ктыбиомемтран от пероксидногоокисления,то есть поддерживает стабильность мембран,оказ регулирующее действие на протекание свободнорадикальных процессов. Повышают в организме актитвносчтьретинола. Гиповитаминоз:патологич изменения мембьран,наруш репродуктивной фции,мышечндистрофия,поражениянервн с. Много его в растмаслах.сут потреб 5-30 Мг

5)в сывке больного 67 лет было обнаружено резкое увели кислой фосфатазы и простатического аг.
8Кислая фосфатаза (простатическая и непростатическаяфракции) является лизосомальнымферментом, который участвует в реакциях обмена фосфорной кислоты. Ткань предстательной железы содержит простатическую и непростатическую фракции кислой фосфатазы, которые имеют одинаковый оптимум рН, но различаются по действию на них ряда веществ (ингибиторов), в частности тартрата (солей винной кислоты). Наибольшую активность общей кислой фосфатазы и простатической кислой фосфатазы обнаруживают в предстательной железе. Меньшую активность непростатической специфической фосфатазы находят в печени, селезенке, эритроцитах, тромбоцитах и костном мозге. Активность кислой фосфатазы предстательной железы проявляется c достижением половой зрелости. У мужчин общая кислая фосфатаза сыворотки состоит из простатической КФ, и, частично печёночной и тромбоцитарной. У женщин выявляется преимущественно печеночное, эритроцитарное и тромбоцитарное происхождение фермента в сыворотке крови. Активность кислой фосфатазы в клинической практике обычно проводится для диагностики: • рака предстательной железы на данный момент наиболее ценным опухолевым маркером, исследование которого в сыворотке крови необходимо для диагностики и наблюдения за течением гиперплазии и рака предстательной железы являетсяпростат-специфический антиген. Простат-спеиифический антиген представляет собой гликопротеин, вырабатываемый секреторным эпителием простаты и обеспечивающий разжижение эякулята.
БИЛЕТ №9
1)79.Гликолипиды —сложные липиды, образующиеся в результате соединения липидов с углеводами.Углеводная часть гликолипидов и гликопротеинов может быть представлена моносахаридами, а также полисахаридами, которые обычно построены из разных моносахаридных остатков (гетерополисахариды). Чаще всего в углеводной части встречаются следующие моносахариды: галактоза (Gal), манноза (Man), глюкоза (Glc), б-дезоксимоносахарид фукоза (Fuc), N-ацетилгалактозамин (GalNAc), N-аце-тилглюкозамин (GlcNAc), сиаловая кислота (N-ацетилнейраминовая кислота — NeuNAc).
Все эти моносахариды в организме синтезируются из глюкозы.В полисахаридах моносахариды соединены гликозидными связями, в образовании которых участвует полуацетальный (гликозидный) гидроксил одного моносахарида и любая гидроксильная группа другого моносахарида. Для альдогексоз возможны такие связи: 1 — 1, 1—2, 1—3, 1~*4, 1—5, 1—6. При этом гликозидный гидроксил может иметь а- или (3-конфигурацию. Вследствие этих особенностей даже из небольшого числа мономеров возможно построить огромное число разных олигосахаридов — линейных и разветвленных. Например, из трех моносахаридов можно образовать 1056 разных трисахаридов. Напомним, что из трех разных аминокислот получается только шесть разных трипептидов.Наиболее распространенные гликолипиды — это гликоцерамиды (гликосфин-голипиды), представляющие собой производные церамида (см. гл. 7). В частности, антигены А и В мембран эритроцитов являются гликоцерамидами.В гликопротеинах углеводная часть может быть связана с белком за счет гид-роксильных групп серина или треонина (О-гликозидная связь) или за счет амид-ной группы аспарагина (N-гликозидная связь). С одной белковой молекулой может быть связано разное число углеводных цепей — от одной до нескольких десятков, и цепи могут иметь разное строение.встреч к клет оболочках белк фр крови ферментах внут фак касла.
2)96. Окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных структурно в мультиферментную систему, получившую название «пируватдегидрогеназный комплекс».На I стадии этого процесса пируват (рис. 10.8) теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом (ТПФ) в составе активного центра фермента пируватдегидрогеназы (E1). На II стадии оксиэтильная группа комплекса E1–ТПФ–СНОН–СН3 окисляется с образованием ацетильной группы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментом дигидроли-поилацетилтрансферазой (Е2). Этот фермент катализирует III стадию – перенос ацетильной группы на коэнзим КоА (HS-KoA) с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макроэргическим) соединением.
На IV стадии регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид–Е2. При участии фермента дигидролипоилдегидрогеназы (Е3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. На V стадии восстановленный ФАДН2 дигидро-липоилдегидрогеназы передает водород на кофермент НАД с образованием НАДН + Н+.Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий. В нем принимают участие (в составе сложного мультиферментного комплекса) 3 фермента (пируватдегидрогеназа, ди-гидролипоилацетилтрансфераза, дигидролипоилдегидрогеназа) и 5 кофер-ментов (ТПФ, амид липоевой кислоты, коэнзим А, ФАД и НАД), из которых три относительно прочно связаны с ферментами (ТПФ-E1, ли-поамид-Е2 и ФАД-Е3), а два – легко диссоциируют (HS-KoA и НАД)

Е1 - пируватдегидрогеназа; Е2 - ди-гидролипоилацетилтрансфсраза; Е3 -дигидролипоилдегидрогеназа; цифры в кружках обозначают стадии процесса.Все эти ферменты, имеющие субъединичное строение, и коферменты организованы в единый комплекс. Поэтому промежуточные продукты способны быстро взаимодействовать друг с другом. Показано, что составляющие комплекс полипептидные цепи субъединиц дигидролипоил-ацетилтрансферазы составляют как бы ядро комплекса, вокруг которого расположены пируватдегидрогеназа и дигидролипоилдегидрогеназа. Принято считать, что нативный ферментный комплекс образуется путем самосборки.Суммарную реакцию, катализируемую пируватдегидрогеназным комплексом, можно представить следующим образом:Пируват + НАД+ + HS-KoA –> Ацетил-КоА + НАДН + Н+ + СO2.Реакция сопровождается значительным уменьшением стандартной свободной энергии и практически необратима.Образовавшийся в процессе окислительного декарбоксилирования аце-тил-КоА подвергается дальнейшему окислению с образованием СО2 и Н2О. Полное окисление ацетил-КоА происходит в цикле трикарбоновых кислот (цикл Кребса). Этот процесс, так же как окислительное декарбо-ксилирование пирувата, происходит в митохондриях клеток.
3)112.
Существует несколько классификаций липидов. Наибольшее распространение получила классификация, основанная на структурных особенностях липидов. По этой классификации различают следующие основные классы липидов.
Простые липиды: сложные эфиры жирных кислот с различными спиртами.1. Глицериды (ацилглицерины, или ацилглицеролы – по международной номенклатуре) представляют собой сложные эфиры трехатомного спирта глицерина и высших жирных кислот.2. Воска: сложные эфиры высших жирных кислот и одноатомных или двухатомных спиртов.Б. Сложные липиды: сложные эфиры жирных кислот со спиртами, дополнительно содержащие и другие группы.1. Фосфолипиды: липиды, содержащие, помимо жирных кислот и спирта, остаток фосфорной кислоты. В их состав часто входят азотистые основания и другие компоненты:а) глицерофосфолипиды (в роли спирта выступает глицерол);б) сфинголипиды (в роли спирта – сфингозин).2. Гликолипиды (гликосфинголипиды).3. Стероиды.4. Другие сложные липиды: сульфолипиды, аминолипиды. К этому классу можно отнести и липопротеины.B. Предшественники и производные липидов: жирные кислоты, глице-рол, стеролы и прочие спирты (помимо глицерола и стеролов), альдегиды жирных кислот, углеводороды, жирорастворимые витамины и гормоны.
Липиды - в-ва, обл. общ.физич. св-вом - гидрофоб. Основ.ф-ция- энергетическая, они дают в2раза больше энергии чем углеводы; запасающая ф-ция, ф-ции теплоизоляционной и мех.защиты, стоительная ф-ция за счет фосфолипидов, холестерина, участие в обменных процессах за счет жирораст. витаминиов, стероидных гормонов.
ЛП-комплекс белков и липидами, внутри ядро, содерж.неполярные липиды(ТАГ), оболочку из фосфолипидов, белка и своб.холестерина. Ф-ция ЛП-транспорт липидов. ХМ- ЛП,синтезируемые клетками кишечника. В результате действия ЛП-липазы на жиры ХМов, образуются жирные кислоты и глицерол.
Гиперхолестеринемия создает повышенную опасность заболевания атеросклерозом. Вероятность заболевания тем выше, чем больше отношение концентрации ЛНП к концентрации ЛВП в крови; их называют соответственно атерогенными и антиатерогенными липопротеинами. Гл. бх прояв. атероскл. — отложения холест. в стенках артерий.Метаболизм липопротеинов может быть представлен в виде двух циклов — экзогенного (превращения экзогенных липидов) и эндогенного (превращения эндогенных липидов). Интегрирующим органом обоих циклов является печень (рис. 163). В метаболизме липопротеинов участвуют две ключевые ферментные системы: Липопротеинлипаза (ЛПЛ) высвобождает свободные жирные кислоты и глицерин из хиломикронов и ЛПОНП в тканях. Лецитин: холестерин-ацилтрансфераза (ЛХАТ) образует эфи-ры холестерина из свободного холестерина и жирных кислот. Экзогенный липидный цикл. Пищевые липиды всасываются в виде моноацилглицеринов, НЭЖК и свободного холестерина. Эти липиды реэтерифицируются в гладком эндоплазматическом ретикулуме энтероцитов и связываются с апопротеином В48, который синтезируется в шероховатом эндоплазматическом ретикулуме. После дальнейших превращений хило-микроны, содержащие также апо А, секретируются в лимфатическую систему. Здесь происходит перенос апопротеинов между липопро-теинами: хиломикроны получают апо СИ и апо Е в основном из ЛПВП, на которые в свою очередь от хиломикронов передается апо А. Хиломикроны поступают в подключичные вены в составе, отличном от такового в грудном протоке. Хиломикроны метаболизируются главным образом в жировой ткани и скелетных мышцах.
4)32.Витамин а.сущ витамин А1 и А2. Провитамины-каротины,содерж в оранжево-красных овощях(морковь,томаты,перчик) и в зеленых частях растений.ВИТАМИНА самого много в рыбьем жирке,также в яичном желточке,слив маслице и печеночке.превращение каротинов в витамины происходит в стенке кишечника и в печени под влиянием каротиндиоксигеназы и ретинальредуктазы.(происх ок и восст) 2 цис ретиналь входит в состав родопсина сетчатки.воздействие света вызывает распад родопсина и конформац изменение цис на транс.это инициирует гидролиз цГМФ и появление медиатора .в резте образ электрический потенциал нервного импульса. В темноте наоброт синтез рдопсина. Ретинолпирофосфат переносчит галактозы и маннозы ,участв в ситезе гликопротеинов.ретиноевая кта способ росту костей и ткани,стим дифф эпителия.авитоминоз: тормоз роста,пораж кожди и слизистых, пораж глаз(ксерофтальмия,кератомаляция)сут потр 1-3 мг.

5)В моче новорожденного ребенка было обнаружено большое количество фенилпировиноградной кислоты. Ваш комментарий.Фенилпировиноградная олигофрения, наследственное заболевание из группы ферментопатий (См. Ферментопатии), в основе которого лежит аномалия аминокислотногообмена вследствие отсутствия или резкого снижения активности фермента фенилаланингидроксилазы. Описана в 1934 норв. учёным А. Фёллингом (A.Foiling) (болезньФёллинга). Частота Ф. – 1 случай на 10–15 тыс. новорождённых; наследуется по аутосомно-рецессивному типу (см. Наследственные заболевания). При Ф. фенилаланингидроксилаза сохраняет только около 5% активности, в связи с чем нарушается обмен фенилаланина ивследствие этого – тирозина, триптофана и др., накапливаются промежуточные продукты обмена – фенилэтиламин, фенилпировиноградная кислота и др. и возникает дефицит метаболитов, необходимых для нормального функционирования организма В частности,вероятная причина умственных расстройств – дефицит медиаторов нервной системы(адреналина, норадреналина, серотонина и др.). Т. о., при Ф. возникает комплекс взаимосвязанных метаболических расстройств, состоящий из первичного ферментного нарушения и обусловленных им др. нарушений обмена. Ф. проявляется главным образом выраженной олигофренией (См. Олигофрения) (идиотией или имбецильностью). Диагностируется в первые дни жизни ребёнка с помощью экспресс-методов – микробиологических или биохимических. Последние основаны на определении пировиноградной кислоты в моче посредством индикаторов (проба Фёллинга). Лечение сводится главным образом к специальной диете (резкое ограничение продуктов, содержащих фенилаланин).
БИЛЕТ №10
1.)(169). Строение рибосом прокариот и эукариот. Роль рибосом в биосинтезе белка.
Рибосо́ма — важнейший немембранный органоид живой клетки сферической или слегка эллипсоидной формы, диаметром от 15—20нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоящий из большой и малой субъединиц. Рибосомы служат для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК, или мРНК. Этот процесс называется трансляцией.
Константа седиментации (скорость оседания в ультрацентрифуге) рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), бактериальных клеток (а также митохондрий и пластид) — 70S (большая и малая субъединицы 50S и 30S, соответственно).
2) (97-9) Глюконеогенез. Цикл Кори.
Некот. ткани, напр. мозг, нуждаются в постоянном поступлении глюкозы. Когда поступ. углеводов в составе пищи недост., сод-е глюкозы в крови некоторое время поддерж. в пределах нормы за счёт расщепления гликогена в печени. Однако запасы гликогена в печени невелики. Они значительно уменьшаются к 6-10 ч голодания и практич. полностью исчерп. после суточ. голодания. В этом случае в печени начинается синтез глюкозы denovo - глюконеогенез - процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длит.голодания и интенс. физич. нагрузок. Протекает в основном в печени и менее интенс. в корковом в-ве почек, в слиз. об-кекишеч.Первич. субстраты глюконеогенеза - лактат, ам-ты и глицерол. Лактат - продукт анаэр. гликолиза. Он обр-ся при любых состояниях организма в эритроцитах и работающих мышцах. Ииспользуется в глюконеогенезе постоянно. Глицеролвысвоб. при гидролизе жиров в жир.тк. в период голодания или при длит. физич. нагрузке. Ами-ты обр-ся в рез-те распада мыш. белков и включ. в глюконеогенез при длит. голодании или продолжит. мыш. работе.Большинство р-цийглюконеогенеза протекает за счёт обратимых р-ций гликолиза и катализируется теми же ферментами. Однако 3 реакции необратимы. На этих стадиях р-цииглюконеогенеза протекают другими путями. Часть реакций глюконеогенеза происходит в митохондриях.ПВК -->оксалоацетат(пируваткарбоксилаза) Оксалоацетат -->фосфоенолпируват (фосфоенолпируваткарбоксикиназа — ГТФ-зависимый фермент). Далее все р-ции до фруктозо-1,6-фосфата проходят под дейст. Гликолитич. Ферм. Фруктозо-1,6-бисфосфатаза и глюкозо-6-фосфатаза катал.отщепление фосфатной гр. от фруктозо-1,6-бисфосфата и глюкозо-6-фосфата. После чего свободная глюкоза выходит из клетки в кровь.Лактат, обр-ся в интенс. раб. м-цах или в кл. с преобл. анаэр. спос. катаб. глюкозы, поступает в кровь, а затем в печень. В печени отношение NADH/NAD+ ниже, чем в сокращ. м-це, поэтому ЛДГ р-ция протекает в обратном направлении, т.е. в сторону образования ПВК из лактата. ПВК включ. в глюконеогенез, а образ-я глюкоза поступает в кровь и поглощ. скелет.м-цами - "глюкозо-лактатным циклом", или "циклом Кори", обесп. утилизацию лактата; предотвращает его накопление опасное снижение рН (лактоацидоз). Часть ПВК, обр. из лактата, ок. печенью. Энергия ок. может исп. для синтеза АТФ, необхо.о для р-цийглюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Аланин из мышц переносится кровью в печень, где преобразуется в ПВК, которыйчастич. окисляется и частично включ. в глюкозонеогенез. Следовательно, сущ. следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз. Аллостерическая регуляция скорости гликолиза, зависимая от изменения соотношения АТФ/АДФ, направлена на изменение скорости исп. глюкозы непосредственно кл. печени. Глюкоза в кл. печени исп. не только для синтеза гликогена и жиров, но также и как источник энергии для синтеза АТФ. Осн. потребителями АТФ в гепатоцитахявл. пр-сы трансмембранного переноса в-в, синтез белков, гликогена, жиров, глюконеогенез. От скорости утилизации АТФ в этих пр-сах зав. скорость его синтеза. АТФ, АДФ и АМФ, а также НАД и НАДН служат аллостерическими эффекторами некот. гликолитических ферментов и ферментов глюконеогенеза. В частности, АМФ активирует фосфофруктокиназу и ингибирует фруктозо-1,6-бисфосфатазу. АТФ и НАДН ингиб. пируваткиназу, а АДФ активирует пируваткарбоксилазу. Следовательно, при усил. расход. АТФ и снижении его конц-ции с одновременнымувелич. конц-ции АМФ, активируется гликолиз и обр-е АТФ, а глюконеогенез при этом замедляется. Глюкокортикостероидыобесп. пр-ссглюконеогенеза субстратами
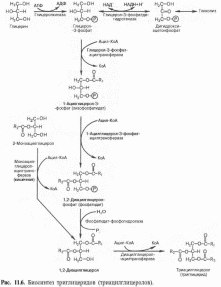
3) (114). Пищевые жиры и их переваривание. Всасывание продуктов переваривания. Нарушения переваривания и всасывания. Биосинтез триглицеридов, локализация этого процесса в клетке и его значение.
Липиды, поступающие с пищей, крайне гетерогенны по своему происхождению. В желудочно кишечном тракте они в значительной мере расщепляются до составляющих их мономеров: высших жирных кислот, глицерола, аминоспиртов и др. Эти продукты расщепления всасываются в кишечную стенку и из них в клетках кишечного эпители синтезируются липиды, свойственные человеку. Эти видоспецифические липиды далее поступают в лимфатическую и кровеносную системы и разносятся к различным тканеям и органам. Липиды, поступающие из кишечника во внутреннюю среду организма обычно называют экзогенными липидами.
Процесс расщепления пищевых жиров идет в основном в тонком кишечнике. В пилорическом отделе желудка, правда, выделяется липаза, но рН желудочного сока на высоте пищеварения составляет 1,0 - 2,5 и при этих значениях рН фермент малоактивен. Принято считать, что образующиеся в пилорическом отделе желудка жирные кислоты и моноглицериды далее участвуют в эмульгировании жиров в двенадцатиперстной кишке. В желудке под действием протеиназ желудочного сока происходит частичное расщепление белковых компонентов липопротеидов, что в дальнейшем облегчает расщепление их липидных составляющих в тонком кишечнике.
ВСАСЫВАНИЕ конечных продуктов переваривания пищи — это физиологический процесс, свойственный живым клеткам. В результате ферментативного расщепления пищевых веществ они становятся водорастворимыми и образуют водные растворы, которые всасываются через клетки слизистой оболочки стенок кишечника, переходят в кровь и лимфу, разносятся ими по всему организму и поступают в отдельные органы и клетки, где и используются для нужд организма.
В желудке очень медленно и в небольшом количестве всасываются продукты расщепления углеводов, которое началось еще в ротовой полости. В двенадцатиперстной кишке также всасывается очень небольшое количество (около 8%) образовавшихся там продуктов.
Основное место всасывания — тонкая кишка и восходящая часть ободочной кишки. В восходящей части толстой кишки завершается переваривание белков, продукты которого тут же и всасываются. Кроме того, здесь же в большом количестве всасывается вода. Общая всасывающая поверхность кишечника достигает 5 кв. м. Всосавшиеся вещества поступают в кровь и в лимфу, поскольку стенки кишечника испещрены кровеносными и лимфатическими сосудами.
Мальабсорбция — (malus — плохой и absorptio — поглощение) — потеря одного или многих питательных веществ, поступающих в пищеварительный тракт, обусловленная недостаточностью их всасывания в тонком кишечнике.
В почках, а также в стенке кишечника, где активность фермента глицеролкиназы высока, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата.
В жировой ткани и мышцах вследствие очень низкой активности глицеролкиназы образование глицерол-3-фосфата в основном связано с процессами гликолиза и гликогенолиза.
Большинство ферментов, участвующих в биосинтезе триглицеридов, находятся в эндоплазматическом ретикулуме, и только некоторые, например глицерол-3-фосфат-ацилтрансфераза,— в митохондриях.
4)(29).Вит РР и В2.Витамин РР (никотиновая кислота, никотинамид, витамин B3)

Источники. Витамин РР широко распространён в растительных продуктах, высоко его содержание в рисовых и пшеничных отрубях, дрожжах, много витамина в печени и почках крупного рогатого скота и свиней. Витамин РР может образовываться из триптофана (из 60 молекул триптофана может образоваться 1 молекула никотинамида), что снижает потребность в витамине РР при увеличении количества триптофана в пище.
Суточная потребность в этом витамине доставляет для взрослых 15-25 мг, для детей - 15 мг.
Биологические функции. Никотиновая кислота в организме входит в состав NAD и NADP, выполняющих функции коферментов различных дегидрогеназ (см. раздел 2). Синтез NAD в организме протекает в 2 этапа:

NADP образуется из NAD путём фосфорилирования под действием цитоплазматической NAD-киназы.
NAD+ + АТФ → NADP+ + АДФ
Недостаточность витамина РР приводит к заболеванию "пеллагра", для которого характерны 3 основных признака: дерматит, диарея, деменция ("три Д"), Пеллагра проявляется в виде симметричного дерматита на участках кожи, доступных действию солнечных лучей, расстройств ЖКТ (диарея) и воспалительных поражений слизистых оболочек рта и языка. В далеко зашедших случаях пеллагры наблюдают расстройства ЦНС (деменция): потеря памяти, галлюцинации и бред.
Витамин В2 (рибофлавин). В основе структуры витамина В2 лежит структура изоаллоксазина, соединённого со спиртом рибитолом.

Рибофлавин представляет собой кристаллы жёлтого цвета (от лат. flavos - жёлтый), слабо растворимые в воде.
Главные источники витамина В2 - печень, почки, яйца, молоко, дрожжи. Витамин содержится также в шпинате, пшенице, ржи. Частично человек получает витамин В2 как продукт жизнедеятельности кишечной микрофлоры.
Суточная потребность в витамине В2 взрослого человека составляет 1,8-2,6 мг.
Биологические функции. В слизистой оболочке кишечника после всасывания витамина происходит образование коферментов FMN и FAD по схеме:
Коферменты FAD и FMN входят в состав флавиновых ферментов, принимающих участие в окислительно-восстановительных реакциях (см. разделы 2, 6, 9, 10).
Клинические проявления недостаточности рибофлавина выражаются в остановке роста у молодых организмов. Часто развиваются воспалительные процессы на слизистой оболочке ротовой полости, появляются длительно незаживающие трещины в углах рта, дерматит носогубной складки. Типично воспаление глаз: конъюнктивиты, васкуляризация роговицы, катаракта. Кроме того, при авитаминозе В2 развиваются общая мышечная слабость и слабость сердечной мышцы.
5) В сыворотке пациента обнаружено двукратное увеличение молочной кислоты и ПВК.
Ваш комментарий.
Повышение уровня молочной кислоты в крови, обусловленное гипоксией, наблюдается при тяжелой физической нагрузке, шоке, кровотечении, сепсисе, инфаркте миокарда, тромбоэмболии легочной артерии, остановке сердца. При отсутствии явных причин нарушения тканевой перфузии причиной повышенного содержания молочной кислоты в крови могут быть такие заболевания, как сахарный диабет, лейкоз и лимфомы, поражение печени, почечная недостаточность, а также недостаточность некоторых ферментов .Лактатацидоз может развиться после приема больших доз ацетаминофена и этанола, а также после внутривенного введения адреналина, глюкагона, фруктозы или сорбитола
БИЛЕТ №11
1)(167)
Нуклеиновые кислоты
–сложные высокомолекулярные соединения,
обеспечхранение,передачу наследств
инфы и реализацию, построенные из
нуклеотидов,соед. 3,5 фосфдиэф. Св.Различают
ДНК и РНК. ДНК-линейный полимер, состоящий
из нуклеотидов-азотистого основания
(произв.пурина/пиримидина)-А,Г,Ц,Т,
пентозы(дезоксирибозы) и остатка
фосфорной к-ты Азотистые основания.
Различают: пиримидиновые
(цитозин,урацил,тимин) и пуриновые
(аденин, гуанин). В ДНК-а,г, ц,т.ДНК имеют
первичную, вторичную и третичную
структуры. Первичная струтура -
полинуклеотидная цепь, состоящая из
расположенных друг за другом нуклеотидов,
связанных между собой3, 5 фосфодиэфирными
связями. Каждый нуклеотид состоит из
остатка фосфорной кислоты, углевода
дезоксирибозы и одного из 4-х озотистых
оснований (аденина, гуанина, цитозина
или тимина). вторичная структура ДНК -
две комплементарные и антипараллельные
полинуклеотидные цепи, связанные через
соответствующие азотистые основания
водородными связями :а-т, г-ц, стабилизируется
благодаря гидрофобным взаимодействиям.
Третичная структура ДНК - двойная
спираль диаметром 2 нм, длиной шага 3,4
нм и 10 парами нуклеотидов в каждом
витке.Функция ДНК: хранение и передача
наследственной информации, записанной
с помощью генетического кода и реализация
(использов. Ее для синтеза белков).
 урацил
урацил
2)(96) Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий. Окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных в «пируватдегидрогеназный комплекс».3 фермента (пируватдегидрогеназа, ди-гидролипоилацетилтрансфераза, дигидролипоилдегидрогеназа) и 5 коферментов (тиамидфасфат(кофермент В6), липоевая кислота, КоА(кофермент пантотеновой к-ты), ФАД(кофермент В2) и НАД(В3).На I стадии этого процесса пируват теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом (ТПФ) в составе АЦ фермента пируватдегидрогеназы.

Суммарная реакция:Пируват + НАД+ + HS-KoA –> Ацетил-КоА + НАДН + Н+ + СO2. Реакция сопровождается значительным уменьшением стандартной свободной энергии и практически необратима. Образовавшийся в процессе окислительного декарбоксилированияаце-тил-КоА подвергается дальнейшему окислению с образованием СО2 и Н2О. Полное окисление ацетил-КоА происходит в цикле трикарбоновых кислот (цикл Кребса). Этот процесс, так же как окислительноедекарбо-ксилированиепирувата, происходит в митохондриях клеток.
3) (79) Гликолипиды-сложные липиды, образующиеся в результате соединения липидов с углеводами. Главной формой гликолипидов в животных тканях явл. Гликосфинголипиды. Они содержат церамид,сост. Из спирта сфингозина и остатка жирной кислоты,и один или неск остатков сахаров. Простейшими гликосфинголипидамиявл1)галактозилцерамиды и 2)глюкозилцерамиды. 1)явл главными сфинголипидами мозга и др нервных тк. 2) Простые гликосфинголипиды в тканях, отличных от нервной, представлены главным образом глюкозилцерамидом; в небольших количествах он имеется и в ткани мозга. Гликосфинголипиды, являющиеся компонентами наружного слоя плазматической мембраны, могут участвовать в межклеточных взаимодействиях и контактах. Некоторые из них являются антигенами, например антиген Форссмана и вещества, определяющие группы крови системы АВ0. Сходные олигосахаридные цепи обнаружены и у других гликопротеинов плазматической мембраны. Ряд ганглиозидов функционирует в качестве рецепторов бактериальных токсинов (например, холерного токсина, который запускает процесс активации аденилатциклазы).
4)(159) В организме исп.всеми клетками для синтеза пуриновых и пиримидиновых оснований. Амидные производные этих ам-к явл.транспортными формами аммиака из тканей в почки и печень. Кроме этого, глутаминовая к-та входит в состав глутатиона, ф-ции:переносам-к ч/з мембрану, медиатор. Асп.принимает участие в орнитиновом цикле, в р-цияхтрансаминирования и биосинтезе углеводов (гликогенная аминокислота)


5) КЛЕНОВОГО СИРОПА БОЛЕЗНЬ - наследственное заболевание аутосамнорецессивноготипа.Проявляется в первую неделю жизни судорожными припадками, затруднениямиглотания, дыхательными нарушениями, задержкой развития. Болезнь быстро прогрессируети в большинстве случаев заканчивается смертью на первом году жизни. Если дети доживаютдо более позднего возраста, основным проявлением заболевания служит умственнаяотсталость. При патологоанатомическом исследовании в мозге обнаруживается спонгиознаядегенерация и демиелинизация. Специфическим признаком болезни является характерныйзапах мочи, подобный запаху кленового сиропа. Обнаружено значительное увеличение вкрови и моче содержания аминокислот валина, лейцина и изолейцина, а также из альфа-кетоаналогов. Предполагается, что первичное биохимическое нарушение заключается вблоке окислительногодекарбоксилирования этих соединений. Диета с минимальнымсодержанием валина, лейцина и изолейцина (белковые гидролизаты, смеси аминокислот)приостанавливает прогрессирование болезни.
БИЛЕТ №12
Типы связей, формирующие третичную и четвертичную структуру белка. Денатурация.
Третичная структура – пространственная организация молекулы, образующаяся в результате взаимодействия между радикалами а/к. Связи: пептидные, ионные, дисульфидные, водородные. Четвертичная структура – агрегация мономерных субъединиц, объединенные слабыми взаимодействиями. Денатурация – изменение нативной конформации белка, сопровождающ. потерей его биологич. активности
2)(105). Роль инсулина и глюкагона в регуляции энергетического метаболизма при нормальном питании и при голодании. Изменения гормонального статуса и метаболизма при сахарном диабете. Наследственные нарушения обмена дисахаридов и их проявления.
Инсулин и глюкагон играют главную роль в регуляции метаболизма при смене абсорбтивного и постабсорбтивного периодов и при голодании.
Абсорбтивный период характеризуется временным повышением концентрации глюкозы, аминокислот и жиров в плазме крови. Клетки поджелудочной железы отвечают на это повышение усилением секреции инсулина и снижением секреции глюкагона. Увеличение отношения инсулин/глюкагон вызывает ускорение использования метаболитов для запасания энергоносителей: происходит синтез гликогена, жиров и белков. Режим запасания включается после приёма пищи и сменяется режимом мобилизации запасов после завершения пищеварения. Тип метаболитов, которые потребляются, депонируются и экспортируются, зависит от типа ткани. Главные органы, связанные с изменениями потока метаболитов при смене режимов мобилизации и запасания энергоносителей, - печень, жировая ткань и мышцы
Постабсорбтивным состоянием называют период после завершения пищеварения до следующего приёма пищи. Если пища не принимается в течение суток и более, то это состояние определяют как голодание. Типичным постабсорбтивным периодом считают состояние после 12-часового ночного перерыва в приёме пищи. В начале постабсорбтивного периода концентрация глюкозы в крови снижается, вследствие чего снижается секреция инсулина и повышается концентрация глюкагона. При снижении индекса инсулин/глюкагон ускоряются процессы мобилизации депонированных энергоносителей
ИЗМЕНЕНИЯ ГОРМОНАЛЬНОГО СТАТУСА И МЕТАБОЛИЗМА ПРИ САХАРНОМ ДИАБЕТЕ. Сахарный диабет - заболевание, возникающее вследствие абсолютного или относительного дефицита инсулина.
При сахарном диабете, как правило, соотношение инсулин/глюкагон снижено. При этом ослабевает стимуляция процессов депонирования гликогена и жиров, и усиливается мобилизация запасов энергоносителей. Печень, мышцы и жировая ткань даже после приёма пищи функционируют в режиме постабсорбтивного состояния.
При дефиците инсулина уменьшается количество белков-переносчиков глюкозы (ГЛЮТ-4) на мембранах инсулинзависимых клеток (жировой ткани и мышц). В мышцах и печени глюкоза не депонируется в виде гликогена, в жировой ткани уменьшается скорость синтеза и депонирования жиров. Кроме того, при снижении инсулинглюкагонового индекса активируется глюконеогенез из аминокислот, глицерола и лактата. Повышение концентрации глюкозы в крови при сахарном диабете превышает концентрационный почечный порог, что становится причиной выделения глюкозы с мочой (глюкозурия).
При низком соотношении инсулин/глюкагон жиры не депонируются, а ускоряется их катаболизм, так как гормончувствительная липаза в жировой ткани находится в фосфорилированной активной форме. Концентрация неэтерифицирован-ных жирных кислот в крови повышается. Печень захватывает жирные кислоты, окисляет их до ацетил-КоА, который, в свою очередь, превращается в β-гидроксимасляную и ацетоуксусную кислоты. В тканях ацетоацетат частично декарбоксилируется до ацетона, запах которого исходит от больных сахарным диабетом и ощущается даже на расстоянии.
При сахарном диабете дефицит инсулина приводит к снижению скорости синтеза белков в организме и усилению распада белков. Это вызывает повышение концентрации аминокислот в крови.Нарушения обмена углеводов, жиров и белков при сахарном диабете могут приводить к развитию коматозных состояний (острые осложнения). Диабетическая кома проявляется в резком нарушении всех функций организма с потерей сознания.
Гликогенозы. Группа наследственных болезней обмена полисахаридов, развивающихся в результате нарушения синтеза или распада гликогена на простые сахара. При этом нормальный и аномальный гликоген одновременно накапливаются в клетках печени и других органах и тканях. Клиническая картинагликогенозов характеризуется гипогликемией (рвота, судороги, потеря сознания, кома). Течение болезни зависит от места депонирования гликогена: печень, почки, мышечная ткань. Соответственно выделяют цирроз печени, почечную форму, мышечный синдром (включая сердечную форму). Преобладание у новорожденного ребенка симптомов гипогликемии может привести к синдрому внезапной смерти. Прогноз зависит от типа болезни.
Мукополисахаридозы (МПС) — гетерогенная группа заболеваний, отнесенных к наследственным болезням обмена сложных сахаров. МПС сопровождаются избыточным накоплением в тканях и повышенной экскрецией гликоз-аминогликанов (ГАГ) — кислых мукополисахаридов, соединенных с белком и состоящих из уроновых кислот, аминосахароз и нейтральных сахаров. Указанные комплексы существуют в форме протеогликанов, являющихся важнейшими компонентами основного структурного белка волос (0-кератина) и структурного белка соединительной ткани (коллагена).
Клиническая картина. Манифестация болезни, как правило, в возрасте до 7 лет, задержка роста (до карликовости), контрактура суставов, кифоз/кифосколиоз/сколиоз, массивный череп с глубоким и удлиненным турецким седлом, короткая шея, деформация грудной клетки, веслообразные ребра, укорочение трубчатых костей, грубые черты лица, помутнение роговицы, гепатоспленомегалия, задержка психического развития, судороги, глухота, грыжи (пупочная, паховая, пахово-мошоночная), врожденные пороки сердца, гликозаминогликанурия (100–200 мг в сутки). Характерные для МПС признаки дисморфизма получили название «гаргоилический фенотип» 3) (134). Биосинтез фосфолипидов и их биологическая роль.
Биосинтез фосфолипидов интенсивно происходит в печени, стенке кишечника, семенниках, яичниках, молочной железе и других тканях. Наиболее важные фосфолипиды синтезируются главным образом в эндоплазма-тической сети клетки.
Центральную роль в биосинтезе фосфолипидов играют 1,2-диглицериды (в синтезе фосфатидилхолинов и фосфатидилэтаноламинов), фосфатидная кислота (в синтезе фосфатидилинозитов) и сфингозин (в синтезе сфин-гомиелинов). Цитидинтрифосфат (ЦТФ) участвует в синтезе практически всех фосфолипидов. В качестве примера рассмотрим синтез отдельных представителей фосфолипидов.
Главная функция фосфолипидов, таким образом, сводится к обеспечению фундаментальной структуры мембран как барьеров проницаемости, как своего рода двумерных строительных лесов для клеток и органелл, а также как гидрофобной среды для ферментов, связанных с мембранами, в частности тех ферментов, которые участвуют в переносе электронов, превращениях энергии и поддержании химических концентрационных градиентов.
4)(28) Витамин В12 и биотин

Биотин: антисеборейный витамин. содерж.в печени, почках и др.;синтез.микрофлорой.
Участвует в переносе Со2 или НСО3(карбоксилировании), или в транскарбоксилировании. Биотин входит в состав пируваткарбоксилазы участвуя в синтезе оксалоацетата. В составе ацетилКоАкарбоксилазы участвует в синтезе жир.к-т. Биотиновая недестаточность: дерматит, поражение ногтей, волос, себорея, наступ из-за избыточного поступления белка сырых яиц авидина, который связывает биотин и предотвращ его всасывание. Биотин содерж. в: дрожжи, печень, яичн. желток, злаки. Сут. потр. 150-250мкг.
Кофермент Биоцетин состоит из биотина и ак лизина.
В12: источники: только животные продукты. +синтез. микрофлорой жкт.Строение:4пиррольных кольца, ион кобальта, группу CN-.Метаболизм: для всасывания витамина необх.внутренний фактор Касла-гликопротеин, синтез. обкладочными клетками желудка. Внешний фактор Кастла – кобаламин. Биохим.ф-ции: участв.в р-циях изомеризации и трансметилирования*ам-к гомоцистеина при синтезе метионина) . Витаминный дефицит или нарушение всасывания витамина В12 связаны главным образом с прекращением секреции внутреннего фактора. Следствием авитаминоза является мегалобластная анемия. Сут. потр. 2-5 мг.
5) В сыворотке больного, взятой натощак, резко повышено содержание мочевины и креатинина. Ваш комментарий.
12 Большая часть креатинина образуется в мышцах из креатинфосфата (источник энергии, необходимый для сокращения мышцы), также небольшое количество креатинина образуется в мозге. Количество креатинина в крови зависит от состояния мышечной системы, а также от выделительной функции почек. Таким образом, по содержанию креатинина в крови можно судить о наличии заболеваний почек или мышечной системы.
Как правило, у мужчин мышечная масса больше, поэтому нормы содержания креатинина в крови для мужчин выше, чем для женщин. Так, у женщин норма содержания креатинина в крови составляет от 57 до 93
мкмоль/л. Для мужчин нормальный уровень креатинина составляет от 80 до 115 мкмоль/л. У
детей содержание креатинина в крови несколько ниже и зависит от возраста.
Обмен белков – это довольно сложный цикл превращений, в результате которого часть белков организма распадается, а другая часть переходит в новую форму. При распаде белков выделяется аммиак – токсичное (ядовитое) для организма вещество. В печени из аммиака образуется мочевина, которая затем выделяется через почки вместе с мочой. Мочевина является одним из основных компонентов остаточного азота крови. В зависимости
от концентрации мочевины в крови, а также скорости ее выведения с мочой судят о выделительной функции почек. Нормальное содержание мочевины в крови для взрослых составляет от 2,5 до 6,4 ммоль/л. У детей младше 14 лет уровень мочевины в крови колеблется от 1,8 до 6,4 ммоль/л. Для людей старше 60 лет норма мочевины в крови от 2,9 до 7,5 ммоль/л. Так как повышено и содержание мочевины в моче, то можно говорить о хронической
почеченой недостаточности.
БИЛЕТ №13
1) (168). Генетический код и его характеристика. Молекулярные механизмы возникновения наследственных болезней. Краткое описание процесса трансляции.
Генети́ческий код — свойственный всем живым организмам способ кодирования аминокислотной последовательности белков при помощи последовательности нуклеотидов.
В ДНК используется четыре азотистых основания — аденин (А), гуанин (G), цитозин (С), тимин (T), которые в русскоязычной литературе обозначаются буквами А, Г, Ц и Т. Эти буквы составляют алфавит генетического кода. В РНК используются те же нуклеотиды, за исключением тимина, который заменён похожим нуклеотидом — урацилом, который обозначается буквой U (У в русскоязычной литературе). В молекулах ДНК и РНК нуклеотиды выстраиваются в цепочки и, таким образом, получаются последовательности генетических букв.
Белки практически всех живых организмов построены из аминокислот всего 20 видов. Эти аминокислоты называют каноническими. Каждый белок представляет собой цепочку или несколько цепочек аминокислот, соединённых в строго определённой последовательности. Эта последовательность определяет строение белка, а следовательно все его биологические свойства.
Свойства:
1. Триплетность — значащей единицей кода является сочетание трёх нуклеотидов (триплет, или кодон).2.Непрерывность — между триплетами нет знаков препинания, то есть информация считывается непрерывно. 3.Неперекрываемость — один и тот же нуклеотид не может входить одновременно в состав двух или более триплетов (не соблюдается для некоторых перекрывающихся геноввирусов, митохондрий и бактерий, которые кодируют несколько белков, считывающихся со сдвигом рамки). 4.Однозначность (специфичность) — определённый кодон соответствует только одной аминокислоте (однако, кодон UGA у Euplotescrassus кодирует две аминокислоты —цистеин и селеноцистеин)5. Вырожденность (избыточность) — одной и той же аминокислоте может соответствовать несколько кодонов. 6. Универсальность — генетический код работает одинаково в организмах разного уровня сложности — от вирусов до человека (на этом основаны методы генной инженерии; есть ряд исключений, показанный в таблице раздела «Вариации стандартного генетического кода» ниже).7. Помехоустойчивость — мутации замен нуклеотидов, не приводящие к смене класса кодируемой аминокислоты, называют консервативными; мутации замен нуклеотидов, приводящие к смене класса кодируемой аминокислоты, называют радикальными.
Механизмы возникновения наследственной патологии. Генные и хромосомные изменения
По характеру и распространенности изменения генетического материала выделяют три формы мутационных изменений — генные (точечные), хромосомные и геномные. Генные изменения характеризуются трансформацией структуры гена, т.е. молекулярной организации участка ДНК, включающего азотистые основания. Это может быть, например, замена одного основания на другое или изменение их последовательности. Генные мутации могут возникать также вследствие нарастания числа триплетных повторов нуклеотидов до предела, свыше того уровня, который протекает без изменения фенотипа. Такая экспансия определенных триплетов приводит к нарушению работы генов ("динамические" мутации). Определение подобных молекулярных изменений генов связано с применением специальных методов исследования ДНК (метод молекулярной гибридизации) или же анализом проявлений в форме определения белковых (ферментных, рецепторных) трансформаций. Наследственные заболевания, связанные с генными мутациями, весьма распространены: например, существует большая группа ферментопатий, обычно наследуемых как аутосомный рецессивный признак.
Хромосомные изменения характеризуются трансформацией структуры хромосом, что нередко обнаруживается при раздельном их морфологическом анализе. Хромосомные аберрации (от лат. aberatio — отклонение) проявляются делецией (отрыв участка хромосомы), инверсией (поворот участка хромосомы), транслокацией (перемещением участка в другое место той же или другой хромосомы), фрагментацией хромосомы и другими явлениями. Геномные изменения характеризуются отклонением от нормы числа хромосом, что проявляется уменьшением или увеличением их количества. Хромосомные и геномные мутации лежат в основе большой группы наследственных заболеваний, получивших название "хромосомные болезни". В соответствии с закономерностями передачи информации в клетке (ДНК— РНК — белок) появление мутированного гена может приводить к снижению (утрате) синтеза белка, появлению патологического белка, неспособного выполнять ту или иную функцию, или дерепрессии гена и появлению эмбрионального белка. Так, при афибриногенемии (аутосомное рецессивное наследование) утрачивается способность гепатоцитов синтезировать фибриноген, а при гемофилии А (рецессивное, сцепленное с полом наследование) — полноценного антигемофильного глобулина (фактор VIII свертывания крови). При серповидно-клеточной анемии (S-гемоглобиноз) в 6-й позиции глобина глутаминовая кислота заменяется на валин, что влечет за собой изменение свойств гемоглобина и эритроцитов (аутосомное рецессивное наследование). В случае талассемии (доминантное или рецессивное аутосомное наследование) образуются эмбриональные гемоглобин и эритроциты; последние приобретают мишеневидную форму и быстро гемолизируются.
Трансляция — процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК (иРНК, мРНК), осуществляемый рибосомой.
Синтез белка является основой жизнедеятельности клетки. Для осуществления этого процесса в клетках всех без исключения организмов имеются специальные органеллы — рибосомы. Рибосомы представляют собой рибонуклеопротеидные комплексы, построенные из 2 субъединиц: большой и малой. Функция рибосом заключается в узнавании трёхбуквенных (трехнуклеотидных) кодонов мРНК, сопоставлении им соответствующихантикодонов тРНК, несущих аминокислоты, и присоединении этих аминокислот к растущей белковой цепи. Двигаясь вдоль молекулы мРНК, рибосома синтезирует белок в соответствии с информацией, заложенной в молекуле мРНК.[1]
Для узнавания аминокислот в клетке имеются специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарный кодону мРНК, а также другой участок, к которому присоединяется аминокислота, соответствующая этому кодону. Присоединение аминокислот к тРНК осуществляется в энергозависимой реакции ферментами аминоацил-тРНК-синтетазами, а получившаяся молекула называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтетаз, присоединяющих аминокислоты строго к соответствующим им тРНК (например, кодону GGU будет соответствовать тРНК, содержащая антикодон CCA, а к этой тРНК будет присоединяться только аминокислотаглицин).
Механизмы трансляции прокариот и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотическую трансляцию, в значительно меньшей степени действуют на трансляцию высших организмов, что позволяет использовать их в медицинской практике как антибактериальные средства безопасные для организма млекопитающих.
Процесс трансляции разделяют на:1.инициацию — узнавание рибосомой стартового кодона и начало синтеза. 2.элонгацию — собственно синтез белка. 3.терминацию — узнавание терминирующего кодона (стоп-кодона) и отделение продукта.
2)(152). Типы дезаминирования аминокислот и их значение в клеточном обмене. Непрямое дезаминирование, химизм процесса, стадии, биологическое значение.

Значение:
Играет важную роль в процессах обмена веществ, в частности в катаболизме аминокислот. Основной и наиболее важный путь дезаминирования аминокислот в тканях животных, растений и у микроорганизмов окислительноедезаминирование с образованием альфа-кетокислот и аммиака. Оксидазы, дезаминирующие большинство природных аминокислот, малоактивны при физиологических значениях рН; наибольшей активностью обладает глутаматдегидрогеназа (коферменты НАД или НАДФ), играющая главную роль в дезаминировании аминокислот.
Непрямое Дезаминирование:
Непрямоедезаминирование происходит в два этапа:
1. Трансаминирование – аминокислота передает аминогруппу a-КГ и при этом превращается в кетоформу, а a-КГ – в глутаминовую:

2. Окислительноедезаминирование ГЛУ с выделением аммиака.

a-КГ может вновь вступать в реакции трансаминирования с другой аминокислотой, затем дезаминироваться. Поскольку обе реакции (трансаминирование и дезаминированиеглутаминовой кислоты) являются обратимыми, создаются условия для синтеза любой заменимой аминокислоты, если в организме имеются соответствующие a-кетокислоты. Организм человека и животных не наделен способностью синтеза незаменимых аминокислот, из-за отсутствия соответствующих a-кетокислот.
После дезаминирования углеродный скелет аминокислоты либо окисляется в аэробных условиях и служит источником энергии, либо используется в биосинтезе соединений.
3) (142). Хиломикроны образуются в лимфатической системе ворсинок кишечника. Они переносят до половины всех триацилглицеролов и холестерина лимфы. Новосинтезированныехиломикроны содержат интегральный белок В-48. Апопротеин В встраивается в липопротеины в гЭПР, где синтезируются триацилглицеролы. В аппарате Гольджи к белкам добавляются углеводы. Они высвобождаются из клеток кишечника обратнымпиноцитозом. После этого хиломикроны поступают в лимфатические сосуды ворсинок и уносятся лимфой. Попадая в кровоток, они получают апопротеины С и Е от ЛВП. На стенках капилляров находится липопротеинлипаза (ЛПЛ) (прикрепляется к ним протеогликановыми цепями гепарансульфата). В печени также есть своя липаза, но она менее эффективно атакует хиломикроны. Апопротеин С2 активирует липопротеинлипазу, которая расщепляет триглицериды хиломикрона до ди- и моноглицеридов, а затем — до свободной жирной кислоты и глицерола. Жирные кислоты транспортируются в мышечные и жировые ткани или связываются с альбумином в крови. По мере липолизахиломикроны теряют большинство своих триацилглицеролов, относительное содержание холестерина и его эфиров увеличивается. Диаметр остатка хиломикрона уменьшается. Апопротеин С2 возвращается на ЛВП, апопротеин Е сохраняется. Остатки хиломикронов поглощаются печенью. Поглощение осуществляется через рецепторныйэндоцитоз, с помощью рецепторов апопротеина Е. В печени эфиры холестерина и триацилглицеролы окончательно гидролизуются.
Липопротеинлипаза (ЛП—липаза) — фермент, обеспечивающий потребление экзогенных жиров тканями. ЛП—липаза, располагающаяся в эндотелии сосудов, взаимодействует с хиломикронами кровотока и гидролизуеттриацилглирины на глицерин и жирные кислоты, которые поступают в клетку. По мере извлечения ТАГ из хиломикронов последние превращаются в остаточные хиломикроны и затем поступают в печень.
4)
(68) Химическая
структура кортикостероидов.



Стероидные г, выделяемые корой надпочечников, делятся на глюкокортикоидные (кортизол, кортикостерон) и минералкортикоид. (альдостерон, 2-ДОК)
Первые -влияние на обм. углеводов, белков, жиров и нукл. к-т, напр.кортизол) и 2е-вл. на обм. солей и воды, напр.альдостерон.
Кортикостероиды оказывают свое действие при связывании с внутриклеточными стероидными рецепторами, при этом они осуществляют регуляцию экспрессии генов на транскрапционном и посттранскрипционном уровнях. Предшественник кортикостероидов – холестерин, стимулируется синтез -кортикотропин.
Влияние глюкокортикоидов: на углеводный обмен – учил. глюконеогенез и всасывание глюкозы в кишечнике, замедл поступл глюкозы в периферич ткани, усил синтез гликогена в печени; на белковый обмен – замедл. синтез белков в тканях ( кроме печени); на обмен липидов – косвенное стимулирование мобилизации жиров из жировой ткани благодаря усил продукции адреналина под влиянием глюкокортикоидов.
5) При определении содержания уробилиногена в моче обнаружить его не удалось. Ваш комментарий. Уробилиногеновые тела — производные билирубина.
Билирубин в основном выводится из организма с экскрементами, но сначала перерабатывается кишечной флорой.
Билирубин переходит в уробилиноген отчасти уже в желчном пузыре, но окончательно процесс происходит в толстой кишке при помощи кишечной флоры. Бактериальные ферменты перерабатывают пигмент билирубин в уробилиногеновые тела(бесцветные соединения мезобилиноген — уробилиноген и стеркобилиноген (L-уробилиноген)).Из желчных пигментов в моче могут появляться билирубин и уробилиноген. В норме билирубин
в общем анализе мочи отсутствует; содержание уробилиногена составляет 5-10 мг/л. Уробилиноген образуется из прямого билирубина, выделившегося с желчью, в тонком кишечнике. Поэтому полное отсутствие уробилиногена служит достоверным признаком прекращения поступления желчи в кишечник, что подтверждает диагноз подпечёночной желтухи при желчно-каменной болезни.
БИЛЕТ №14
1)(86) Глюкозо-6-фосфат, схема путей его образования и использования в организме.

Образуется в процессах гликолиза, гликогенеза из глюкозы. Обратный процесс образования из глюкозо-6фосфата глюкозы происходит в печени в процессе гликонеогенеза и гликогенолиза.
Образование глюкозо-6-фосфата происходит в ходе АТФ-зависимой реакции при участии ферментов, относящихся к группе ки-наз. АТФ в данной реакции выступает как донор фосфатной группы. Фосфоэфиры моносахаридов могут образовываться и без использования АТФ. Например, глюкозо-1-фосфат образуется из гликогена при участии Н3РО4. Физиологическое значение фосфоэфиров моносахаридов заключается в том, что они представляют собой метаболически активные структуры. Реакция фосфорилирования моносахаридов важна для метаболизма ещё и потому, что клеточная мембрана мало проницаема для этих соединений, т.е. клетка удерживает моносахариды благодаря тому, что они находятся в фосфорилированной форме.
При снижении расхода энергии в клетке повышается уровень АТФ (относительно АДФ) и глюкозо-6-фосфата. В этом случае активность гексокиназы снижается, и, следовательно, уменьшается скорость поступления глюкозы в клетку.
Глюкозо-6-фосфат может синтезироваться и из неуглеводных субстратов глюконеогенеза (лактата, пирувата, аминокислот). В мышцах глюкозо-6-фосфат синтезируется преимущественно из глюкозы крови. Печень способна к интенсивномуглюконеогенезу, особенно после мышечной работы, когда в крови накапливается много лактата. Глюкозо-6-фосфат превращается в глюкозо-1-фосфат, из которого синтезируются цепи гликогена. Образование альфа-1,4-связей катализирует гликогенсинтетаза; для образования альфа-1,6-связей необходим 1,4-альфа-глюкан-ветвящий фермент.
Глюкозо-6-фосфат превращается не только в гликоген. В печени при гидролизе глюкозо-6-фосфата образуется глюкоза. Эта реакция катализируется глюкозо-6-фосфатазой. Другие пути метаболизма глюкозо-6-фосфата: гликолиз (при этом образуются пируват и лактат) и пентозофосфатный путь (при этом образуется рибозо-5-фосфат). В норме между всеми процессами метаболизма глюкозо-6-фосфата поддерживается равновесие.
2)(37) Современные представления о мех-х действия ферментов. Мультиферментные комплексы на примере структуры синтазы жирных кислот.
Различают три стадии в механизме ферментативного катализа:
1.образование фермент-субстратного комплекса;2.образование комплекса «фермент-продукт реакции»;3.отщепление продуктов реакции от фермента. Суть действия ф-тов в том, что очень медленно течет реакция без него из-за высокого энергетичсекого барьера. реакция с участием ф-та начинает протекать по иному: вместо одной прямой реакции с высоким энерг. барьером начинает протекать несколько новых рекций, каждая из которых имеет низкий барьер, низкую энергию активации и запаса энергии у молекул на это хватает.
1. фермент отличается от субстрата наличием АЦ . В АЦ имеются якорные участки, за счет которых субстрат закрепляется и каталитический участок АЦ, ответственен за тип ускоряемой реакции. 2. – функционально-активные группы АЦ фермента действуют на субстрат, дестабилизируя связи в нем, вызывая изменение конфигурации субстрата, поляризацию его молекулы. Возникает переходное состояние. Это приводит к химическому преобразованию субстрата и образованию продуктов реакции, которые некоторое время находятся в связи с ферментом3.от этого времени и зависит скорость реакции. Происходит отделение фермента от продуктов реакции.
Мультиферментные комплексы
В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, где продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Благодаря таким комплексам значительно ускоряется скорость превращения
молекул. Напр.: пируватдегидрогеназный комплекс превращающий пируват в ацетил-SКоА,
α-кетоглутаратдегидрогеназный комплекс (в ЦТК превращающий α-кетоглутарат в сукцинил-SКоА
3)(141) Краткая характеристика липопротеидов крови. Роль апопротеинов в функционировании липопротеидов. Диагностич. значение определения липопротеинов в клинике.
Это класс сложных белков, сост из белка и простетич. группы, представленной липидом. В составе липопротеинов открыты нейтральные жиры, свободные жирные кислоты, фосфолипиды, холестериды.
Липопротеины сыворотки крови разделяются на классы в зависимости от электрофоретической подвижности и от плотности при центрифугировании. Различают ЛПНП(липипротеиды низкой плотности), ЛПОНП(очень низкой), ЛПВП(высокой), ЛПОВП(оч высок) ЛППП(промежуточной).
Установлено, что атеросклероз протекает при значительном повышении в плазме крови ЛПНП и ЛПОНП. Это связано с тем, что они подвергаются перекисному окислению , взаимодействуют с апопротеинами и образуют перекисно модифицированные ЛП. Это происходит в артериальной стенке. Там они захватываются макрофагами. МФ не могут переварить холестерин, они трансформируются в пенистые клетки и в конце концов разрываются, изливая накопленный холестерин во внутреннюю оболочку артерий.
В клинике необходимо определять значения ЛП для диагностики атеросклероза. Чес меньше в крови ЛПНП и чем больше ЛПВП, тем меньше вероятность развития атеросклероза.
4)(150) Декарбоксилирование а/к.Образование биогенных аминов: гистамина, серотонина, ГАМК. Роль биогенных аминов в регуляции метаболизма и функций.
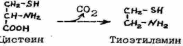



Реакции декарбоксилирования а/к явл. необратимыми, катализируются спец. декарбоксилазами аминокислот ( в состав их вход ПФ). Полученные в результате биогенные амины оказ. сильное фармакологическое действие на физиологические функции. Гистамин облад. сосудорасширяющим свойством, участвует в воспалении, а также в секреции HCL в желудке. ГАМК (гамма-амино-маслянная к-та) обладает тормозящим действием на деятельность ЦНС. используется при заболеваниях, связанных с резким возбуждением коры ГМ.
5) В результате анализа сыворотки крови, взятой натощак, было обнаружено высокое содержание кетоновых тел. Ваш комментарий.
Кетоновые тела (синоним ацетоновые тела) — группа органических соединений, являющихся промежуточными продуктами жирового, углеводного и белкового обменов. Появление повышенных количеств К. т. в крови и моче свидетельствует о нарушении углеводного и жирового обменов. Главным путем синтеза К. т., происходящего в основном в печени, считается реакция конденсации между двумя молекулами ацетил-КоА (см. Коферменты), образовавшегося при b-окислении жирных кислот (см. Жировой обмен) или при окислительном декарбоксилировании пируват(пировиноградной кислоты) в процессе обмена глюкозы и ряда аминокислот. Из печени К. т. поступают в кровь и с нею во все остальные органы и ткани, где они включаются в универсальный энергообразующий цикл — цикл трикарбоновых кислот, в котором окисляются до углекислоты и воды. К. т. используются также для синтеза холестерина, высших жирных кислот, фосфолипидов (см. Липиды) и заменимых аминокислот. Кетонемию и кетонурию наблюдают при сахарном диабете, углеводном голодании, лихорадочных состояниях, общем голодании и истощении (повышен кетогенез), приеме богатой кетогенными веществами пищи (усилен кетогенез), при состояниях после операций, акромегалии, гиперпродукции глюкокортикоидов, инфекционных болезнях (скарлатине, гриппе, туберкулезном менингите и др.) и тяжелых интоксикациях (например, при отравлении свинцом) и др. Следствием кетонемии являются метаболический ацидоз, или кетоацидоз, и ацетоновое отравление (ацетон растворяет структурные липиды клеток), при которых нарушается транспорт глюкозы через биологические мембраны и резко угнетается деятельность ц.н.с
БИЛЕТ №15
1)(1) Уровни организации белковых молекул. Первичная, вторичная, третичная и четвертичная стр-ры. А/к состав
Б.- полимеры, мономерами которых явл.ам-к, соедин.пептидной связью. Пептидная связь образуется путем взаим.а-карбоксил.группы одной ам-к с а-аминогруппой другой ам-к.
Первичная структура – линей.последов. ам-к.остатков в полипептидной цепи.
Вторич. струк. белка — простр. структура, формирующаяся в рез-те образ.водород.связей м/у группами –С=о и NH пептидного остова.структура мб 2 типов: а-спирали и b-структуры.
Третич. струк. белка — обр. в рез-те гидрофобных взаимод. между радикалами аминок-т. Большинство белков при этом формир.глобулу.
Четвертич струк. - способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой. Белки-высокомолекулярные биологич полимеры,составленные из 21 разл мономера- альфа аминокислотных остатков, соединенных пептидной связью. Если аминокислотн цепь содержит менее 10-20 остатков аминокислот, ее наз- пептидом, если более –полипептидом. Полипептиды сост из 50 и более аминокислотных остатков, наз – белками. Пептидная связь очень прочна, разрывается спец. протеолитическими ферментами.
2)(108) Пентозофосфатный путь превращения глюкозы. Значение его для эритроцитов и жировой ткани.
Существует еще один путь окисления глюкозы. В классическом гликолитическом пути глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат, который фосфорилируется 2-й раз и превращ. во фруктозо-1,6-бисфосфат. Если 2-го фосфорилирования гексозо-6-монофосфата не происходит, то фосфорилированная глюкоза может подвергаться прямому окислению до фосфопентоз.
ПФП можно разделить на два этапа: окислительный и неокислительный. Субстратом является глюкозо-6-фосфат.
В окислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу - рибулозо-5-фосфат, и образуется восстановленный NADPH. В неокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза. Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным коферментом NADPH, который используется в восстановительных процессах. ПФП и гликолиз, протекающие в цитозоле, взаимосвязаны и способны переключаться друг на друга в зависимости от соотношения концентраций промежуточных продуктов, образовавшихся в клетке.
3)(120)Образование желчных кислот и их роль в переваривании жиров. Конъюгирование желчных кислот, первичные и вторичные ж.к.
Желчные кислоты – холевая и хенодезоксихолевая(первичные, возникают в гепатоцитах), а также дезоксихолевая и литохолевая(вторичные, образуются под влиянием микрофлоры в кишечнике из первичных желчных кислот, реабсорбируются в подвздошной кишке).
Желч.к-ты способствуют эмульгированию пищевых жиров, участвуют в активировании панкреатической липазы, обеспечивают всасывание продуктов переваривания липидов. В печени эмульгирующие свойства желч.к-т усиливаются за счетреакции конъюгации, в которой к карбоксильной группе желч.к-т присоединяется таурин или глицин. Эти производные – конъюгированные желч.к-ты – наход. в ионизированной форме и поэтому называются солями желчных кислот. Именно они служат главными эмульгаторами жиров в кишечнике.
4)(70) Эстрогены: хим. строение, механизм действия и физиологич. роль.




Стероидные г., в основном синт-ся в фоллик. Эстрадиол Сост. из 18 ат. углерода. предш. явл. холестерин. Плацента также продуц эстр. Прогестерон сост из 18 ат. С. Эти горм выз. разв. вторич. пол. признаков., прог. подгот. слиз. об. матки к имплант. яйцекл., сохр. берем., торм. овуляцию и стимул. разв. тк. молоч. ж-зы. Эстрогены оказ. анаболич. дейст., стимул. синтез белка. Связ. с внутриклет. рецеп. и регулир. транскрип. генов подобно стер. горм. Эстрогены повышают концентрации в крови тироксина, железа, меди. Оказывают антиатеросклеротическое действие, увеличивают содержание ЛПВП, уменьшает ЛПНП и холестерина (уровень триглицеридов возрастает).
5)В суточной моче у пациента было обнаружено 10-кратное превышение содержания уропорфирина 1 и копропорфирина 1. Ваш комментарий.
15 Копропорфирин - соединение порфирина, образующееся в результате синтеза протопорфирина IX - предшественника гема. Уропорфирин - порфирин, играющий промежуточную роль в процессе синтеза протопорфирина IX.Эритропоэтическая уропорфирия — редкое врожденное тяжелое заболевание, наследуется аутосомно по рецессивному типу, наблюдается в одном поколении иногда у нескольких детей, у родителей
— гетерозиготных носителей патологического гена — клинические проявления болезни отсутствуют. Заболевание может проявляться у новорожденных, появляется моча красного цвета, фотосенсибилизация (освобождающийся из эритроцитов уропорфириноген окисляется в уропорфирин и откладывается в коже), спустя несколько недель или месяцев после рождения на теле ребенка появляются пузыри с последующим развитием язв, которые на фоне
антибиотикотерапии рубцуются, оставляя участки склерозированной кожи на лице и другой локализации. У ребенка нередко возникают контрактура суставов и слепота, отсутствуют волосы, ногти. У больных обнаруживается увеличение селезенки. Выявляется гемолитическая анемия с внутриклеточным гемолизом, повышен уровень свободного билирубина сыворотки крови и содержание ретикулоцитов, расширен эритро-нормобластический росток в костном мозге. Укорочена продожительность жизни эритроцитов, часто снижена их осмотическая
резистентность. Повышен уропорфирин и копропорфирин мочи и эритроцитов. Заболевание приводит к инвалидности и нередко к смерти в раннем детском возрасте
БИЛЕТ №16
1) Скорость ферментативной реакции зависит температуры, реакции среды, концентрации реагирующих веществ, количества фермента и других факторов. Зависимость скорости реакции от количест ва фермента. При условии избытка субстрата скорость реакции пропорциональна количеству фермента, но при избыточном количестве фермента прирост скорости реакции будет снижаться, поскольку уже не будет хватать субстрата. Скорость химических реакций пропорциональна концентрации реагирующих веществ (закон действующих масс). Этот закон применим и для ферментативных реакций, но с определенными ограничениями. При постоянных количествах фермента скорость реакции действительно пропорциональна концентрации субстрата, но, только в области низких концен траций. При высоких концентрациях субстрата наступает насыщение фермента субстратом, то есть наступает такой момент, когда уже все мо лекулы фермента задействованы в каталитическом процессе и прироста скорости реакции не будет. Скорость реакции выходит на макси мальный уровень (Vmax) и дальше уже не зависит от концентрации субстрата. Зависимость скорости реакции от концентрации субстрата следует определять в той части кривой, кото рая ниже Vmax. Технически легче определить не максимальную скорость, а ½ Vmax. Этот параметр является главной характеристикой ферментативной реакции и дает возможность определить константу Михаелиса (Кm). Кm (константа Михаэлиса) – это такая концентрация субстрата, при которой ско рость ферментативной реакции равна по ловине максимальной. Отсюда выводится уравнение Михаэлиса–Ментена скорости ферментативной реакции. Влияние температуры на скорость ферментативной реакции. При низких температурах (приблизительно до 40 – 50 оС) повышение температуры на каждые 10 оС в соответствии с правилом Вант-Гоффа сопровождается увеличением скорости химической реакции в 2 – 4 раза. При высоких температурах более 55 – 60 оС активность фермента резко снижается из-за его тепловой денатурации, и, как следствие этого, наблюдается резкое снижение скорости ферментативной реакции. Максимальная активность ферментов наблюдается обычно в пределах 40 – 60 оС. Температура, при которой активность фермента максимальна, называется температурным оптимумом. Влияние рН на скорость ферментативной реакции. График зависимости от рН имеет колоколообразную форму. Значение рН, при котором активность фермента максимальна, называется рН-оптимумом фермента. Значения рН-оптимума для различных ферментов колеблются в широких пределах. Характер зависимости ферментативной реакции от рН определяется тем, что этот показатель оказывает влияние на:a) ионизацию аминокислотных остатков, участвующих в катализе, b) ионизацию субстрата, c) конформацию фермента и его активного центра. (38, но эт с большими дополнениями)
2) Глюконеогенез - синтез глюкозы из неуглеводных продуктов de novo. Его осн.ф-цией яв-ся поддержание уровня глюкозы в крови в период длитет.голодания или интенст.физ.нагрузок. Протекает в основном в печени и менее интенсивно в корк.в-ве почек, в слиз.об-ке кишеч-ка. Большинство реакций глюконеогенеза протекает за счет обратим.реа-й гликолиза и катализируется теми же ферм-ми. Однако 3 реак-и необратимы. На этих стадиях реакции глюконеогенеза протекают другими путями. Пировиноградная к-та включается в глюконеогенез, а образ-я глюкоза поступает в кровь и поглащается скел.мышцами - "глюкозалактатным циклом" или "циклом Кори" - обеспечивает утилизацию лактата. предотвращает его накопление - опасное снижение рН (лактоацидоз). Часть пировинюк-ты обра-ся из лактата, окисляется печенью. Энергия окис-я может исполь-ся для синтеза АТФ, необходимо для реакций глюконеогенеза. Из всех аминок-т, поступающих в печень, примерно 30% приходится на долю аланина. Аланин из мышц переноситься кровью в печень, где преобраз-ся в Пировинг.к-ту(пируват), кот. частично окисляется и частично включается в глюконеогенез.
3 )
Трансаминирование — биохимическая
ферментативная реакция обратимого
переноса аминогруппы с аминокислоты
на кетокислоту без промежуточного
образования аммиака.Ферменты,
катализирующие процесс, назвали
трансаминазами, или аминотрансферазами.
Константа равновесия ферментативной
реакции трансаминирования приблизительно
равна 1, то есть направление протекания
процесса переноса аминогруппы
определяется концентрацией субстратов
и продуктов в клетке. Одна и та же реакция
трансаминирования может протекать в
разных направлениях в разных частях
клетки. Следовательно трансаминирование
служит как для анаболизма, так и для
катаболизма аминокислот, то есть
является амфиболическим процессом.
Лизин и треонин не участвуют в реакциях
трансаминирования. Продуктами чаще
всего являются аланин, аспарагин и
глутамат, так как соответствующие им
кетокислоты образуются в процессе
метаболизма углеводов. Реакции
трансаминирования играют большую роль
в обмене аминокислот. Поскольку этот
процесс обратим, ферменты аминотрансферазы
функционируют как в процессах катаболизма,
так и биосинтеза аминокислот.
Трансаминирование - заключительный
этап синтеза заменимых аминокислот из
соответствующих α-кетокислот, если они
в данный момент необходимы клеткам. В
результате происходит перераспределение
аминного азота в тканях организма.
Трансаминирование - первая стадия
дезаминирования большинства аминокислот,
т.е. начальный этап их катаболизма.
Образующиеся при этом кетокислоты
окисляются в ЦТК или используются для
синтеза глюкозы и кетоновых тел. При
трансаминировании общее количество
аминокислот в клетке не
меняется.Трансаминирование играет
важную роль в процессах мочевинообразования,
глюконеогенеза, путях образования
новых аминокислот. Трансаминирование
аминокислот с образованием глутаминовой
кислоты в сочетании с ёё дезаминированием
НАД(Ф)-зависимой глутаматдегидрогеназой
называется непрямым дезаминированием
аминокислот (трансдезаминирование).Аминотрансферазы
представляют собой семейство ферментов,
обладающих различной субстратной
специфичностью по отношению к
аминокислотам, по-разному распределенных
в различных тканях организма, но имеющих
один и тот же кофермент и действующих
в соответствии с одним и тем же механизмом.
Этим коферментом является витамин Вв
в форме пиридоксальфосфата. Механизм
действия заключается в простом переносе
аминогруппы (—NHa) одной а-аминокислоты
с образованием второй а-аминокислоты,
причем пиридоксалевая группа связана
с ферментом, который действует при этом
переносе аминогруппы как посредник.
Поскольку ACT и АЛТ наиболее активны в
клетках печени, сердца и, в меньшей
степени, скелетных мышц, их используют
для диагностики болезней этих органов.
В клетках сердечной мышцы количество
ACT значительно превышает количество
АЛТ, а в печени - наоборот. Поэтому
особенно информативно одновременное
измерение активности обоих ферментов
в сыворотке крови. Соотношение активностей
ACT/АЛТ называют "коэффициент де
Ритиса". В норме этот коэффициент
равен 1,33±0,42. При инфаркте миокарда
активность ACT в крови увеличивается в
8-10 раз, а АЛТ - в 1,5-2,0 раза. Наиболее резко
активность ACT увеличивается при некрозе
ткани, так как выходит в кровь и
цитоплазматическая и митохондриальная
формы фермента. При инфаркте миокарда
значение коэффициента де Ритиса резко
возрастает. При гепатитах активность
АЛТ в сыворотке крови увеличивается в
∼8-10
раз по сравнению с нормой, a ACT - в 2-4 раза.
Коэффициент де Ритиса снижается до
0,6. Однако при циррозе печени этот
коэффициент увеличивается, что
свидетельствует о некрозе клеток, при
котором в кровь выходят обе формы ACT.
)
Трансаминирование — биохимическая
ферментативная реакция обратимого
переноса аминогруппы с аминокислоты
на кетокислоту без промежуточного
образования аммиака.Ферменты,
катализирующие процесс, назвали
трансаминазами, или аминотрансферазами.
Константа равновесия ферментативной
реакции трансаминирования приблизительно
равна 1, то есть направление протекания
процесса переноса аминогруппы
определяется концентрацией субстратов
и продуктов в клетке. Одна и та же реакция
трансаминирования может протекать в
разных направлениях в разных частях
клетки. Следовательно трансаминирование
служит как для анаболизма, так и для
катаболизма аминокислот, то есть
является амфиболическим процессом.
Лизин и треонин не участвуют в реакциях
трансаминирования. Продуктами чаще
всего являются аланин, аспарагин и
глутамат, так как соответствующие им
кетокислоты образуются в процессе
метаболизма углеводов. Реакции
трансаминирования играют большую роль
в обмене аминокислот. Поскольку этот
процесс обратим, ферменты аминотрансферазы
функционируют как в процессах катаболизма,
так и биосинтеза аминокислот.
Трансаминирование - заключительный
этап синтеза заменимых аминокислот из
соответствующих α-кетокислот, если они
в данный момент необходимы клеткам. В
результате происходит перераспределение
аминного азота в тканях организма.
Трансаминирование - первая стадия
дезаминирования большинства аминокислот,
т.е. начальный этап их катаболизма.
Образующиеся при этом кетокислоты
окисляются в ЦТК или используются для
синтеза глюкозы и кетоновых тел. При
трансаминировании общее количество
аминокислот в клетке не
меняется.Трансаминирование играет
важную роль в процессах мочевинообразования,
глюконеогенеза, путях образования
новых аминокислот. Трансаминирование
аминокислот с образованием глутаминовой
кислоты в сочетании с ёё дезаминированием
НАД(Ф)-зависимой глутаматдегидрогеназой
называется непрямым дезаминированием
аминокислот (трансдезаминирование).Аминотрансферазы
представляют собой семейство ферментов,
обладающих различной субстратной
специфичностью по отношению к
аминокислотам, по-разному распределенных
в различных тканях организма, но имеющих
один и тот же кофермент и действующих
в соответствии с одним и тем же механизмом.
Этим коферментом является витамин Вв
в форме пиридоксальфосфата. Механизм
действия заключается в простом переносе
аминогруппы (—NHa) одной а-аминокислоты
с образованием второй а-аминокислоты,
причем пиридоксалевая группа связана
с ферментом, который действует при этом
переносе аминогруппы как посредник.
Поскольку ACT и АЛТ наиболее активны в
клетках печени, сердца и, в меньшей
степени, скелетных мышц, их используют
для диагностики болезней этих органов.
В клетках сердечной мышцы количество
ACT значительно превышает количество
АЛТ, а в печени - наоборот. Поэтому
особенно информативно одновременное
измерение активности обоих ферментов
в сыворотке крови. Соотношение активностей
ACT/АЛТ называют "коэффициент де
Ритиса". В норме этот коэффициент
равен 1,33±0,42. При инфаркте миокарда
активность ACT в крови увеличивается в
8-10 раз, а АЛТ - в 1,5-2,0 раза. Наиболее резко
активность ACT увеличивается при некрозе
ткани, так как выходит в кровь и
цитоплазматическая и митохондриальная
формы фермента. При инфаркте миокарда
значение коэффициента де Ритиса резко
возрастает. При гепатитах активность
АЛТ в сыворотке крови увеличивается в
∼8-10
раз по сравнению с нормой, a ACT - в 2-4 раза.
Коэффициент де Ритиса снижается до
0,6. Однако при циррозе печени этот
коэффициент увеличивается, что
свидетельствует о некрозе клеток, при
котором в кровь выходят обе формы ACT.
тут будет картинка, которую я пришлю отдельно в письме =* вопрос хуярила сама в шпорах не нашла, мб плохо смотрела

4) (71-72) Андрогены - общее собирательное название группы стероидных гормонов, производимых половыми железами (семенниками у мужчин и яичниками у женщин) и корой надпочечников и обладающих свойством в определённых концентрациях вызывать андрогенез, вирилизацию организма — развитие мужских вторичных половых признаков. Представители: Тестостерон, Дигидротестостерон, андростерон. Предшеств. - холестерол, кот. поступает из плазмы в виде ЛПНП (липопротеины низкой плотности), либо синт-ся в полов.железах из ацетил-КоА. Синте-ся полов.железами и корой надпочечников. У эмбриона под действием андрогенов из вольфова протока образуется придаток яичка, семявыносящий проток и семенной пузырек, стимул-ет клеточное деление, стим-ет формир-е вторич.полов.признаков.
5) Выпадение функций оксидазы гомогентизиновой кислоты, характеризующееся расстройством обмена тирозина и экскрецией с мочой большого количества гомогентизиновой кислоты – алкаптонурия. Алкаптонурия возникает вследствие мутации гена, кодирующего синтез оксидазы гомогентезиновой кислоты. Данная патология характеризуется аутосомно-рецессивным типом наследования. Алкаптонурией чаще болеют мужчины. Ген оксидазы гомогетинзиновой кислоты человека (HGD) локализован на длинном плече 3 хромосомы человека (3q 21-23). В нормальных условиях гомогентезиновая кислота — промежуточный продукт распада тирозина и фенилаланина — переводится малеилацетоуксусную кислоту, из которой в конечном счёте образуются фумаровая и ацетоуксусная кислоты, вступающие в другие биохимические циклы. Из-за дефекта фермента этот процесс тормозится, и остающаяся в избытке гомогентезиновая кислота превращается полифенолоксидазой в хиноновый полифенол (алкаптон или бензохинонацетат), который и выводится почками. Ранний признак алкаптонурии — выделение у ребенка мочи, быстро темнеющей при стоянии на воздухе, подогревании, подщелачивают. В дальнейшем может присоединиться мочекаменная болезнь, осложняющаяся пиелонефритом. Признаки поражения опорно-двигательного аппарата появляются обычно после 30 лет.
БИЛЕТ №17
1)(8) Нуклеотиды,это составные части нуклеиновых кислот,то есть мономеры нукл кислот. Состоят из фосф кислоты, азотистого основания и углевода(рибозы или дезоксирибозы). Нуклеотиды ,соединяясь друг с другом,образуютполинкулеотиды. Примеры нуклеотидов :АМФ,ЦМФ,УМФ,ГМФ. Нуклеозиды-вещества,состоящие из азотистого основания и углевода.,являются частью нуклеотидов. Индивидуальные нуклеозиды: аденозин, уридин,тимидин,цитидин.Динуклеотид-димер нуклеотида, в котором два нуклеотида связаны друг с другом через фосфатные группировки. К этой группе соединений относятся некоторые коферменты (НАДФ и НАД), а также флавин (ФАД). НАДФ и НАД-коферменты витамина РР, широко распространённые в природе коферменты некоторых дегидрогеназ — ферментов, катализирующих окислительно-восстановительные реакции в живых клетках. НАДФ принимает на себя водород и электроны окисляемого соединения и передаёт их на другие вещества.ФАД- кофермент, принимающий участие во многих окислительно-восстановительных биохимических процессах. FAD существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается
в
переходе между этими формами.Кофермент
рибофлавина(витамина B2).

ФАД
2) (100) Аэробный гликолиз - процесс окисления глюкозы с образованием двух молекул пирувата. Главный путь утилизации глюкозы. При расщ. 1 молекулы глюкозы в тканях синтезируется 38 молекул АТФ.В результате этих процессов глюкоза распадается до CO2 и H2O, а освобождающаяся энергия используется для синтеза АТФ. при распаде 1 моль ацетил-КоА образуется 12 моль АТФ, следовательно, из 2 моль ацетил-КоА - 24 моль АТФ. Суммируя энергетические эффекты всех этапов распада глюкозы в аэробных условиях, получаем 38 моль АТФ.

Е1 - гексокиназа или глюкокиназа
Е2 - глюкозофосфатизомераза
Е3 - фосфофруктокиназа
Е4 - фруктозодифосфатальдолаза
Е5 – триозфосфатизомераза
2этап: Е6 - глицеральдегид-3-фофатдегидрогеназа
Е7 - фосфоглицераткиназа
Е8 - фосфоглицератфосфомутаза
Е9 - енолгидратаза
Е10 –прируваткиназа

3)(129)Фосфолипи́ды — сложные липиды, сложные эфиры многоатомных спиртов и высших жирных кислот. Содержат остаток фосфорной кислоты и соединенную с ней добавочную группу атомов различной химической природы. Они есть во всех живых клетках. 1)глицерофосфолипиды— содержат остаток глицерина :фосфатидилхолин (лецитин);фосфатидилэтаноламин (кефалин);фосфатидилсерин 2)фосфосфинголипиды — содержат остаток сфингозина сфингомиелины;3)фосфоинозитиды — содержат остаток инозитола. Центральную роль в биосинтезе фосфолипидов играют 1,2-диглицериды (в синтезе фосфатидилхолинов и фосфатидилэтаноламинов), фосфатидная кислота (в синтезе фосфатидилинозитов) и сфингозин (в синтезе сфин-гомиелинов). Цитидинтрифосфат (ЦТФ) участвует в синтезе практически всех фосфолипидов.
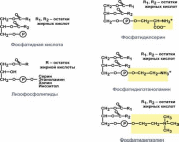
Главный липидный компонент клеточных мембран. Они сопутствуют жирам в пище и служат источником фосфорной кислоты, необходимый для жизни человека. Фосфолипиды являются важной частью клеточных мембран. Они обеспечивают текучие и пластические свойства мембран клеток и клеточных органоидов, в то время как холестерин обеспечивает жёсткость и стабильность мембран. Как фосфолипиды, так и холестерин часто входят в состав липопротеидов клеточных мембран, но имеются в мембранах и в свободном, не связанном с белками состоянии. Соотношение холестерин/фосфолипиды в основном и определяет текучесть либо жёсткость клеточной мембраны.Фосфолипиды участвуют в транспорте жиров, жирных кислот и холестерина. Между плазмой и эритроцитами происходит обмен фосфолипидами, которые играют важнейшую роль, поддерживая в растворимом состоянии неполярные липиды. Будучи более гидрофильными, чем холестерин, благодаря наличию в молекуле остатков фосфорной кислоты, фосфолипиды являются своеобразными «растворителями» для холестерина и других высоко гидрофобных соединений.
 4)(31)
ВитаминD (кальциферол,
антирахический) в активной форме в виде
1,25 дигидроксихолекальциферола усиливает
всасывание кальция в тонк. Киш,стимулируя
синтез кальц.связ. белка и белковых
комп. Кальциевой АТФазы,усил всасывание
фосфатов в киш. В почках он усиливает
в канальцах реабсорбциюCAи
Р.,также стимулирует резорбцию кальц
и фосф из костной ткани. Витамин D
помогает в борьбе против рахита,
способствует повышению сопротивляемости
организма, участвует в активизации
кальция в тонком кишечнике и минерализации
костей.Недостаточность витамина D
приводит к нарушению фосфорно-кальциевого
обмена, следствием чего является рахит
- расстройство солевого обмена, что
приводит к недостаточному отложению
извести в костях. При передозировке
витамина D наблюдается сильное токсическое
отравление: потеря аппетита, тошнота,
рвота, общая слабость, раздражительность,
нарушение сна, повышение температуры.Содержится
в печени, дрожжах, жирномолочных
продуктах. Образованию витамина D в
коже способствуют ультрафиолетовые
лучи.
4)(31)
ВитаминD (кальциферол,
антирахический) в активной форме в виде
1,25 дигидроксихолекальциферола усиливает
всасывание кальция в тонк. Киш,стимулируя
синтез кальц.связ. белка и белковых
комп. Кальциевой АТФазы,усил всасывание
фосфатов в киш. В почках он усиливает
в канальцах реабсорбциюCAи
Р.,также стимулирует резорбцию кальц
и фосф из костной ткани. Витамин D
помогает в борьбе против рахита,
способствует повышению сопротивляемости
организма, участвует в активизации
кальция в тонком кишечнике и минерализации
костей.Недостаточность витамина D
приводит к нарушению фосфорно-кальциевого
обмена, следствием чего является рахит
- расстройство солевого обмена, что
приводит к недостаточному отложению
извести в костях. При передозировке
витамина D наблюдается сильное токсическое
отравление: потеря аппетита, тошнота,
рвота, общая слабость, раздражительность,
нарушение сна, повышение температуры.Содержится
в печени, дрожжах, жирномолочных
продуктах. Образованию витамина D в
коже способствуют ультрафиолетовые
лучи.
5) В крови пациента было обнаружено высокое содержание лактатдегидрогеназы (ЛДГ1)
и тропонина Т. Ваш комментарий.
Это фермент, который участвует в процессе окисления глюкозы и образовании молочной кислоты. Лактат (соль молочной кислоты) образуется в клетках в процессе дыхания. Лактатдегидрогеназа содержится почти во всех органах и тканях человека, особенно много его в мышцах. При полноценном снабжении кислородом лактат в крови не накапливается, а разрушается до нейтральных продуктов и выводится. В условиях гипоксии (недостатка кислорода) накапливается, вызывает чувство мышечной усталости, нарушает процесс тканевого дыхания. Тропонины — небольшие белки, включённые в процесс регуляции мышечного сокращения. Два вида тропонинов, тропонин-I и тропонин-T, структурно различаются в скелетной и сердечной мышцах, поэтому кардиоспецифичные формы тропонина-I и тропонина-T можно изолированно выявить методами иммуноанализа. Для тропонинов отношение концентрации внутри мышечных клеток к концентрации в плазме крови намного выше, чем для ферментов и миоглобина, что делает эти белки высокочувствительными маркёрами поражения миокарда. Можно говорить в данном случае, об инфаркте миокарда
БИЛЕТ №18
1)(57) . Дыхательная цепь митохондрий, ее строение и основные принципы функционирования. Теории сопряжения окисления и фосфорилирования
Окислительное фосфолирование – процесс образования АТФ и воды на внут.мембране митохондрий, заключающийся в окислении восстановленных эквивалентов (НАДН и ФАДН2) дыхательными ферментами.На внут.мембране содержится мультиферментных комплекс-дыхательные ферменты, а последовательность их расположения в мембране назыв.дыхат.цепью.Дыхат. цепь состоит из: НАД-зависимой дегидрогеназы; ФАД-зависимой дегидрогеназы; Убихинона (КоQ); Цитохрмов b, c,с1, a,a3. Соединение может отдавать электроны только соед-ю с более высоким ок-восст потенциалом. В дых. цепи каждое последующее звено имеет более высокий потенциал, чем предыдущее. В дых. цепи каждое последующее звено имеет более высокий потенциал, чем предыдущее. Наруж. мембрана митох. проницаема для большинства мелких молекул и ионов, внутренняя почти для всех ионов (кроме протонов Н) и для большинства незаряженных молекул. Компоненты дых. цепи встроены во внутр. мембрану. Транспорт протонов и электронов по дых. цепи обеспечивается разностью потенциалов между ее компонентами. При этом каждое увеличение потенциала на 0,16 В освобождает энергию, достаточную для синтеза одной молекулы АТФ из АДФ и Н3РО4. Процессы ок. и образования АТФ из АДФ и фосфорной к-ты т.е. фосфорилирования протекают в митох. Перенос электронов по дыхат. цепи от НАДН к О2 сопровождается выкачиванием протонов из матрикса митохондрий через внутреннюю мембрану в межмембранное пространство. Протоны, перенесённые из матрикса в межмембранное пр-во, не могут вернуться обратно в матрикс. Создаётся протонный градиент, при котором концентрация протонов в межмембранном пространстве больше, а рН меньше, чем в матриксе. В дыхат. цепи есть только 3 участка - уч-ки сопряжения и фосфолирования, где перенос электронов сопряжен с накоплением энергии, достаточным для обр-я АТФ, на др. этапах возник-я разн. потенциалов для этого пр-са недостаточна. Теория сопряжения Митчела - ок-е субстрата и фосфолир-е АДФ через протонный градиент. Часть энергии эл. трансформир. в энергию трансмембранного электрохим. потенциала, созд-го путем перекачки протонов из матрикса митох. в межмебр. пр-во. В дальнейшем протоны через канал сопрягаещего устройства возвр. в матрикс, конц. протонов выравнивается, мембрана разряж., а энергия трансмемранного потенциалал исп. для синт. АТФ.
2.) (88) Пути синтеза полисахаридов. Роль УТФ в синтезе полисахаридов. Регуляция синтеза и распада полисахаридов. Гликогенозы и биохимические механизмы их возникновения.
ПОЛИСАХАРИДЫ(гликаны), полимерные углеводы,молекулы к-рых построены из моносахаридных остатков, соединенных гликозидными связями.
Синтез полисахаридов. Первым из них служит последоват. перенос отдельных моносахаридных остатков от нуклеотидсахаров на растущую цепь с участием специфич.ферментовHYPERLINK "http://www.xumuk.ru/encyklopedia/1087.html"гликозилтрансфераз, обеспечивающих необходимое положение и стереохимию образующейся гли-козидной связи; Второй тип-сборка олигосахаридного "повторяющегося звена" по первому типу р-ций и его последующая полимеризация с образованием строго регулярных полимерных молекул, характерных для полисахаридных цепей липополисахаридов грамотрицательных бактерий или для бактериальных капсульных полисахаридов.Наконец, полисахариды, построенные по первому или второму типу, могут испытывать постполимеризац. модификации (третий тип биосинтеза), к-рые включают замещение атомов Н гид-роксильных групп на ацильные остатки (ацетилирование, сульфатирование), присоединение боковых моно- и олигоса-харидных остатков и даже изменение конфигурации отдельных моносахаридных звеньев [таким путем в результате эпимеризации приатоме С-5 образуются остатки L-гулуро-новой к-ты из D-маннуроновой в составе альгинатов, а также остатки L-идуроновой к-ты из D-глюкуроновой в составе мукополисахаридов]. Последние р-ции часто приводят к нарушению (маскировке) первонач. регулярности цепей полисахаридов и к образованию нерегулярных (мн. гемицеллюлозы) или блочных (альгиновые к-ты, мукополисахариды) структур. Роль УТФ в синтезе полисахаридов.
В силу обратимости реакции глюкозо-6-фосфат ↔ глюкозо-1-фосфат синтез гликогена из глюкозо-1-фосфата и его распад оказались бы также обратимыми и поэтому неконтролируемыми. Чтобы синтез гликогена был термодинам. необратимым, необходима дополнительная стадия образования уридиндифосфатглюкозы из УТФ и глюкозо-1-фосфата. Нуклеотидная часть УДФ-глюкозы играет существенную роль в действии гликоген синтазы, выполняя функцию "рукоятки", при помощи которой фермент располагает глюкозу в полисахаридной цепи в нужном положении. Кроме того, нуклеотидная часть УДФ-глюкозы, по-видимому, необходима для узнавания субстрата при катализе.
Регуляция синтеза и распада.
В мышцах нет рецепторов глюкагона, и распад гликогена стимулируется главным образом ионами Са2+ и адреналином. Пр-сс нач. с возникновения стрессовой ситуации, связанной с необходимостью напряженной работы. В отв. на сигнал цнс из мозгового вещества надпочечников секретируется в кровь адреналин, который взаимод. с рецепторами мембран мыш. кл., и запускаются каскады реакций, аденилатциклазный, инозитолфосфатный, связ. с кальмодулином.
Ключевую роль в рег. синтеза и распада гликогена играют р-ции фосфорилирования-дефосфорилирования гликогенсинтетазы и гликогенфосфорилазы. Глюкагон передает сигнал в кл. через аденилатциклазную сист, в кл. актив. протеинкиназа А. Протеинкиназа А и инактивирует гликогенсинтетазу: синтез гликогена прекращается. Протеинкиназа А активирует через киназу гликогенфосфорилазы гликогенфосфорилазу. Т. о., синтез гликогена в клетке заторможен, но происходит его распад. Инсулин активирует тирозинкиназу своего рецептора, и далее следует каскад реакций, в рез-те к-го фосфорилируется и активируется печеночная протеинфосфатаза гранул гликогена 1. Затем ПфГр-1 дефос-активирует гликогенсинтетазу — становится возможным синтез гликогена, и инактивирует киназу гликогенфосфорилазы. Распад гликогена прекращ. Гликогенозы- Группа наследственных болезней, которые обусловлены недостаточностью ферментов, участвующие в обмене гликогена. Разделение гликогенозов на типы по характеру ферментативной недостаточности. Болезнь Гирке-фермент глюкозо-6-фосфатаза, накопление гликогена норм.структуры. Болезнь Кори – амило1,6-глюкозидаза-накопление гликогена с короткими внешними ветвям.Болезнь Андерсена – амило1-6 глюкозилтрансфераза, накопление гликогена с длинными наружными ветвями. Болезнь Херса-гликогенфосфорилаза-накопление в мышцах гликогена норм.структуры.
3). (143 )Образование кетоновых тел и основные причины усиления кетогенеза. При низком соотношении инсулин/глюкагон в крови в жир. тк. акт. распад жиров. Жир. к-ты поступ. в печень в большем кол-ве, чем в норме, поэтому увеличивается скорость β-окисления. Ск-ть реакций ЦТК в этих условиях сниж., т. к. оксалоацетат исп-ся для глюконеогенеза. В рез-те ск-ть образования ацетил-КоА превышает способность ЦТК окислять его. Ацетил-КоА накапл. в митохондриях печени и используется для синтеза кетоновых тел. Синтез кетоновых тел происходит только в митохондриях печени.
Синтез кет. тел нач. с взаимод. 2 молек ацетил-КоА, к-е под дейст. тиолазы обр. ацетоацетил-КоА. С ацетоацетил-КоА взаимодействует третья молекула ацетил-КоА, образуя 3-гидрокси-3-метилглутарил-КоА (ГМГ-КоА). Эту реакцию катализирует ГМГ-КоА-синтаза. Далее ГМГ-КоАлиаза катализирует расщепление ГМГ-КоА на свободный ацетоацетат и ацетил-КоА. Ацетоацетат может выделяться в кровь или превращаться в печени в другое кетоновое тело - β-гидроксибутират путём восстановления. В кл. печени при акт. β-окислении создаётся высокая конц-ция НАДН => превращ. большей части ацетоацетата в β-гидроксибутират, поэтому осн. кетоновое тело в крови - именно β-гидроксибутират. При высокой конц-ции ацетоацетата часть его неферментативно декарбокс., превращаясь в ацетон. Уже через 2-3 дня после начала голодания конц-ция кет. тел в крови достаточна для того, чтобы они проходили в клетки мозга и окислялись, снижая его потребности в глюкозе. β-Гидроксибутират), попадая в клетки, дегидрируется НАД-зависимой ДГ и превращ. в ацетоацетат. Ацетоацетат активируется, взаимодействуя с сукцинил-КоА - донором КоА:
Ацетоацетат + Сукцинил-КоА → Ацетоацетил- КоА + Сукцинат.
Ок-е 1 молек. β-гидроксибутирата до СО2 и Н2О обесп-т синтез 27 молекул АТФ.
При длительном голодании, когда печень выраб.ок.50%жир.к-т в др.источники обр.кетоновые тела- b-гидроксибутират, ацетоацетат, ацетон. В норме их число 1-3мг/дл. Их кл-во так же увелич. При длит.физ.нагрузке, употреблении пищи, богатой жирами, но с низким содерж.углеводов, сахарном диабете. Кет.тела-водорастворимы и могут проходить ч/з гематоэнцефалический барьер и служат ист.энергии для нервной ткани. При избытке кетоновых тел в крови развивается метаболический ацидоз.
Синтез их идет в митох.печени и немного в корковом слое почек.
4) (73) Прогестерон, его физико-химическая характеристика и биологические функции
гормон жёлтого тела яичников. По химическому строению является стероидным гормоном. является предшественником ряда нейростероидов в головном мозге. Очень большое количество прогестерона производит плацента плода. Изначальный предшественник – холестерин.Прогестерон сост из 18 ат. С. Эти горм выз. разв. вторич. пол. признаков., прог. подгот. слиз. об. матки к имплант. яйцекл., сохр. берем., торм. овуляцию и стимул. разв. тк. молоч. ж-зы. Эстрогены оказ. анаболич. дейст., стимул. синтез белка. Связ. с внутриклет. рецеп. и регулир. транскрип. генов подобно стер. горм.
5) . Нормы общего билирубина: 3,4— 17,1 мкмоль/л— для взрослых и детей (кроме периода новорожденности). У новорожденных билирубин высокий всегда— это так называемая физиологическая желтуха. Повышенный билирубин — симптом следующих нарушений в деятельности организма: недостаток витамина В 12 острые и хронические заболевания печени рак печени гепатит первичный цирроз печени токсическое, алкогольное, лекарственное отравление печени желчнокаменная болезнь. Повышение уровня общего билирубина в крови (гипербилирубинемия) свыше 27 – 34 мкмоль/л приводит к связыванию его эластическими волокнами кожи и конъюнктивы, что проявляется желтушным окрашиванием. Тяжесть желтухи обычно соответствует уровню билирубинемии (легкая форма - до 85 мкмоль/л, среднетяжелая - 86-169 мкмоль/л, тяжелая форма - свыше 170 мкмоль/л). В клинической практике наиболее широкое распространение получило деление желтух на гемолитические, паренхиматозные и обтурационные. Для дифференциальной диагностики желтух используют комплекс пигментных тестов - определение концентрации в крови общего, прямого билирубина (и оценку по их разности уровня непрямого билирубина), а также определение концентрации в моче уробилиногена и билирубина.
БИЛЕТ №19
1)(3)физико-химические свойства белков и их классификация. Потребность в белках. Азотистый баланс. Белковая недостаточность. Квашиокор.
Белки — кристалл.в-ва, имеющие большую молекулярную массу , благодаря чему образуют в воде коллоидные растворы. Повышенная вязкость растворов, подвижность в эл. поле.Растворимость Б. опр. их ам-к.составом, особ. организации молекулы и св-вами растворителя. Стабильность растворам белков придают заряд белковой молекулы и ее гидратная оболочка.Химические св-ва белков определяются благодаря функциональнм группам(—NH2, —СООН, —ОН, —SН и др.). Характерной для белков реакцией является гидролиз пептидных связей. Благодаря наличию и амино-, и карбоксильных групп белки обладают амфотерными свойствами.
Азотистый баланс-это соотнош между суточным приходом и суточным расходом белка (азота) -о приходе и расходе белка судят по приходу и расходу азота, для этого кол-во азота умножают на 6,25 (напр с мочой выделилось 12 г азота, суточный расход равен = 12*6,25=75 г)
Возможны 3 варианта баланса - азотистое равновесие, отриц.(расход > приход – опухолевый рост) и положительный азот баланс(приход>расхода – рост, беременность, наращивание мыш массы.
Сут.потребность в белках – 60-120г.
Причины развития белковой недостаточности: малое содержание белков в пище с дефицитом незаменимых аминокислот; заболевания органов пищеварения,; повышенный расход и потери белка при туберкулезе, многих инфекционных болезнях. Квашиоркор — вид тяжёлой дистрофии на фоне недостатка белков в пищевом рационе. Болезнь обычно возникает у детей 1-4 лет, развивающихся стран. Причинами мб также врожденные нарушения обмена ам-к, нарушения всасывания белка в кишечнике, повышенные потери белка с мочой при нефротическом синдроме, нарушение синтеза белка. Все это приводит к нарушению развития ребенка, дистрофическим изменениям органов и тканей.
2)(52) Цикл трикарбоновых кислот и его биологическое значение
Цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в к-е превращ. в пр-се катаболизма большая часть орг. молекул, играющих роль «клеточного топлива»: углеводов, жирных к-т и аминок-т. Данный цикл происходит в матриксе митох. и состоит из 8 последовательных р-ций. Нач. цикл с присоед. ацетил-КоА к оксалоацетату и обр-ия цитрата. Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований и двух декарбоксилирований теряет два углеродных атома и снова в цикле К. превращается в оксалоацетат (четырехуглеродное соединение), т.е. в рез-те полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула оксалоацетата регенерируется. Ц. К. дает поток электронов высокой энергии связ. НАДН2 и ФАДН2 форме.и затем включаеются в процесс окислительного фосфорилирования, где уже снитез.АТФ и образ.вода, При окислении 1 молек. ацетил-КоА в ц. К. и системе окислительного фосфорилирования может обр-ся 12 АТФ.

3)(146) Роль печени в липидном обмене.

Играет ведущую роль. Непосредственно в гепатоцитах идет биосинтез холестерина, желчных к-т, образование фосфолипидов плазмы, кетоновых тел, ЛП.Печенью регулируются процессы синтеза и транспорта жир.к-т организма.
4)(13) Витамин В1, его строение и медико-биол. значение.
Антиневрический витамин, тиамин. В организме превращается в кофермент тиаминпирофосфат(ТПФ, карбоксилаза),

Уч-т в р-ции окислительного декарбоксилирования пирувата, а также в транскетолазной реакций пентозофосфатного пути. При недостатке витамина Β1 развивается болезнь бери-бери, признаками которой являются расстройства нервной системы (полиневриты) метаболизма пищеварительной., сердечно-сосудистые заболевания и мышечная атрофия.
Витамин регулирует углеводный, жировой. белковый обм., обладает с-витаминсберегающей ф-цией, оказ. влияние на проведение нервного возбуждения в синапсах. В1 принимает уч-е в синтезе ацетилхолина, катализ. обр-е ацетил-КоА, уч. в кроветворении. Сут.норма – 1-3мг.
5)В плазме крови пациента в результате лабораторного анализа было обнаружено, что
концентрация общего холестерина составляет 12 мМ. Ваше заключение.
Холестерин или холестерол — органическое соединение, важнейший компонент жирового обмена. Нормы холестерина общего в крови — 3,0—6,0 ммоль/л. Определение холестерина крови — обязательный этап диагностики заболеваний сердечно- сосудистой системы (ишемическая болезнь сердца, инфаркт миокарда), атеросклероза и заболеваний печени. Состояние организма, при котором отмечается повышенный уровень холестерина и триглицеридов в крови врачи называют гиперлипидемией. Гиперлипидемия может быть
наследуемым явлением, особенно если в семье среди родственников были случаи инфаркта
миокарда, инсульта до 50 лет. Повышенный холестерин или гиперхолестеринемия приводит к образованию
атеросклеротических бляшек: холестирин присоединяется к стенкам сосудов, сужая просвет внутри них. На холестериновых бляшках образуются тромбы, которые могут оторваться и попасть в кровеносное русло, вызвав закупорку сосудов в различных органах и т канях, что может привести к атеросклерозу, инфаркту миокарда и другим заболеваниям.
БИЛЕТ №20
1) Кислород необходим организму для функц-я ЦПМ и многих др.реакций, явл-ся одновременно и токс.в-вом, если из него образ-ся так называемые актив.формы: ОН* - гидроксильный радикал, О2- -супероксидный анион, Н2О2 - пероксид водорода.Ключевой активной формой кислорода является супероксид анион - радикал (О2-), образующейся при присоединении одного электрона к молекуле кислорода в основном состоянии.Присоединение двух электронов к молекуле кислорода или одного электрона к супероксид-аниону приводит к образованию перекиси водорода, которая является окислителем умеренной силы. Однако из перекиси водорода может образовываться гидроксид-радикал (ОН.), который является весьма сильным окислителем. ОН радикал может образовываться при трехэлектронном восстановлении кислорода или при взаимодействии перекиси водорода с супероксид радикал - анионом. В процессе реакции генерируется OH (гидроксил-радикал) из H2O2 (пероксида водорода) и супероксида (O2?). Реакция может возникать в клетке и вызывать окислительный стресс. Наиболее активен гидроксильный радикал, взаимодействующий с большинством орг.молекул. Он отнимает от них электрон и инициирует таким образом цепные реакции окисления. Эти свободнорадикальные реакции окисления могут выполнять полезные функции, НР, когда клетки белой крови с участием актив.форм кислорода разрушают фагоцитированные клетки бактерий. Но в остальных клетках свободнорадик.окисление приводит к разрушению орган.молекул, в первую очередь липидов, и, соответственно, мембранных структур клеток, что часто заканчивается их гибелью. Поэтому в организме функционирует эффективная система ингибирования перекисного окисления липидов(ПОЛ).Защита от токсического действия кислорода на клетку обеспечивается двумя эшелонами обороны: они сводят до минимума образование токсических продуктов в ходе неферментативного окисления (т. е. свободных радикалов и перекиси водорода) и эффективно улавливают те из них, образования которых избежать не удалось. Первую линию обороны клетки от свободных радикалов обеспечивает группа ферментов, наличие которых в клетках живых организмов установлено относительно недавно. Эта линия обороны защищает организм от супероксидного радикала и перекиси водорода, тем самым предотвращая образование крайне опасного гидроксильного радикала. В 1969 г. была открыта группа ферментов супероксиддисмутаз (СОД), которые захватывают генерируемые в клетке супероксидные радикалы О. Две другие группы ферментов — каталазы и пероксидазы — предназначены для улавливания перекиси водорода.
2)Существует несколько способов регуляции действия ферментов: - изменение активности фермента при его постоянной концентрации; - доступностью молекул субстрата и кофер-мента; - изменение концентрации фермента, обычно в результате ускорения (индукции) или торможения (репрессии) синтеза фермента. Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра. Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Активность может увеличиться — это активация фермента, или уменьшиться — это ингибирование. Сообщение о присоединении аллостерического активатора передается посредством конформационных изменений каталитической субъединице, которая становится комплементарной субстрату, и фермент включается. При удалении активатора фермент вновь переходит в неактивную форму и выключается. Аллостерическая регуляция является основным способом регуляции метаболических путей. В качестве примера можно рассмотреть принципы регуляции гликолиза - специфического (начального) пути распада глюкозы. Один из конечных продуктов распада глюкозы - молекула АТФ. При избытке в клетке АТФ происходит ретро-ингибирование аллостерических ферментов фосфофруктокиназы и пируваткиназы. При образовании большого количества фруктозо-1,6-бисфосфата наблюдают аллостерическую активацию фермента пируваткиназы.Регуляция каталит.актив-ти ферментов мб путем фосфорилирования /дефосфорилирования. Модификации подвергаются ОН-группы фермента. Фосфорил-е осущест-ся фер-ми протеинкиназами, а дефосфол-е - фосфопротеинфофатазами. Присоединение остатка фосфорной к-ты приводит к изменению конформации активного центра и его каталит.актив-ти. При этом результат мб двояким: одни ферменты при фосфол-и активируются, другие, напротив, становятся менее активными. Например, под действием глюкагона (в период между приёмами пищи) в клетках происходит уменьшение синтеза энергетического материала - жира, гликогена и усиление его распада (мобилизация), вызванного фосфо-рилированием ключевых ферментов этих процессов. А под действием инсулина (во время пищеварения), наоборот, активируется синтез гликогена и ингибируется его распад, так как взаимодействие инсулина с рецептором активирует сигнальный путь, приводящий к дефосфорилированию тех же ключевых ферментов. в 1961 г. в Москве приняли классификацию ферментов, в основе кот. лежит тип катализируемой хим.реак-и:1.оксиредуктазы (перенос электронов и протонов), 2. трансферазы (перенос групп атомов, отличных от атомов ыодорода), 3. Гидролазы (гидролиз различных связей с участием молекулы воды), 4. лиазы (образование двойных связкей за счет удаления групп или добавления групп за счет разрыва двойных связей), 5. Лигазы/синтетазы (соединение двух молекул и образование связей С-С, С-О, С-S, C-N, сопряженных с разрывом пирофосфатной связи АТФ). Оксиредуктазы катализируют ОВР, лежащие в основе биологич.окисления, коферментами этого класса яв-ся НАД, НАДФ,ФАД,ФМН, убихинон, глутатион, липоевая к-та. Примеры ферм-в:дегидрогеназы, редуктазы, оксидазы.
3) Примерно 3/4 жир.к-т являются непредельными (ненасыщенными), т.е соед. двойные связи, имеют цис-конфигурацию, кот. делает ненасыщенную кислоту менее стабильной и более подверженной катаболизму. Ненасыщен.жир.к-ты: пальмитиновая (С15Н29СООН, 1 двойная связь), олеиновая (С17Н33СООН, 1 двойная связь). Полиненасыщенные жир.к-ты: линолевая (С17Н31СООН, 2 двойные связи), линоленовая (С17Н29СООН, 3 двойные связи), арахидоная (С19Н31СООН, 4 двойные связи). Ткани животных обладают весьма ограниченной способностью превращать насыщенные жир.к-ты в ненасыщенные. Поэтому в пище жив-х дожны обязательно присутствовать некоторые полиненасыщ.жир.к-ты, содержащиеся в продуктах растит.происхождения. Фосфолипиды клеточ.мембран содержат ненасыщ.жир.к-ты. Высокое содержание полиненасыщ.ж.к-т в пищ.рационе является основным фактором, обеспеч. снижение холестерола в плазме крови. Простогландины и тромбоксаны являются гормонами местного дей-я, при необходимости они быстро синтезируются и действуют в непосредственной близости от места их синтеза. Основная физиол.фун-я простогландинов состоит в модулировании актив-ти аденилатциклазы и выраж., например, в регуляции агрегации тромбоцитов или ингибировании действия АДГ в почках. Полиненас.ж.к-ты (ПНЖК) - не синтезируются в организме, поэтому должны поступать в организм с пищей. ПНЖК подразделяются на 2 группы: ПНЖК семейства омега-6 (линолевая ж.к-та) и омега-3 (альфа-линолевая и др). Первые содер-ся в раст маслах(соевое, подсолнечное, кукурузное), вторые - как в раст.маслах, так и в рыбе.
4) Фоливая к-та - водораст.вит В9, необходимый для роста и развития кровеностной и уммуной систем. Недостаток фол.к-ты может вызвать мегалобластную анемию у взрослых, а при беременности повышает риск развития дефектов нервной трубки. Фолюк-та необходима для создания и поддержания в здоровом состоянии новых клеток, поэтому ее наличие особенно важно в периоды быстрого развития организма - на стадии раннего внутриутроб.развития и в раннем детстве. Процес репликации ДНК требует участия фол.к-ты, и нарушение этого процесса увеличивает опасность развития раковых опухолей. Основная функция - перенос одноуглеродных групп, НР метильных и формильных от одних орган.соединений другим. Главная актив.форма фолиев.к-ты - тетрагидрофолиевая кислота, образуемая с помощью фермента дигидрофолатредуктазы.

5) Альфа-амилаза крови катализирует гидролиз гликозидных связей крахмала и гликогена, секретируется поджелудочной и слюнными железами, небольшая ее активность обнаруживается в тканях печени и скелетной мускулатуры. Амилаза представлена двумя изоферментами: P-тип, панкреатический (из поджелудочной железы), S-тип, слюнной (из слюнных желез). В отличие от большинства ферментов, α-амилаза фильтруется в клубочках почек и содержится в моче. Существует также макроамилаза, которая не выделяется почками из-за большой величины молекулы, но может встречаться в сыворотке крови в норме и при патологии. Наибольшую диагностическую значимость имеет определение панкреатического изофермента. В сыворотке крови у здоровых людей около 70% амилолитической активности приходится на слюнной изофермент, в моче приблизительно такой же процент приходится на панкреатическую альфа-амилазу. Активность амилазы в сыворотке крови повышается при остром панкреатите (более, чем в 5 раз, в основном, за счет панкреатического изофермента), при раке поджелудочной железы, вирусном гепатите, поражении слюнных желез (эпидемический паротит), почечной недостаточности, при приеме кортикостероидных препаратов, салицилатов, тетрациклина, гистамина.
БИЛЕТ №21
1) (170) . Синтез белка на рибосомах. Условия необходимые для реализации этого процесса.
Рибосомный синтез белка-многоэтапный процесс. Первая стадия (инициация) начинается с присоединения матричной РНК (мРНК) к малой рибосомнойсубчастице, не связанной с большой субчастицей. Характерно, что для начала процесса необходима именно диссоциированная рибосома. К образовавшемуся т. наз. инициаторному комплексу присоединяется большаярибосомнаясубчастица. В стадии инициации участвуют спец. инициирующий кодон (см. Генетический код), инициаторная транспортная РНК (тРНК) и специфич. белки (т. наз. факторы инициации). Пройдя стадию инициации, рибосома переходит к последоват. считыванию кодонов мРНК по направлению от 5'- к 3'-концу, что сопровождается синтезом полипептидной цепи белка, кодируемого этой мРНК (подробнее о механизме синтеза полипептидов см. в ст. Трансляция). В этом процессе рибосома функционирует как циклически работающая мол.машина. Рабочий цикл рибосомы при элонгации состоит из трех тактов: 1) кодонзависимого связывания аминоацил-тРНК (поставляет аминокислоты в рибосому), 2) транспептидации-переноса С-конца растущего пептида на аминоацил-тРНК, т.е. удлинения строящейся белковой цепи на одно звено, 3) транслокации-перемещения матрицы (мРНК) и пептидил-тРНК относительно рибосомы и переход рибосомы в исходное состояние, когда она может воспринять след.аминоацил-тРНК. Когда рибосома достигнет специального терминирующего кодона мРНК, синтез полипептида прекращается. При участии специфич. белков (т. наз. факторов терминации) синтезир. полипептид освобождается из рибосомы. После терминации рибосома может повторить весь цикл с др. цепью мРНК или др. кодирующей последовательностью той же цепи.
2)(103).Челночные механизмы транспорта восстановительных эквивалентов из цитоплазмы в митохондрии. Химизм, медико-биологическое значение.

Челночные механизмы – специальные ферментные системы, необходимые для переноса восстановительных эквивалентов (электронов) из цитоплазмы в митохондрии для их поступления в цепь транспорта электронов и использования в восстановлении кислорода, создания протонного градиента, и получения АТФ за счет окислительного фосфорилирования. Необходимость челночных механизмов связана с особенностями строения митохондриальной мембраны, которая представлена внутренней и наружной мембраной митохондрий. Наружная мембрана митохондрий легко проницаема для всех молекул и ионов небольшого размера. Внутренняя мембрана митохондрий для большинства веществ и ионов даже небольшого размера, в том числе для протонов, НАД+ и НАДН непроницаема. Поэтому для транспорта электронов и протонов используются те вещества, которые легко проходят через внутреннюю мембрану митохондрий и используются в челночных механизмах. К наиболее важным из них относятся глицерофосфатный и малатаспартатный челночные механизмы.
Глицерофосфатный челночный механизм основан на восстановлении образующегося при гликолизе фосфодигидроксиацетона (дигидроксиацетонфосфата) цитоплазматической глицерофосфатдегидрогеназой (1), использующей восстановленный НАДН, до α-глицерофосфата, который лег-ко проникает через обе мембраны митохондрии в матрикс и на внутренней мембране окисляется с помощью митохондриальной ФАД-зависимой глицерофосфатдегидрогеназы (2) до дигидроксиацетонфосфата, легко переходящего через мембраны митохондрии в цитозоль клетки. Образующийся ФАДН2 далее через флавинзависимый транспортирующий электроны фермент ЕТФ отдает свои электроны и протоны на коэнзим Q (убихинон) в митохондриальную цепь транспорта электронов, где в результате использования 2 моль электронов в процессе окислительного фосфорилирования генерируется до 1,5 моль АТФ.
Этот механизм широко используется различными тканями, особенно печеночной и мышечной тканью, в процессе интенсивной мышечной работы.
Малат-аспартатный челночный механизм является более сложным, но и более энергосберегающим. Он использует избыток восстановленного цитоплазматического НАДН в реакции восстановления оксалоацетата (щаве-левоуксусной кислоты) до малата (яблочной кислоты) с помощью НАД- зависимого цитоплазматического фермента малатдегидрогеназы(4). Яб-лочная кислота легко проникает в матрикс через обе мембраны митохондрии, где окисляется митохондриальнойтакже НАД-зависимой, малатдегидро-геназой(5) до оксалоацетата. Далее электроны от полученного НАДН поступают в цепь транспорта электронов, где в процессе окислительного фофорилирования на 2 моль электронов генерируется до 2,5 моль АТФ. Образующийся оксалоацетат не может покинуть митохондрию, он подвергается реакции переаминирования с участием глутаминовой кислоты (глутамата) под действием митохондриальнойаспартатаминотрансферазы(3). В результате образуется аспарагиновая кислота (аспартат), которая с помощью специфической транспортной системы переходит из митохондрии в цитоплазму, где под действием цитоплазматической аспартатаминотрансферазы(2) отдает свою аминогруппу α-кетоглутаровой кислоте (α-кетоглутарат), пре- вращаясь в оксалоацетат. Следует заметить, что α-кетоглутарат и глутамат легко проникают через внутреннюю мембрану митохондрии используя спе- циальную ферментную транспортную систему — глутамат-α-кетоглутарат- транслоказу(1). Внутренняя мембрана митохондрий содержит целый ряд переносчиков для ионов и заряженных метаболитов: например, переносчик дикарбоновых кислот опосредует облегченную обменную диффузию малата, сукцината, фумарата и Н2РО4–, а переносчики трикарбоновых кислот обеспе-чивают обмен ОН– и Н2РО4–. Из наиболее важных транслоказ – ферментов, осуществляющих специфический транспорт веществ через внутреннюю мембрану митохондрий необходимо упомянуть АТФ-АДФ-транслоказу, осуществляющую транспорт в цитоплазму синтезирующейся в митохондриях АТФ в обмен на поступающие в митохондрию АДФ и неорганический фосфат ион, вносящий в митохондрию дополнительный протон.
3)(130). Желчные кислоты и их роль в переваривании липидов. Связь с обменом холестерина.
Желчные кислоты – это стероидные монокарбоновые кислоты, производные холановой кислоты, образующиеся в печени человека и животных и выделяющиеся с желчью в двенадцатиперстную кишку.
Первичные желчные кислоты - холевая кислота и хенодезоксихолевая кислота - синтезируются в печени из холестерина, конъюгируются с глицином или таурином и секретируются в составе желчи. Вторичные желчные кислоты, включая дезоксихолевую кислоту и литохолевую кислоту, образуются из первичных желчных кислот в толстой кишке под действием бактерий. Литохолевая кислота всасывается значительно хуже, чем дезоксихолевая. Другие вторичные желчные кислоты образуются в ничтожно малых количествах. К ним относятся урсодезоксихолевая кислота (стереоизомер хенодезоксихолевой кислоты) и ряд других необычных желчных кислот. При хроническомхолестазе эти кислоты обнаруживаются в повышенных количествах. В норме соотношение количеств желчных кислот, конъюгированных с глицином и таурином, составляет 3:1; при холестазе часто повышены концентрации желчных кислот, конъюгированных с серной и глюкуроновой кислотами.
Желчные кислоты в организме человека выполняют различные функции, основные из них - участие во всасывании жиров из кишечника, регуляция синтеза холестерина и регуляция желчеобразования и желчевыделения.
Желчные кислоты играют важную роль в переваривании и всасывании липидов. В тонкой кишке конъюгированные желчные кислоты, являясь поверхностно-активными веществами, адсорбируются в присутствии свободных жирных кислот и моноглицеридов на поверхности капелек жира, образуя при этом тончайшую пленку, препятствующую слиянию мельчайших капелек жира в более крупные. При этом происходит резкое снижение поверхностного натяжения на границе двух фаз - воды и жира, что приводит к образованию эмульсии с размерами частиц 300-1000 ммк и мице-лярного раствора с размерами частиц 3-30 ммк. Образование мицеллярных растворов облегчает действие панкреатической липазы, которая при воздействии на жиры расщепляет их на глицерин, легко всасывающийся кишечной стенкой, и жирные кислоты, нерастворимые в воде. Желчные кислоты, соединяясь с последними, образуют холеиновые кислоты, хорошо растворимые в воде и поэтому легко всасывающиеся кишечными ворсинками в верхних отделах тонкой кишки. Холеиновые кислоты в виде мицелл всасываются из просвета подвздошной кишки внутрь клеток, сравнительно легко проходя мембраны клеток. Электронно-микроскопические исследования показали, что в клетке связь желчных и жирных кислот распадается: желчные кислоты попадают через портальную вену в кровь и печень, а жирные кислоты, накапливаясь внутри цитоплазмы клеток в виде гроздьев мельчайших капель, являются конечными продуктами всасывания липидов.
Холестерин плохо растворим в воде; его растворимость в желчи зависит от концентрации липидов и соотношения молярных концентраций желчных кислот и лецитина. При нормальном соотношении этих компонентов образуются растворимые смешанные мицеллы, содержащие холестерин, при нарушенном соотношении происходит осаждение кристаллов холестерина.
Помимо того, что желчные кислоты способствуют экскреции холестерина, они необходимы для всасывания жиров в кишечнике, которое также осуществляется посредством образования мицелл.
4) (56) Цикл Кребса. Амфиболические функции цикла трикарбоновых кислот.
Цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в к-е превращ. в пр-се катаболизма большая часть орг. молекул, играющих роль «клеточного топлива»: углеводов, жирных к-т и аминок-т. Данный цикл происходит в матриксе митох. и состоит из 8 последовательных р-ций. Нач. цикл с присоед. ацетил-КоА к оксалоацетату и обр-ия цитрата. Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований и двух декарбоксилирований теряет два углеродных атома и снова в цикле К. превращается в оксалоацетат (четырехуглеродное соединение), т.е. в рез-те полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула оксалоацетата регенерируется. Ц. К. дает поток электронов высокой энергии связ. НАДН2 и ФАДН2 форме.и затем включаеются в процесс окислительного фосфорилирования, где уже снитез.АТФ и образ.вода, При окислении 1 молек. ацетил-КоА в ц. К. и системе окислительного фосфорилирования может обр-ся 12 АТФ.

Амфиболическая – двойственная функция: Катаболическая – распад ацетильных остатков Анаболическая – субстраты цикла Кребса используются для синтеза. Анаболическая – субстраты цикла используются для синтеза многих других соединений: оксалацетат используется для синтеза глюкозы (глюконеогенез) и синтеза аспарагиновой кислоты, ацетил-КоА – для синтеза гема, α-кетоглутарат – для синтеза глютаминовой кислоты, ацетил-КоА – для синтеза жирных кислот, холестерола, стероидных гормонов, ацетоновых тел и др. Катаболическая – в этом цикле завершают свой путь продукты распада глюкозы, жирных кислот, кетогенных аминокислот – все они превращаются в ацетил-КоА; глутаминовая кислота – в α-кетоглутаровую; аспарагиновая – в оксалоацетат и пр.
5) Содержание глюкозы в плазме крови пациента, взятой натощак, оказалось равным 15 мМ. Каковы возможные причины этого явления?
Глюкоза — основной показатель углеводного обмена. Определение глюкозы — обязательный этап в диагностике сахарного диабета. Концентрация глюкозы в крови регулируется гормонами: инсулин является основным
гормоном поджелудочной железы. При его недостатке уровень глюкозы в крови повышается, клетки голодают.
Норма глюкозы у детей до 14 лет — 3,33 — 5,55 ммоль/л, у взрослых норма глюкозы в крови — 3,89 — 5,83 ммоль/л, с 60 лет уровень глюкозы в норме возрастает до 6,38 ммоль/л. При беременности глюкоза в норме — 3,3—6,6 ммоль/л. Гипергликемия может говорить о таких заболеваниях, как: сахарный диабет эндокринные нарушения острый и хронический панкреатит, муковисцидоз опухоли поджелудочной железы
хронические заболевания печени и почек кровоизлияние в мозг инфаркт миокарда. Рост глюкозы происходит после сильных эмоций, стресса и курения, при неправильном питании.
БИЛЕТ №23
1)(178) Незаменимые факторы питания
Незаменимые – значит наиболее важные факторы питания, обеспечивающие защиту организма от неблагоприятных экзогенных и эндогенных факторов. Незаменимые факторы питания обычно подразделяют на две группы: макронутриенты (протеины, жиры, сахариды) и микронутриенты, или минорные питательные вещества, входящие в состав продуктов питания в сверхмалых концентрациях – милли- и микрограммах. Макронутриенты содержатся в пищевых продуктах в сравнительно больших количествах и обеспечивают организм энергией и строительным сырьём. Микронутриенты осуществляют большое количество важных регулирующих, обменных и защитных функций. Незаменимыми факторами питания являются: макроэлементы; микроэлементы; витамины; аминокислоты; незаменимые жирные кислоты и фосфолипиды; клетчатка; различные органические соединения растительного происхождения
2)(67) Иерархия регуляторных систем… Гормоны – вещества органической природы, вырабатываются в специал кл-ках эндокринной желез и пост в кровь и оказ регуляторн влияние на ОВ и физиологич функции. В регуляции процессов гормоны занимают промежут место между Н.С. и действием ферментов. Механизм передачи: на поверхн клеток наход рецепторы узнающ гормональный сигнал, они трансформир его в изменение концентраций внутриклет посредников. Сопряжение рецептора с эффекторн системами осущ через G-белок, котор стимулирует синтез цАМФ, кот запускает каскадный механизм активирования внутриклеточных белков.
3) Желчные кислоты явл. продуктами метаболизма холестерола, образ-ся в гепатоцитах. Различают первичные (холевая, хенодезоксихолевая) и вторичные (дезоксихолевая, литохолевая) желч.к-ты. В желчи конъюгированные с глицином илитаурином (например, гликохолевая к-та, таурохолевая к-та и т.д.). Желчные кислоты принимают непосредственное участие в переваривании жиров в кишечнике: - оказывают на пищевые жиры эмульгирующее действие, - активируют панкреатическую липазу, - способ-т всасыванию жир.к-т и жирорастворим.витаминов, - стимулируют перестальтику кишечника. При нар-и оттока желчи желч.к-ты проникают в кровь и мочу.


4)19 20 28. недостаточность витамина В12 Витамин В12 (или цианокобаламин, кобаламин) — уникальный витамин в организме человека, содержащий незаменимые минеральные элементы. Большое количество витамина B12 необходимо селезенке и почкам, несколько меньше поглощается мышцами. Кроме того, витамин В12 содержится в молоке матери. Характеристика витамина В12: витамин B 12 необходим для образования и созревания эритроцитов витамин B12 влияет на нервную систему, поддерживая ее в здоровом состоянии, снижает раздражительность витамин Б 12 предотвращает появление анемии цианокобаламин участвует в белковом, жировом и углеводном обмене кобаламин участвует в процессе усвоения, транспорта и распада фолиевой кислоты витамин B12 помогает увеличивать энергию витамин Б12 способствует росту и улучшению аппетита витамин B12 помогает улучшить концентрацию, память и равновесие. В организме не происходит синтез витамина Б12, его поступление происходит с продуктами питания — источниками витамина В12. Содержат кобаламин продукты животного происхождения: печень, говядина, рыба, свинина, яйца, молоко, сыр, почки. Благополучному усвоению витамина В12 помешает одновременное употребление кислот, щелочей, воды, алкоголя, эстрогенов, снотворных таблеток. Для благополучного усвоения витамина B12 необходимо достаточное количество кальция, с которым В12 должен вступить во взаимодействие во время принятия пищи для того, чтобы он мог принести пользу для организма. Распад витамина B 12 происходит очень медленно, из организма цианокобаламин выводится желчью. При дефиците В12 в течение около 5—6 лет развивается В12 дефицитная анемия. Норма витамина Б 12: 180 — 900 пг/мл Рекомендуемая суточная доза B12 В12 для взрослых -3 мкг. Дефицит витамина B12 приводит к серьезным, опасным для здоровья последствиям — развивается B 12-дефицитная анемия. Особенно подвержены В12 анемии вегетарианцы и любители диет, исключившие из свого рациона яйца и молочные продукты. При недостатке цианокобаламина происходят изменения в клетках костного мозга, полости рта, языка и желудочно-кишечного тракта, что ведет к нарушению кроветворения, появлению симптомов неврологических расстройств (психические расстройства, полиневриты, поражение спинного мозга). В12-дефицитная анемия (понижение уровня витамина В12) может привести к заболеваниям печени, почек, заболеваниям крови, онкологическим заболеваниям, лейкозам. Дефицит витамина В12 в молоке матери приводит к мегалобластической анемии у ребенка.
БиотинБабы!формула биотина там в конце COOH,а в биоцитине вместо COOH :CO-NH-CH2-CH2-CH2-CH2-CH-NH2-COOH

Отвечает за перенос карбоксигрупп. содерж.в печени, почках и др.;синтез.микрофлорой. Участвует в переносе Со2 или НСО3 (карбоксилировании), или в транскарбоксилировании. Биотин входит в состав пируваткарбоксилазы участвуя в синтезе оксалоацетата. В составе ацетилКоА карбоксилазы участвует в синтезе жир.к-т.(Участвует в переносе CO2.Кофермент-биоцитин,кот входит в состав ферментов карбоксилаз. Витамин называют антисеборрейным,проявлнедост:дерматит,поражногтей,волос,себоррея. Наступает при избыт поступлении белка сырых яиц авидина,кот связывает биотин и предотвращ его всасывание.
5) При определении активности кислой фосфатазы в сыворотке крови, взятой у пациента, активность ее оказалась в 3 раза выше нормы. Ваши коментарии. Кислая фосфатаза — фермент, участвующий в реакциях обмена ионов фосфорной кислоты. Наибольшее содержание (в сотни раз большее по сравнению с другими тканями) обнаруживается в предстательной железе, что используется как очень чувствительный и специфичный показатель ее патологии. Активность кислой фосфатазы повышается при раке предстательной железы далеко не всегда: только у 20-25% больных без метастазов и у 60% больных с метастазами [Vihko P. et al., 1985]. Повышение активности кислой фосфатазы может иметь место при повышенном разрушении тромбоцитов (тробоцитопения, тромбоэмболии и др.), гемолитической болезни, прогрессирующей болезни Педжета, метастатических поражениях костей, миеломной болезни (не всегда), болезни Гоше и Нимана-Пика, через 1-2 дня после операции на предстательной железе или после её биопсии
БИЛЕТ №24
1) Белковые фракции – количественное соотношение фракций общего белка сыворотки крови: альбуминов, α-1- глобулинов, α-2-глобулинов, β-глобулинов и γ-глобулинов. Фракция альбуминов однородна, в норме составляет 50-65% от общего количества белка. Глобулиновые фракции по составу более разнородны. Фракция α-1-глобулинов включает в себя альфа-1-антитрипсин (основной компонент этой фракции) – ингибитор протеолитических ферментов, альфа-1-кислый гликопротеин (орозомукоид) – обладает широким спектром функций, в зоне воспаления способствует фибриллогенезу, альфа-1-липопротеины(функция – участие в транспорте липидов), протромбин и транспортные белки: тироксинсвязывающий глобулин, транкортин (функция – связывание и транспорт кортизола и тироксина соответственно). Фракция α-2-глобулинов преимущественно включает белки острой фазы – альфа-2 макроглобулин, гаптоглобин, церулоплазмин, а также аполипопротеин В. Альфа-2-макроглобулин, являющийся основным компонентом фракции, участвует в развитии инфекционных и воспалительных реакций. Гаптоглобин – это гликопротеин, который образует комплекс с гемоглобином, высвобождающемся из эритроцитов при внутрисосудистом гемолизе. Церулоплазмин специфически связывает ионы меди, а также является оксидазой аскорбиновой кислоты, адреналина, диоксифенилаланина (ДОФА), способен инактивировать свободные радикалы. Альфа-липопротеины участвуют в транспорте липидов. Фракция β-глобулинов содержит трансферрин (главный плазменный белок – переносчик железа), гемопексин (связывает гемм/метгем, вследствие чего предотвращает выведение его почками и потерю железа), компоненты комплемента (которые учавствуют в реакциях иммунитета), бета-липопротеины (принимают участие в транспорте холестерина и фосфолипидов) и часть иммуноглобулинов. Фракция γ-глобулинов состоит из иммуноглобулинов (соответственно порядку количественного убывания – IgG, IgA, IgM, IgE). Функционально иммуноглобулины представляют собой антитела, обеспечивающие гуморальный иммунитет. Общий белок - 64-85 г/л. Сильное понижение (недостаточность фун-й печени): альбумины - 35-50 г/л, пониж-е уровня (болезни почек и печени, мб новообразования): α-1- глобулины - 3,5-6,5%. Повыш.уровня (патология паренхимы печени, остр.воспол.процессы, опухоли): α-2-глобулины - 6,9-10,5%. Повыш.уровня (забол-я с вовлечением соед.тк - коллагенозы, ревматические заб-я, аутоиммун.заб-я, мб цирроз печени): γ-глобулины - 12,8-19%. Повыш.уровня (хрон.активный гепатит, мб цирроз печени): β-глобулины - 7,3-12,5%: Повышение уровня ( возможна механ.желтуха), сниж-е уровня (возможны злокачественные новообр-я). Исследование - ЭФ-анализ - разделение белков в соотв-и с их электрофоретичес.подвиж-ти для анализа компоненты смеси раздел-т на фракции. Энзимодиагностика - исслед-е актив-ти фер-в плазмы крови, мочи слюны с целью диагностики различ.заб-й. Например: опред-е актив-ти лактатдегидрогеназы необходимо при заб-ях сердца,печени. Увелич-е актив-ти альфа-амилазы наблюд-ся при воспал.процессах поджелуд. и слюн.желез. (5)
2) Пентозофосфатный путь превращения глюкозы можно разделить на 2 этапа: окислит. и не окислит. Субстратом является глюкозо-6-фосфат. В окислительной фазе Г-6-Ф необратимо окисляется в пентозу - рибулозо-5-фосфат, и образуется восстанов. NADPH. В неокисл.фазе Р-6-Ф обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза. ПФПуть обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным коферментом NADPH, кот. используется в восстан.процесах.


3) β-окисление ненасыщенных жир.к-т - спец.путь катабализма жир.к-т, продуктом явля-ся ацетил-КоА. Окисление идет по b-углеродному атому. Служит источником энергии для синтеза 12 АТФ. Процесс идет в матриксе митохондрий в аэробных усл-х. Для переноса ацетил-КоА через мембрану митохондрий существует система - в комплексе с молекулой карнитина, фер-т карнитинацилтрансфераза I (ингибитором явл-ся малонил-КоА). 4 реакции b-окисления назыв-ся циклом Т.К. эти 4 реакции повтор-ся до тех пор пока к-та не расщипится на ацетильные остатки. Регуляция: при голодании - глюкагон, в постабсорбтивном периоде - инсулин.

4) Щит.железа секретирует гормноны производные аминок-т, тиреоидные гормноны, и пептидные - кальцитонин и паратгормон. Трийодтиронин и тироксин регулируют энергет.обмен, влияют на дифф.деление клеток, определяя рост и развитие организма. Пептидные - регул-т обмен кальция и фосфатов. Гипофункция проявл-ся в виде судорог, тетании, мб дыхат.паралич, ларингоспазм. Гиперфункция - гиперпаратериоз - первичный - при аденоме желез, появл-ся мочекаменная болезнь, вторичный - при почечной недост-ти. Эндемический заб возникает при недост.поступления йода в организм, уменьш.продукция трийодтиронинов, усил-ся синтез ТТГ, компенсаторное увелич-е щит.жел-зы.

5) В конце беременности, а также в первые 3–4 дня после родов выделяется молозиво — клейкая, густая жидкость желтого цвета, с 4–5 дня — переходное молоко, со 2–3 недели — зрелое молоко. Молозиво богато белками, солями, а также витаминами, лейкоцитами, а также особенными молозивными тельцами. Но оно содержит меньше лактозы, жира, а также водорастворимых витаминов. В молозиве высокий уровень иммуноглобулинов, а также много иных защитных факторов, что даёт возможность его считать не просто продуктом питания, но, а также лекарством. Они обеспечивают первую защиту ребенка, а также предотвращают инфекционно-воспалительные заболевания. Состав женского молока в период лактации меняется в зависимости от периода лактации, времени суток и даже от начала к концу каждого кормления. Содержание некоторых компонентов, например, водорастворимых витаминов (аскорбиновой, никотиновой кислот, тиамина, рибофлавина, пиридоксина) до определенной степени зависит от режима питания матери. Содержание других компонентов, например, железа, не зависит от диеты матери Общее количество белков в женском молоке составляет 0,9-1,0 %, что в 2-3 раза ниже, чем в коровьем молоке. Содержание казеина низкое в начале лактации (соотношение сывороточные белки/казеин 90:10); в зрелом молоке пропорция казеина выше (соотношение сывороточные белки/казеин 60:40))[2] . Размер казеиновых мицелл равен 42 нм. Комплекс частично развернутого альфа-лактальбумина (сывороточный белок грудного молока) и олеиновой кислоты, получивший название вызывает программируемую гибель (апоптоз) опухолевых клеток как in vitro, так и in vivo. Условия, необходимые для образования комплекса HAMLET, присутствуют в желудке ребенка на грудном вскармливании: низкий pH может развернуть молекулу белка за счет высвобождения кальция; там же происходит гидролиз триглицеридов молока кислоточувствительными липазами с высвобождением олеиновой кислоты. Содержание жира колеблется от 2,1 до 5,3 %, при этом жир женского молока содержит в 1,5-2 раза больше ненасыщенных жирных кислот (в том числе незаменимых) по сравнению с жиром коровьего молока. Жир молока тонко диспергирован, что способствует лучшему всасыванию жира организмом ребёнка. Жирность молока обратно пропорциональна наполненности груди: в начале кормления из полной груди ребенок получает т.н. переднее молоко, содержание жира в котором невелико. Такое молоко хорошо утоляет жажду ребенка. Диета матери не влияет на общее содержание жира в молоке. Но при этом состав жирных кислот в молоке зависит от типа жиров в питании женщины. Женское молоко содержит много лактозы — 6.8 % и около 1 % других более сложных олигосахаридов, которые стимулируют развитие в кишечнике грудного ребёнка бифидобактерий. Лактоза важна для усвоения кальция. Высокое содержание лактозы, которая расщепляется на глюкозу и галактозу при переваривании молока, обеспечивает энергией быстро растущий мозг ребенка. В грудном молоке обнаружено около 130 разновидностей олигосахаридов. Олигосахариды могут блокировать антигены и предотвращать их прикрепление к клеткам эпителия. Например, этот механизм блокирует адгезию пневмококка. Олигосахаридом является и содержащийся в грудном молоке бифидус-фактор, который стимулирует рост бифидобактерий в кишечнике ребенка. Грудное молоко содержит активные гидролитические ферменты: липазу, амилазу, протеазу, ксантиноксидазу и характеризуется менее активной пероксидазой и щелочной фосфатазой. Активируемая желчными солями липаза, вырабатываемая молочной железой матери и поступающая в организм ребенка с женским молоком, компенсирует низкое количество собственных ферментов новорожденного и помогает ребенку усваивать жиры. Свободные жирные кислоты, которые образуются при расщеплении жиров в желудочно-кишечном тракте ребенка липазой женского молока, имеют сильное противовирусное и антипротозойное действие. Активируемая желчными солями липаза является основным фактором, инактивирующим патогенных простейших. Женское молоко содержит широкий спектр факторов иммунологической защиты. Основными типами иммунных клеток, которые содержатся в женском молоке являются фагоциты (в основном, макрофаги) (90% популяции клеток), Т-лимфоциты и В-лимфоциты (10% популяции клеток грудного молока). Эти клетки остаются активными в желудочно-кишечном тракте ребенка.Основной класс иммуноглобулинов женского молока составляет секреторный иммуноглобулин А (sIgA). Этот иммуноглобулин защищает слизистые ребенка – главные ворота инфекции для детей этого возраста. В молозиве содержание sIgA достигает 5 г/Л, в зрелом молоке - до 1 г/Л. Секреторный иммуноглобулин А резистентен к низкому рН и протеолитическим ферментам и остается активным в ЖКТ ребенка, покрывая его стенки защитным слоем. Несмотря на то, что концентрация иммуноглобулинов А в зрелом молоке ниже, ребенок получает достаточно этих антител за счет того, что поглощает больший объем молока.
БИЛЕТ №25
1.)(41). Зависимость скорости ферментативной реакции от концентрации субстрата. График Михаэлиса-Ментен. Медико-биологическое значение константы Михаэлиса.
При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax.
График зависимости активности фермента от концентрации субстрата описывается уравнением Михаэлиса – Ментен

где v – скорость ферментативной реакции; [S] – концентрация субстрата; KM – константа Михаэлиса.
физический смысл константы Михаэлиса. При условии, что v = ½ Vmax, получаем KM = [S]. Таким образом, константа Михаэлиса равна концентрации субстрата, при которой скорость реакции равна половине максимальной.

Рис. 2-19. Зависимость скорости реакции (V) от концентрации субстрата S. Vmax - максимальная скорость реакции при данной концентрации фермента в оптимальных условиях проведения реакции. Кm - константа Михаэлиса.
2)(90, 91) Гликогенолиз. Химизм и биологическое значение.
1). (С6Н10О5)n+H3PO4=(C6H10O5)n-1 +глюкозо-1-фосфат
2). глюкозо-1-фосфат-- > глюкозо-6-фосфат -- > глюкоза
Благодаря способности к отложениб гликогена(гл. обр. в печени и мышцах) созд-ся условия для накопления в норме некоторого резерва углеводов .При повышении в организме энергозатрат в результате возбуждения ЦНС, происходит усиление распада гликогена
3) (162). S-аденозилметионин, его химическое строение и роль в метаболизме клетки. Липотропные факторы.
S-аденозилметионин (SAM, SAMe, SAM-e, адеметионин) — это кофермент, принимающий участие в реакциях переноса метильных групп. S-аденозилметионин образуется из АТФ и метионина ферментом метионин аденозилтрансферазой. В клетке участвует в таких метаболических путях, как трансметилирование, транссульфирование и аминопролилирование. И хотя эти анаболические реакции идут во многих тканях организма, большая часть S-аденозилметионина образуется в печени.[1]
Метильная группа (CH3), которая присоединена к атому серы в молекуле метионина в составе S-аденозилметионина является химически активной. Поэтому метильная группа может быть перенесена на молекулу субстрата в трансметилазной реакции. Более сорока метаболических реакций требуют переноса метильной группы от S-аденозилметионина на такие субстраты, как нуклеиновые кислоты, белки и липиды.
Липотропные факторы – все вещества, способствующие синтезу фосфолипидов и препятствующие синтезу ТАГ. К ним относятся: 1.Структурные компоненты фосфолипидов: полиненасыщенные жирные кислоты, инозитол, серин, холин, этаноламин. 2. Метионин – донор метильных групп для синтеза холина и фосфатидилхолина3.Витамины: -пиридоксин (В6), способствующий образованию ФЭА из ФС;-цианкобаламин (В12) и фолиевая кислота, участвующие в образовании активной формы метионина, и, следовательно, в синтезе фосфатидилхолина.
4)(66) Г. передней доли гипофиза.
Гипофиз состоит из трех долей: передней, промежуточной и задней. Первые две доли состоят из железистой ткани и образуются у эмбриона из кармана Ратке – переднего выпячивания кишечной трубки. Заднюю долю образует вырост нервной ткани, идущий от дна промежуточного мозга. Все эти доли фактически являются отдельными железами, и каждая секретирует свои собственные гормоны.
Передняя доля гипофиза вырабатывает белковые гормоны, шесть из которых выделены в химически чистом виде.
Гормон роста.СТГ
На рост организма влияют многие гормоны, но наиболее важную роль в этом сложном процессе играет, видимо, именно гипофизарный гормон роста (соматотропин). После удаления гипофиза рост практически прекращается. Введение этого гормона молодым животным ускоряет рост, а у взрослых может приводить к его возобновлению, причем исследование обмена веществ в этих случаях всегда выявляет снижение экскреции (выведения) азота из организма. Задержка азота – необходимый признак истинного роста, свидетельствующий о том, что действительно происходит образование новых тканей, а не просто увеличение массы тела за счет накопления жира или воды. При патологических процессах, ведущих к снижению функции гипофиза, в отдельных случаях возникает гипофизарная карликовость; такие карлики имеют небольшие размеры тела, но в остальном остаются нормальными людьми. Другие нарушения функции гипофиза могут сопровождаться избыточным выделением гормона роста, порождающим гигантизм. Если большие количества гормона роста вырабатываются до завершения созревания организма, рост увеличивается пропорционально; если же это происходит уже после достижения зрелости, возникает состояние, называемое акромегалией, при котором наблюдается непропорциональный рост отдельных частей тела, поскольку у взрослых некоторые кости теряют способность к дальнейшему удлинению. При акромегалии больной приобретает характерный внешний облик: начинают выдаваться брови, нос и нижняя челюсть, увеличиваются кисти рук, стопы и грудь, спина становится неподвижной, нос и губы утолщаются.
Лактогенный гормон ЛГ
гипофиза (пролактин) стимулирует лактацию – образование молока в молочных железах. Стойкая лактация в сочетании с аменореей (аномальным отсутствием или подавлением менструальных выделений) может возникать при опухоли гипофиза. Это расстройство бывает также связано с нарушениями секреторной активности гипоталамуса, в норме подавляющей высвобождение пролактина. У самок некоторых млекопитающих пролактин влияет и на другие процессы, в частности он может стимулировать секрецию гормона прогестерона желтым телом яичника. Пролактин присутствует в гипофизе особей не только женского, но и мужского пола, причем не только у млекопитающих, но и у низших позвоночных. Относительно его функций в мужском организме и у животных, не относящихся к млекопитающим, известно мало. У некоторых птиц пролактин стимулирует развитие зобного мешка. Поскольку «зобное молоко», вырабатывающееся в этом мешке, служит для вскармливания птенцов, такое действие гормона функционально сходно с его действием у млекопитающих. У рыб пролактин участвует в регуляции осмотического давления крови.
Тиреотропный гормон ТТГ
гипофиза (тиреотропин) стимулирует рост щитовидной железы и ее секреторную активность. После удаления гипофиза функция щитовидной железы полностью прекращается и она уменьшается в размерах. Введение тиреотропина может вызвать избыточную активность щитовидной железы. Таким образом, нарушения ее функции могут быть следствием не только заболеваний самой железы, но и патологических процессов в гипофизе и соответственно требуют разного лечения.
Адренокортикотропный гормон
гипофиза (АКТГ, кортикотропин) стимулирует кору надпочечников подобно тому, как тиреотропный гормон стимулирует щитовидную железу. Одно из различий, однако, заключается в том, что функция коры надпочечников в отсутствие АКТГ прекращается не полностью. Когда стимуляция со стороны гипофиза отсутствует, кора надпочечников сохраняет способность секретировать необходимый для жизни гормон альдостерон, который регулирует содержание натрия и калия в организме. Однако без АКТГ надпочечники вырабатывают недостаточное количество другого жизненно важного гормона, кортизола, и теряют способность усиливать при необходимости его секрецию. Поэтому больные с недостаточностью функции гипофиза становятся очень чувствительны кразличного рода нагрузкам и стрессам. Избыточные количества АКТГ, которые могут вырабатываться при опухолях гипофиза, приводят к развитию потенциально смертельного заболевания, т.н. синдрома Кушинга. К характерным его признакам относятся прибавка в весе, лунообразное лицо, увеличение жировых отложений в верхней части туловища, повышение кровяного давления, мышечная слабость.
Гонадотропные гормоны
(гонадотропины). Передняя доля гипофиза секретирует два гонадотропных гормона. Один из них, фолликулостимулирующий гормонФСГ, стимулирует развитие яйцеклеток в яичниках и сперматозоидов в семенниках. Второй называется лютеинизирующим гормономЛГ; в женском организме он стимулирует выработку в яичниках женских половых гормонов и выход зрелой яйцеклетки из яичника, а в мужском – секрецию гормона тестостерона интерстициальными клетками семенников (см. также РЕПРОДУКЦИЯ ЧЕЛОВЕКА). Введение этих гормонов или их избыточная продукция вследствие заболевания вызывают преждевременное половое развитие незрелого организма. При удалении гипофиза или его разрушении патологическим процессом возникают изменения, сходные с теми, что происходят при кастрации.
Регуляция метаболизма.
Гормоны, секретируемые передней долей гипофиза, необходимы для надлежащего использования в организме углеводов, поступающих с пищей; кроме того, они выполняют и другие важные функции в обмене веществ. Особая роль в регуляции метаболизма принадлежит, по-видимому, гормону роста и адренокортикотропному гормону, которые функционально тесно связаны с гормоном поджелудочной железы, инсулином. Хорошо известно, что в отсутствие инсулина развивается хроническое заболевание – сахарный диабет. При одновременном удалении поджелудочной железы и гипофиза большинство симптомов диабета отсутствует, так что в этом отношении влияние гормонов гипофиза и поджелудочной железы как бы противоположно.
5) В крови новорожденного уровень билирубина составляет 300 мкмоль/л. Каковы
возможные причины, предварительный диагноз?
Появление физиологической желтухи происходит из-за повышения уровня непрямого билирубина у новорожденных (гипербилирубинемия). Гипирбилирубинемия в первые днипосле рождения отмечается у всех новорожденных. Но вот окрашивание кожи в желтый цвет отмечается только у половины детей рожденных в срок. Билирубин откладываясь в верхних слоях кожи, окрашивает её в желтый цвет. Окрашивание кожи происходит при определенном уровне непрямого билирубина. У доношенных детей при уровене билирубина - 85-120 мкмоль\л, у недоношенных - 61-85 мкмоль\л. Так как значение билирубина в данном случае превышают норму, то можно предположить резус конфликт Разрушение эритроцитов может быть вызвано и различными генетически обусловленными нарушениями, как, например, микросфероцитоз ( анемия Минковского- Шоффара ), нарушениями структуры гемоглобина ( например, при серповидно-клеточной анемии ), изменением формы и структуры самого эритроцита и пр. Следует провести фототерапию и переливание крови.
БИЛЕТ №26
1)(8). Строение нуклеиновых кислот. Азотистые основания и сахара, входящие в состав ДНК и РНК. Нуклеозиды и нуклеотиды. Адениловыединуклеотиды (НАД, НАДФ, ФАД). Связи, формирующие первичную структуру ДНК и РНК, –5`-фосфатный и 3`- гидроксильный концы полинуклеотидных цепей. Вторичная структура ДНК и РНК. Денатурация и ренатурация ДНК
Встречаются два типа нуклеиновых кислот: рибонуклеиновая кислота (РНК) и дезоксирибонуклеиновая кислота (ДНК), различающиеся между собой по нуклеотидному составу. Углеводным компонентом РНК является рибоза, а ДНК — дезоксирибоза. В составе РНК встречаются четыре основных азотистых основания — аденин, гуанин, цитозин и урацил. Нуклеотиды, образующие ДНК, также содержат четыре основных азотистых основания — аденин, гуанин, цитозин и тимин.
Один конец РНК заканчивается свободным остатком фосфорной кислоты, который присоединен к пятому атому углерода сахара. Этот конец считают началом полинуклеотидной
Цепи и называют 5-концом. На другом конце РНК у третьего атома углерода сахара оказывается свободной гидроксильная группа. Этот конец называют 3-концом и считают окончанием

Соединения азотистых оснований с рибозой или 2-дезоксирибозой носят название нуклеозиды. Так, например, аденин и рибоза образуют нуклеозид аденозин (1, сокращенно А). Соответствующие производные других азотистых оснований носят названия гуанозин (G), уридин (U), тимидин (T) и цитидин (С). Если углеводный остаток представлен 2-дезоксирибозой образуется дезоксинуклеозид, например 2'-дезоксиаденозин (dA, на схеме не приведен). В клетке 5'-ОН-группа углеводного остатка нуклеозида этерифицирована фосфорной кислотой. Соответствующее производное 2'-дезокситимидина (dT), звено ДНК, называется 2'-дезокситимидин-5'-монофосфат(dTMP) (2).
НАД – никотинамидадениндинуклеотид;
НАДФ – никотинамидадениндинуклеотид фосфат. В состав этих динуклеотидов входит никотинамид (амид никотиновой кислоты, являющееся важным витамином — витамином В5). Молекула НАДФ идентична по структуре НАДс той лишь разницей, что у НАДФ у С-3 атома рибозы ОН-группа замещена остатком молекулы фосфорной кислоты. Молекулы НАД и НФДФ способны к обратимому окислению и восстановлению (благодаря окислительно-восстановительной способности никотинамида), поэтому они участвуют в качестве переносчиков водорода; в реакциях биологического окисления НАД и НАДФ являются кофакторами ферментов дегидрогеназ.
ФАД – флавинадениндинуклеотид. В его состав входит рибофлавин
ФАД, как и другие динуклеотиды, способен обратимо окисляться и восстанавливаться, присоединяя к своей молекуле 2 атома водорода, поэтому он участвует в биологическом окислении в качестве переносчика водорода. Является кофакторомдегидрогеназ, так же, как и НАД и НАДФ.


структура ФАД
Первичная структура нуклеиновых кислот стабилизируется 3',5'-фосфодиэфирными связями. Эти связи образуются при взаимодействии гидроксильной группы в 3'-положении пентозногоостатка каждого нуклеотида с фосфатной группой соседнего нуклеотида, таким образом, на одном конце полинуклеотидной цепи имеется свободная 5'-фосфатная группа (5'-конец), а на другом - свободная гидроксильная группа в 3'-положении (3'-конец). Нуклеотидные последовательности принято записывать в направлении от 5'-конца к 3'-концу.
особенности вторичной структуры ДНК:
1) молекула ДНК построена из двух полинуклеотидных цепей, связанных между собой водородными связями и ориентированных антипараллельно (то есть 3'-конец одной цепи расположен напротив 5'-конца другой цепи и наоборот);
2) водородные связи образуются между комплементарными парами азотистых оснований. Аденину комплементарен тимин; эта пара стабилизируется двумя водородными связями. Гуанину комплементарен цитозин; эта пара стабилизируется тремя водородными связями. Чем больше в молекуле ДНК пар Г-Ц, тем больше её устойчивость к действию высоких температур и ионизирующего излучения;
3) обе цепи ДНК закручены в спираль, имеющую общую ось. Азотистые основания обращены внутрь спирали; кроме водородных, между ними возникают также гидрофобные взаимодействия. Рибозофосфатные части расположены по периферии, образуя остов спирали.
В отличие от ДНК, молекулы РНК построены из одной полинуклеотидной цепи, в которой могут находиться комплементарные друг другу участки. Эти участки могут взаимодействовать между собой, образуя двойные спирали, чередующиеся с неспирализованными участками.
Денатурация — термин биологической химии, означающий потерю белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.
Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют плавлением молекулы.
Практически любое заметное изменение внешних условий, например, нагревание или существенное изменение pH приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др.
Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Визуально это выглядит, например, как образование «белка» при жарке яиц.
Ренатурация — процесс, обратный денатурации, при котором белки возвращают свою природную структуру. Нужно отметить, что не все белки способны ренатурировать; у большинства белков денатурация необратима. Если при денатурации белка физико-химические изменения связаны с переходом полипептидной цепи из плотно упакованного (упорядоченного) состояния в беспорядочное, то при ренатурации проявляется способность белков к самоорганизации, путь которой предопределён последовательностью аминокислот в полипептидной цепи, то есть её первичной структурой, детерминированной наследственной информацией. В живых клетках данная информация, вероятно, является решающей для преобразования неупорядоченной полипептидной цепи во время или после её биосинтеза на рибосоме в структуру нативной молекулы белка. При нагревании двухцепочечных молекул ДНК до температуры около 100°C водородные связи между основаниями разрываются, и комплементарные цепи расходятся — ДНК денатурирует. Однако при медленном охлаждении комплементарные цепи могут вновь соединяться в регулярную двойную спираль. Эта способность ДНК к ренатурации используется для получения искусственных гибридных молекул ДНК (так называемая молекулярная гибридизация).
2)(93). Анаэробный распад глюкозы (анаэробный гликолиз). Гликолитическая оксидоредукция, субстратное фосфорилирование. Биологическое значение анаэробного гликолиза.
Аэробный гликолиз включает - процесс окисления глюкозы с образованием 2 молекул ПВК, общий путь катаболизма, включающий превращение пирувата в ацетил-КоА и его дальнейшее окисление в цитратом цикле; цепь переноса электронов на О2, сопряжённая с р-циями дегидрирования происх. в пр-се распада глюкозы. В результате гликолиза образуется ПВК, который далее окисляется до СО2 и Н2О в ЦТК. Выход АТФ при окислении 1 моль глюкозы до СО2 и Н2О составляет 38 моль АТФ.В процессе аэробного распада глюкозы происходят 6 реакций дегидрирования. Субстраты для специфических НАД-зависимых дегидрогеназ: глицеральдегид-3-фосфат, ПВК, изоцитрат, α-кетоглутарат, малат. Одна реакция дегидрирования в цитратном цикле под действием сукцинатдегидрогеназы происходит с участием ФАД. Общее количество АТФ, синтезированное путём окислит.фофорилирования, составляет 17 АТФ на 1 моль глицеральдегидфосфата. К этому необходимо прибавить 3 АТФ, синтезированных путём субстр. фосфорилирования (две реакции в гликолизе и одна в цитратном цикле). Учитывая, что глюкоза распадается на 2 фосфотриозы и что стехиометрический коэффициент дальнейших превращений равен 2, полученную величину надо умножить на 2, а из результата вычесть 2 АТФ, использованные на первом этапе гликолиза.
Реакции гликолитической оксидоредукции полностью обратимы. В отсутствие кислорода сколько НАДН2 образуется на 6-й стадии, столько же НАДН2 и отдаст свой водород на пируват. Поэтому в анаэробных условиях конечный продукт распада глюкозы — лактат.
Процесс распада глюкозы до лактата в анаэробных условиях — гликолиз, гликогена — гликогенолиз.
Гликолитическая оксидоредукция — сопряжение между 6-й реакцией (окисление ФГА) и 11-й реакцией (восстановление пирувата до лактата) гликолиза.
Субстратноефосфорилирование — процесс образования АТФ, не связанный с мембранами. В этом случае АТФ образуется За счет того, что фосфатная группа перемещается от фосфорилированного соединения (субстрата) к АДФ (например, образование АТФ при гликолизе).
3)(132).Биосинтез кефалина и его биологическое значение.
Биосинтез фосфатидилэтаноламина(кефалина): Первоначально этаноламин при участии соответствующейкиназыфосфорилируется с образованием фосфоэтаноламина:

Затем фосфоэтаноламин взаимодействует с ЦТФ, в результате чего образуются цитидиндифосфатэтаноламин (ЦДФ-этаноламин) и пирофосфат (PPi):

В следующей реакции ЦДФ-этаноламин, взаимодействуя с 1,2-дигли-церидом, образующимся при дефосфорилированиифосфатидной кислоты, превращается в фосфатидилэтаноламин. Реакция катализируется ферментом этаноламинфосфотрансферазой:
ЦДФ-этаноламин + 1,2-диглицерид –>Фосфатидилэтаноламин + ЦМФ.
Кефалины принимают участие в переносе жирных кислот от печени к другим органам и обратно. При недостаточном образовании кефалинов в печени возникает ее ожирение. Кефалины играют определенную роль в процессах свертывания крови, способствуя превращению протромбина в активный тромбин. Кроме того, кефалины, входя в состав цитоплазматических мембран, определяют их проницаемость для других соединений.
4)(33). Токоферолы, их строение и биологическая роль. Представление об антиоксидантах.
Антиоксиданты (антиокислители, консерванты) — ингибиторы окисления, природные или синтетические вещества, способные замедлять окисление (рассматриваются преимущественно в контексте окисления органических соединений).
Витамины группы Е (токоферолы)Витамин Е был выделен из масла зародышей пшеничных зёрен в 1936 г. и получил название токоферол. В настоящее время известно семейство токоферолов и токотриенолов, найденных в природных источниках. Все они - метальные производные исходного соединения токола, по строению очень близки и обозначаются буквами греческого алфавита. Наибольшую биологическую активность проявляет α-токоферол.
Токоферолы представляют собой маслянистую жидкость, хорошо растворимую в органических растворителях.

Источники витамина Е для человека - растительные масла, салат, капуста, семена злаков, сливочное масло, яичный желток.
Суточная потребность взрослого человека в витамине примерно 5 мг.
Биологическая роль. По механизму действия токоферол является биологическим антиоксидантом. Он ингибирует свободнорадикальные реакции в клетках и таким образом препятствует развитию цепных реакций перекисного окисления ненасыщенных жирных кислот в липидах биологических мембран и других молекул, например ДНК (см. раздел 8). Токоферол повышает биологическую активность витамина А, защищая от окисления ненасыщенную боковую цепь.
Клинические проявления недостаточности витамина Е у человека до конца не изучены. Известно положительное влияние витамина Е при лечении нарушения процесса оплодотворения, при повторяющихся непроизвольных абортах, некоторых форм мышечной слабости и дистрофии. Показано применение витамина Е для недоношенных детей и детей, находящихся на искусственном вскармливании, так как в коровьем молоке в 10 раз меньше витамина Е, чем в женском. Дефицит витамина Е проявляется развитием гемолитической анемии, возможно из-за разрушения мембран эритроцитов в результате ПО
5) О чем свидетельствует отсутствие уробилиногена в моче?
Уробилиногеновые тела — производные билирубина.
Билирубин переходит в уробилиноген отчасти уже в желчном пузыре, но окончательно процесс происходит в толстой кишке при помощи кишечной флоры. Бактериальные ферменты перерабатывают пигмент билирубин в уробилиногеновые тела. Из желчных пигментов в моче могут появляться билирубин и уробилиноген. В норме билирубин в общем анализе мочи отсутствует; содержание уробилиногена составляет 5-10 мг/л. Уробилиноген образуется из прямого билирубина, выделившегося с желчью, в тонком кишечнике. Поэтому полное отсутствие уробилиногена служит достоверным признаком прекращения поступления желчи в кишечник, что подтверждает диагноз подпечёночной желтухи при желчно-каменной болезни.
БИЛЕТ №27
1)(6). Глобулярные и фибриллярные белки, простые и сложные. Представления о структуре фибриллярных белков. Коллаген как основной белок соединительной ткани.
Глобулярные белки́ — белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры — глобулы (третичные структуры белка)
Глобулярная структура белков обусловлена гидрофобно-гидрофильными взаимодействиями.К глобулярным белкам относятся ферменты, иммуноглобулины, некоторые гормоны белковой природы (например, инсулин) а также другие белки, выполняющие транспортные, регуляторные и вспомогательные функции.
Фибриллярные белки — белки, имеющие вытянутую нитевидную структуру, в которой отношение длинной оси молекулы к короткой (степень асимметрии) составляет от 80 до 150. Большинство фибриллярных белков не растворяется в воде, имеют большую молекулярную массу и высокорегулярную пространственную структуру, которая стабилизируется, главным образом, взаимодействиями (в том числе и ковалентными) между различными полипептидными цепями. Первичная и вторичная структурафибриллярного белка также, как правило, регулярна[1]. Полипептидные цепи многих фибриллярных белков расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слои.
К фибриллярным белкам относят:
α-структурные фибриллярные белки (кератины, на долю которых приходится почти весь сухой вес волос и других роговых покровов, тропомиозин, белки промежуточных филаментов); β-структурные фибриллярные белки (фиброин шёлка); коллаген — белок сухожилий и хрящей.
Коллаге́н — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов. Это основной компонент соединительной ткани и самый распространённый белок у млекопитающих,составляющий от 25% до 35% белков во всём теле.
Просты́е белки́ — белки, которые построены из остатков α-аминокислот и при гидролизе распадаются только на аминокислоты.
Простые белки по растворимости в воде и солевых растворах условно подразделяются на несколько групп: протамины, гистоны, альбумины, глобулины, проламины,глютелины.
Среди глобулярных белков можно выделить:
альбумины — растворимы в воде в широком интервале рН (от 4 до 8,5), осаждаются 70-100%-ным раствором сульфата аммония;
полифункциональные глобулины с большей молекулярной массой, труднее растворимы в воде, растворимы в солевых растворах, часто содержат углеводную часть;
гистоны — низкомолекулярные белки с высоким содержанием в молекуле остатков аргинина и лизина, что обусловливает их основные свойства;
протамины отличаются еще более высоким содержанием аргинина (до 85 %), как и гистоны, образуют устойчивые ассоциаты с нуклеиновыми кислотами, выступают как регуляторные и репрессорные белки — составная часть нуклеопротеинов;
проламины характеризуются высоким содержанием глутаминовой кислоты (30-45 %) и пролина (до 15 %), нерастворимы в воде, растворяются в 50-90 % этаноле;
глутелины содержат около 45 % глутаминовой кислоты, как и проламины, чаще содержатся в белках злаков.
Фибриллярные белки характеризуются волокнистой структурой, практически нерастворимы в воде и солевых растворах. Полипептидные цепи в молекулах расположены параллельно одна другой. Участвуют в образовании структурных элементов соединительной ткани (коллагены, кератины, эластины).
Сло́жные белки́ (протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизесложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада.
В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы[1]:
1.Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
2.Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
3.Металлопротеиды, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин итрансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
4.Нуклеопротеиды, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом[2].
5.Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока[3]:
6.Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем —гемоглобин, цитохромы и др.), хлорофиллы; флавопротеиды с флавиновой группой, и др.
2)(82). Глюкоза как важнейший метаболит углеводного обмена: общая схема источников и путей расходования глюкозы в организме. Взаимопревращения моносахаридов.
Глюкоза же проникает внутрь клетки очень легко и окисляется очень быстро, поэтому – то глюкоза и рассматривается нами как основное энергетическое вещество.
Гликоген печени и мышц тоже вначале распадается до глюкозы и, лишь потом включается в энергетический обмен.
Источниками глюкозы являются фрукты, цветочный нектар, различные растения, их сок, а также кровь.
инсулин контролирует расходование глюкозы.
При физической активности происходит увеличение чувствительности тканей к инсулину и активное расходование глюкозы в мышцах — это приводит к снижению уровня глюкозы крови.клетки расходуют глюкозу неравномерно: во время тяжелой работы топлива требуется больше, чем во время отдыха. Если в крови находится глюкозы больше, чем это требуется в данный момент клеткам, избыток сахара поступает с кровью в печень, где он снова полимеризуется в длинные молекулы животного крахмала гликогена.
Взаимопревращения моносахаридов происходят в результате действия соот¬ветствующих ферментов, катализирующих реакции фосфорилирования и образо¬вания фосфорных эфиров сахаров. Разнообразные гексозофосфорные эфиры най¬дены в целом ряде растений. Так, напри¬мер, под действием фермента гексокиназы глюкоза превращается в глюкозо-6 фосфат. Под действием фермента глюкозофосфатизомеразы происходит обратимое превращение глюкозо- 6-фосфата во фруктозо-6-фосфат и маннозо-6-фосфат. В результате действия фос¬фоглюкомутазы глюкозо-6-фосфат может обратимо превращаться в глюкозо-1-¬фосфат. Фосфофруктокиназа катализирует превращение фруктозо-6-фосфата во фруктозо-1,6-дифосфат.
3)(136) . Строение холестерина и его биологическое значение. Представление о биосинтезе холестерина.
Холестерин в крови существует в нескольких различных по своему строению формах. Все они объединены одним общим названием - липопротеиды, т.е. соединение липидов (и холестерина) с белковой молекулой. Синтез липопротеидов плазмы крови происходит в печени. Холестерин, который попадает в организм с пищей, полностью усваивается, однако это приводит к увеличению синтеза в печени собственного холестерина. Липопротеиды плазмы крови содержат нейтральный жир, эфиры холестерина, фосфолипиды, белок и свободный холестерин. Существуют несколько основных разновидностей липопротеидов. Все они различаются своими размерами. Самые крупные из них-1 хиломикроны, далее следуют пре-бета-липопротеиды (липопротеиды очень низкой плотности (ЛПОНП)), бета-липопротеиды, (липопротеиды низкой плотности (ЛПНП)) и самые маленькие-альфа-липопротеиды (липопротеиды высокой плотности (ЛПВП)). Хиломикроны не могут проникнуть в сосудистую стенку из-за больших размеров.
Протекает в основном в печени на мембранах эндоплазматическогоретикулумагепатоцитов. Этот холестерин - эндогенный. Происходит постоянный транспорт холестерина из печени в ткани. Для построения мембран используется также пищевой (экзогенный) холестерин. Ключевой фермент биосинтеза холестерина - ГМГ-редуктаза (бета-гидрокси, бета-метил, глутарил-КоАредуктаза). Этот фермент ингибируется по принципу отрицательной обратной связи конечным продуктом – холестерино
Именно на "холестериновом каркасе" держатся все остальные компоненты клеточной мембраны.
Достаточное количество холестерина необходимо для нормального функционирования клеточных мембран. Холестерин совершенно необходим для деления клеток в качестве строительного материала. Особенно необходим холестерин детскому растущему организму, когда идет интенсивное деление клеток. Синтез холестерина обусловлен генетически, без него (холестерина) организм не мог бы существовать, не мог бы расти и развиваться.
Клетка использует холестерин для построения мембран, часть его этерифицируется. Молекулы холестерина плазматических мембран, оказавшись в сыворотке крови, начинают афферентный путь к печени в составе ЛПВП. Поступивший в печень в составе ЛПВП холестерин подвергается микросомальномугидроксилированию, превращаясь в желчные кислоты, а также экскретируется с желчью в форме свободного холестерина или его эфиров.
Входя в состав межклеточных мембран, обеспечивающий их жесткость и препятствующий слиянию клетки со свободно циркулирующими межклеточными жидкостями.
Но не только в обеспечении строения клетки состоит биологическая роль и главное значение холестерина в организме. Он также участвует в синтезе многих гормонов, выработке витамина D, в обеспечении нервной деятельности и в работе головного мозга. Более того, считается, что огромное значение он имеет в поддержании иммунитета и в борьбе с раковыми клетками в организме
4) (76) Гормоны щитовидной железы.
Тироксин и трийодтиронин.явл. производным L-тиронина. к-й синт-ся из L-тирозина. Тироксин в 4 положениях кольцевой структуры йод. Биосинт. тироксина в фоллик. щит.ж-зыпроисх. путем конденсации 2 ост. молек. дийодтирозина, вх. в сост. тиреоглобулина - гликопротеина, сод. около 5 тыс. аминокислот ост. Йодирование тирозина осущ. путем ферментат окисления йодидов.Регулируют скорость основного обмена, рост и диффер. тканей, обмен белков, липидов, углеводов, липидов, водно-электролит. обм., деят-тьцнс, пищ. тракта. гемопоэз, ф-циюссс, потреб. в витаминах, сопрот. орг-ма инфекциям. Спциф. рецеп. обесп. транспорт тиреоидныхгорм. в ядро и взаимод. со струк. генами, в рез-те чего увелич. синтез ферментов. регулир. ск-тьок-восст. процессов.Кальцитонин - гормон пептидной природы. 32 ам-т. Сод.дисульфид. мостик между 1 и 7 аминокислот. ост. Подавляет резорбтивных процессов в костной ткани, выз. гипокальциемию и гипофосфатемию. Гипотиреозразв. вслед.недост. йодтиронинов, вслед. недост. ф-ции щит. ж-зы, заб гипофиза и гипоталамуса. Мекседемаобусл. избыточным накоплением глюкозаминогликанов и воды. В подкожклнакапл. глюкуроновая к-та. Избыт глик-оввыз. изм-е коллоидной струк. межклет. матрикса, усил. его гидрофильность и связ. ионы Nа. сниж. осн. обмен, ск-ти гликолиза, мобилиз. гликогена и жиров.потреб. глюкозы м-цами, сниж. теплопрод. Эндемический зобвозн. при недост. поступ. йода в орг., уменьш. продукция трийодтиронинов, усил-ся синтез ТТГ, компенсатор.увелич. щит. ж-зы. Гипертиреозвознвледповыш. продукции трийодтиронинов. Увелич. осн. обмен, усил. пр-сы катаболизма. Б-ньГрейвавозн. в рез-теобр-я АТ к тиреоидным АГ. IgG имитирует действие тиреотропина, взаимод. с рецеп. на мембране кл. щит.ж-зы, что прив. к разрастанию тк. щит. ж-зы и неконтролир. продук. Т3 и Т4. ТТГ снижен.
5) Содержание лактата в крови больного 55 лет достигает 8 ммоль/л( норма до 2,1 ммоль/л). Каковы возможные причины? Какие метаболические нарушения связаны с лактацидозом?
Повышение уровня молочной кислоты в крови, обусловленное гипоксией, наблюдается при тяжелой физической нагрузке, шоке, кровотечении, сепсисе, инфаркте миокарда, тромбоэмболии легочной артерии, остановке сердца. При отсутствии явных причин нарушения тканевой перфузии причиной повышенного содержания молочной кислоты в крови могут быть такие заболевания, как сахарный диабет, лейкоз и лимфомы, поражение печени, почечная недостаточность, а также недостаточность некоторых ферментов (болезнь Гирке - дефицит глюкозо-6фосфатазы, недостаточность фруктозо-1,6-бисфосфатазы).лактатацидоз может развиться после приема больших доз ацетаминофена и этанола, а также после внутривенного введения адреналина, глюкагона, фруктозы или сорбитола. В патологии лактоацидоз (закисление крови вследствие накопления лактата) чаще всего наблюдается при уменьшении доставки кислорода к тканям (тип А), вследствие снижения кровотока (шок, сепсис) или снижения парциального давления кислорода (тяжёлые заболевания лёгких, задержка дыхания). Реже причиной лактоацидоза являются метаболические сдвиги, приводящие к увеличению продукции лактата (тип В) – например, повышенная мышечная активность (чрезмерная физическая нагрузка, эпилептический статус), опухоли (особенно лейкемии и лимфомы) или изменения метаболизма печени (алкогольная интоксикация). Лактатный ацидоз — один из вариантов метаболического ацидоза, который можно заподозрить при высоком анионном дефиците (разность между концентрацией натрия и суммарной концентрацией хлорида и бикарбонатов > 18 ммоль/л) и отсутствии других причин, таких как почечная недостаточность, приём салицилатов, отравление метанолом, злоупотребление этанолом, значительная кетонемия. Лактат является метаболическим продуктом пропиленгликоля, входящего в состав растворителя для многих внутривенных препаратов. У пациентов со сниженной функцией почек при продолжительных инфузиях таких растворов может накапливаться повышенное количество лактата.
БИЛЕТ №28
1) (117)Липидный состав мембран….
В мембранах имеются фосфолипиды 2 типов — глицерофосфолипиды и сфингофосфолипиды. 1ые- явл. производными фосфатидной к-ты (диацилглицеринфосфата).2ые сод. аминоспирт сфингозин и явл. производными церамидов.
Холестерин
— относится к стероидами.
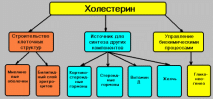 Физические свойства мембран зависят
от расположения белков в липидном слое.
Липиды и белки мембран способны к
диффузии в пределах слоя параллельно
поверхности мембраны (латеральная
диффузия). Фосфолипазы- ферменты класса
гидролаз, катал. гидролиз фосфоглицеридов.
В зав-ти от положения гидролизуемой
связи в фосфолипиде различают 4 осн.
класса : A, B, C и D.Фосфолипиды в кишеч.
подвергаются дейст. фосфолипазыА2,
катализир. гидролиз. сложноэфирной
связи в -положении. Глицрофосфолипиды
расщеп. с обр-м лизофосфолипида и жир.
к-ты. Лизофосфо-липид подв.
дейст.лизофосфолипазы панкр. сока,
обр-ся глицерофосфохолин. который всас.
в кровь
Физические свойства мембран зависят
от расположения белков в липидном слое.
Липиды и белки мембран способны к
диффузии в пределах слоя параллельно
поверхности мембраны (латеральная
диффузия). Фосфолипазы- ферменты класса
гидролаз, катал. гидролиз фосфоглицеридов.
В зав-ти от положения гидролизуемой
связи в фосфолипиде различают 4 осн.
класса : A, B, C и D.Фосфолипиды в кишеч.
подвергаются дейст. фосфолипазыА2,
катализир. гидролиз. сложноэфирной
связи в -положении. Глицрофосфолипиды
расщеп. с обр-м лизофосфолипида и жир.
к-ты. Лизофосфо-липид подв.
дейст.лизофосфолипазы панкр. сока,
обр-ся глицерофосфохолин. который всас.
в кровь
(85)Аэробный распад глюкозы…
Аэробный гликолиз - процесс окисления глюкозы с образованием двух молекул пирувата. Главный путь утилизации глюкозы. При расщ. 1 молекулы глюкозы в тканях синтезируется 38 молекул АТФ.В результате этих процессов глюкоза распадается до CO2 и H2O, а освобождающаяся энергия используется для синтеза АТФ. при распаде 1 моль ацетил-КоА образуется 12 моль АТФ, следовательно, из 2 моль ацетил-КоА - 24 моль АТФ.
Суммируя энергетические эффекты всех этапов распада глюкозы в аэробных условиях, получаем 38 моль АТФ.


Второй этап – окислительное декарбоксилирование пвк
Третий этап - цтк
3)(161)Строение аргинина и гистидина. Их роль в ОВ.
Аргинин. Ф-ции: -используется в синтезе креатина, который в виде креатинфосфата способен служить источником энергии для работы мышц человека и млекопитающих.
-служит источником NO в организме;
-служит предшественником орнитина, из которого синтезируются полиамины спермидин и спермин. Аргинин служит в организме источником оксида азота (NO). Образование NO в клетках катализирует сложный Са2 зависимый фермент NO-синтаза. В состав фермента входит гем.




4)(67)Гормоны задней доли гипофиза ….
Вазопрессин(АДГ) и окситоцин отклад. в зад. доле. АДГ усиливает реабсорбцию воды в почечных канальцах, стимулирует сокращение гл.мышц артериол и капилляров. Окситоцин стимулирует сокращение гладких мышц матки, кишечника, желчного пузыря, мочевого пузыря, уретры, уч-т в процессе родов, стимулирует выделение молока. Действует на клетки-мишени через цАМФ.
5) Что такое гиперхолестеринемия и ее значение для сердечно-сосудистой патологии.
Состояние организма, при котором отмечается повышенный уровень холестерина и триглицеридов в крови врачи называют гиперлипидемией. Повышенный холестерин или гиперхолестеринемия приводит к образованию
атеросклеротических бляшек: холестирин присоединяется к стенкам сосудов, сужая просвет внутри них. На холестериновых бляшках образуются тромбы, которые могут оторваться и попасть в кровеносное русло, вызвав закупорку сосудов в различных органах и тканях, что может привести к атеросклерозу, инфаркту миокарда и другим заболеваниям.
БИЛЕТ №29
хз какой вопрос среди всех,но смотреть в дыхатцепь,тамсвязывать.НАД-зависимые дегидрогеназы. В качестве кофермента содержат НАД и НАДФ. Пиридиновое кольцо никотинамида способно присоединять электроны и протоны водорода.НАД(Ф) -зависимые дегидрогеназы, катализирующие отры водорода от молекул различных субстратов и передающие его на стартовый переносчик дыхательной цепи - НАД(Ф)*Н2-дегидрогеназу, - растворимые ферменты.Известно более 250 НАД(Ф)-зависимых дегидрогеназ, активно участвующих в реакциях промежуточного обмена. Но не все из них имеют отношение к энергетическому метаболизму. С помощью дегидрогеназ осуществляется перенос гидрид-иона (2е + Н+ переходит в Н-) от субстрата к НАД(Ф), при этом в среду переходит протон ( рис. 93 , А). Атом водорода входит в состав пиридинового кольца , а электрон присоединяется к азоту пиридинового кольца . После восстановления НАД(Ф)*Н2 отщепляется от активного центра фермента и переносится к мембране, где акцептируется флавиновойдегидрогеназой и передает ей восстановительные эквиваленты. Одновременно к дегидрогеназе, освобожденной от кофермента, присоединяется окисленная молекула НАД(Ф) , поступающая из среды. Таким образом, особенность НАД(Ф) - их подвижность, позволяющая им курсировать от молекул-доноров электронов, находящихся в цитоплазме, к акцепторам электронов, локализованным в мембране.Субстраты тканевого дыхания :НАД-зависимые – субстраты цикла Кребса изоцитрат, α-кетоглутарат и малат. Это также пируват, гидроксибутират и β–гидрокси-ацил~КоА, глутамат и некоторые другие аминокислоты. Водород от НАД-зависимых субстратов c помощью НАД-зависимых дегидрогеназ передаётся на I-й комплекс дыхательной цепи.

2)87 ГЛИКОГЕН (от греч. glykys-сладкий и греч. -genes-рождающий, рожденный) (С6Н10О5)„, разветвленный полисахарид, молекулы к-рого построены из остатков1113-27.jpg-D-глюкопиранозы со связями 1 -> 4 в линейных участках и 1->6 в разветвлениях (ф-лу участка молекулы гликогена см. в ст. Гликозилтрансферазы). Точки ветвления во внутр. участках молекулы расположены через 3-4 остатка моносахарида, хотя в среднем одно разветвление приходится на 10-12 глюкозильныхостатков.Гликоген-аморфный продукт; мол. м. 106-109,1113-28.jpg + 196° (вода); хорошо раств. в воде (р-рыопалесцируют), из к-рой осаждается спиртом или (NH4)2SO4; раств. также в ДМСО; характеристич. вязкость 6,5-14,3 мл/г. К-тамигидролизуется, причем вначале образуются декстрины, а в конце р-ции - глюкоза. К действию конц. р-ров щелочей довольно устойчив. Водные р-ры гликогенаокрашиваются иодом (1113-29.jpg 410-490 нм), что используется для качеств.обнаружения полисахарида. Образует комплексы со мн. белками, напр. с альбумином и конканавалиномА.Гликоген содержится во всех тканях животных и человека и представляет собой резервное в-во (в растениях такие ф-ции выполняет крахмал), легко расщепляющееся под действием ряда ферментов до глюкозы. Обнаружен также в нек-рых бактериях, грибах и зернах растений. У человека Наиб.богаты гликогеном печень (2-6% от массы сырой ткани) и мышцы (до 2%). В тканях животных гликоген присутствует в виде частиц, наз. гликогеносомами. Наиб.крупные из них, т.н.1113-30.jpg-частицы (диам. 100-200 нм), собраны из1113-31.jpg-частиц (диам. 30-40 нм). Встречаются также еще более мелкие1113-32.jpg частицы (3-20 нм).Биосинтез гликогена осуществляется с помощью ферментов гликозилтрансфераз. Исходным в-вом для синтеза может служить молекула олигосахарида, состоящая из остатков глюкозы, или белок, глюкозилированный в результате переноса на него остатка глюкозы с уридиндифосфатглюкозы. Гликоген расщепляется с помощью фермента фосфорилазы, переносящей остаток глюкозы на фосфорную к-ту с образованием1113-33.jpg -D-глюкозо-!-фосфата, и разл. гидролаз (напр.,1113-34.jpg-глюкозидазы), катализирующих гидролиз связей 1 -> 4 и 1 -> 6. Распад и синтез гликогена регулируется гормонами надпочечников и поджелудочной железы, напр. инсулином и адреналином.Гликоген экстрагируют из тканей 60%-ным кипящим водным р-ром КОН, холодным р-ром трихлоруксусной к-ты или смесью фенола и воды с послед. осаждением этанолом; при этом гликоген частично разлагается. Нативный гликоген выделяют экстракцией водой на холоду в присут. солей Hg.Нарушение обмена гликогена приводит к заболеваниям (гликогенозам), связанным с накоплением его в больших кол-вах в организме (гл. обр. в печени и сердце) или образованием молекул с отклонениями в строении.
Прежде всего глюкоза подвергается фосфорилированию при участии фермента гексокиназы, а в печени – и глюкокиназы. Далее глюкозо-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фос-фат:

Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена. На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с УТФ (уридинтрифосфат), образуя уридиндифосфатглюкозу (УДФ-глюкоза) и пирофосфат. Данная реакция катализируется ферментом глюкозо-1-фосфат-уридилилтрансферазой (УДФГ-пирофосфорилаза):Глюкозо-1-фосфат + УТФ < = > УДФ-глюкоза + Пирофосфат.Приводим структурную формулу УДФ-глюкозы:
На второй стадии – стадии образования гликогена – происходит перенос глюкозного остатка, входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена («затравочное» количество). При этом образуется α-(1–>4)-связь между первым атомом углерода добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы цепи. Эта реакция катализируется ферментом гликогенсинтазой. Необходимо еще раз подчеркнуть, что реакция, катализируемая гликогенсинтазой, возможна только при условии, что полисахаридная цепь уже содержит более 4 остатков D-глю-козы

Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и таким образом весь цикл превращений глюкозо-1-фосфата начинается сначала.
Ветвление повышает растворимость гликогена. Кроме того, благодаря ветвлению создается большое количество невосстанавливающих концевых остатков, которые являются местами действия гликогенфосфорилазы и гликогенсинтазы.Таким образом, ветвление увеличивает скорость синтеза и расщепления гликогена.Благодаря способности к отложению гликогена (главным образом в печени и мышцах и в меньшей степени в других органах и тканях) создаются условия для накопления в норме некоторого резерва углеводов. При повышении энерготрат в организме в результате возбуждения ЦНС обычно происходят усиление распада гликогена и образование глюкозы.Помимо непосредственной передачи нервных импульсов к эффекторным органам и тканям, при возбуждении ЦНС повышаются функции ряда желез внутренней секреции (мозговое вещество надпочечников, щитовидная железа, гипофиз и др.), гормоны которых активируют распад гликогена, прежде всего в печени и мышцах (см. главу 8).Как отмечалось, эффект катехоламинов в значительной мере опосредован действием цАМФ, который активирует протеинкиназы тканей. При участии последних происходит фосфорилирование ряда белков, в том числе гликогенсинтазы и фосфорилазы b – ферментов, участвующих в обмене углеводов. Фосфорилированный фермент гликогенсинтаза сам по себе малоактивен или полностью неактивен, но в значительной мере активируется положительным модулятором глюкозо-6-фосфатом, который увеличивает Vmaxфермента. Эта форма гликогенсинтазы называется D-формой, или зависимой (dependent) формой, поскольку ее активность зависит от глюкозо-6-фосфата. Дефосфорилированная форма гликоген-синтазы, называемая также I-формой, или независимой (independent) формой, активна и в отсутствие глюкозо-6-фосфата.Таким образом, адреналин оказывает двойное действие на обмен углеводов: ингибирует синтез гликогена из УДФ-глюкозы, поскольку для проявления максимальной активности D-формы гликогенсинтазы нужны очень высокие концентрации глюкозо-6-фосфата, и ускоряет распад гликогена, так как способствует образованию активной фосфорилазы а. В целом суммарный результат действия адреналина состоит в ускорении превращения гликогена в глюкозу.
144 145 Под термином «кетоновые (ацетоновые) тела» подразумевают ацетоук-сусную кислоту (ацетоацетат) СН3СОСН2СООН, β-оксимасляную кислоту (β-оксибутират, или D-3-гидроксибутират) СН3СНОНСН2СООН и ацетон СН3СОСН3.В здоровом организме ацетон в крови присутствует в крайне низких концентрациях, образуется в результате спонтанного декарбоксилированияацетоацетата и, по-видимому, не имеет определенного физиологического значения.Кетоновые тела образуются в печени. При голодании глюкагон(адреналин при тяж.физ.работе) ч/з аденилатциклазную с-му в жировой ткани активирует распад жира. Жир.к-ты выделяются в кровь и транспортируются в комплексе с альбуминами. Концентрация ацетил-КоА повышена в рез-те активного b-окисления, и исп.для синтеза кетоновых тел. регуляция этого синтеза осущ.за счет ГМГ-КоАсинтазы. Печень, эритроциты не окисляют кетоновые тела и исп. их только на «экспорт». При длительном головании, когда печень выраб.ок.50%жир.к-т в др.источникиобр.кетоновые тела- b-гидроксибутират, ацетоацетат, ацетон. В норме их число 1-3мг/дл. Их кл-во так же увелич. При длит.физ.нагрузке, употреблении пищи, богатой жирами, но с низким содерж.углеводов, сахарном диабете. Кет.тела-водорастворимы и могут проходить ч/з гематоэнцефалический барьер и служат ист.энергии для нервной ткани. При избытке кетоновых тел в крови развивается метаболический ацидоз. Синтез их идет в митох.печени и немного в корковом слое почек



4)75 Адреналин и норадреналин- катехоламины, нейромедиаторы. Из метаболит.пути: фенилаланин - тирозин - ДОФА - дофамин - норадреналин - адреналин. Адреналин-секретируется в состояниях стресса, кровопотерь. Обеспечивает повыш.АД за счет сужения сосудов кожи, ЖКТ а и скелетной мускулатуры, усиливает и учащает сердечные сокращения, повышает уровень глюкозы крови. По химическому строению норадреналин отличается от него отсутствием метильной группы у атома азота аминогруппы боковой цепи, его действие как гормона во многом синергично с действием адреналина.
Возник катехоламины из тирозина.влияют на углеводный и липидный обмены усил распад гликогена в мышцах и мобилизацию гликогена в печени возник гипергликимия. Стимул липолиз в жировой ткани и поступл кислот в кровь.дофамин медиатор в н. с.


5) Атеросклероз - наиболее распространенное хроническое заболевание артерий, с
формированием одиночных и множественных очагов липидных, главным образом
холестериновых отложений — бляшек во внутренней оболочке артерий. Последующие
разрастания в ней соединительной ткани (склероз) и отложение кальция в стенки сосуда
приводят к деформации и сужению его просвета вплоть до полной закупорки артерии. Тем самым вызывается недостаточность кровоснабжения органа, питаемого через пораженнуюартерию. Кроме того, возможна острая закупорка (окклюзия) просвета артерии либотромбом, либо (значительно реже) содержимым распавшейся бляшки, либо и тем и другимодновременно, что ведет к образованию очагов некроза (инфаркт) или гангрены в органе,который питается этой артерией.Атеросклероз встречается с наибольшей частотой у мужчин в возрасте 50—60 и у женщинстарше 60 лет.
Несомненно значение так называемых факторов риска развития атеросклероза.
Приобретенные факторы риска:
— курение,
— избыточная масса тела,
— высокий уровень холестерина в крови,
— высокое давление,
— стрессы,
— малоподвижный образ жизни.
Атеросклероз возникает при повышении уровень холестерина в крови (>6 ммоль\л ). Кол-во лонп не должно превышать 3,0 ммоль/л и должно составлять не более 75% от общего уровня липопротеидов. А доля липопротеидов высокой плотности должна составлять примерно 25 %от общего холестерина и быть > 1,0 -1,2 ммоль/л.
БИЛЕТ №30
1)(11)Витамины-органические низкомолекулярные биолог. Акт. Вещества,не синтезирующ. В клетках организма человека(за искл неск),поступающих в организм из внешней среды и принимающие участие в биологическом катализе.Витамины делят на жирорастворимые и водорастворимые,жирор:ADEKF,водорастворимые:b1 B2 B6 B12 B15 PPCPU, биотин,пантотеновая кислота,фолиевая кта,липоевая кта.Витамины — жизненно важные органический соединения, необх. в ничтожных количествах, но имеющие огромное значение для нормального роста, развития. поступают с раст.пищей/живот.,и не синтезируются в организме. Исключения составляют витамин К, достаточное количество которого в норме синтезируется в толстом кишечнике человека за счёт деятельности бактерий, и витамин В3, синтезируемый бактериями кишечника из аминокислоты триптофана.Большинство витаминов – предшественники коферментов. При нормальном питании суточная потребность организма в витаминах удовлетворяется полностью. Важная роль в обеспечении организма рядом витаминов (К, B12, H) принадлежит микрофлоре пищ.тракта. Гиповитаминоз-недостаточная обеспеченность организма витамином;авитоминоз-состояние,возникающее при полном прекращении поступления витамина в орг,гипервитаминоз-состояние,возник. При чрезмерно большом поступлении витамина в организм.Коферменты, или коэнзимы — малые молекулы небелковой природы, специфически соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие роль активного центра или простетической группы молекулы фермента.кофактор- небелковое вещество, которое обязательно должно присутствовать в организме в небольших количествах, чтобы соответствующие ферменты смогли выполнить свои функции. В состав кофактора входят коферменты и ионы металлов (например, ионы натрия и калия).
2)(84) Галактоземия - возникает при нарушении обмена галактозы в рез-те недостатка фермента галактоза-1-фосфатуридилтрансферазы. Проявл. у н/р, питающихся материнским молоком. ранние симптомы - рвота, диарея, дегидратация. уменьш. массы тела. В крови, моче и тканях повышается конц-ция галактозы и галактозо-1-фосфата. Накопление галактозо-1-фосфата в печени приводит к токсич. возд. на гепатоциты. возн. гепатомегалия и жировая дистрофия печени. Непереносимость фруктозы. Наруш.работы 2фермента-фруктокиназы клин. не проявляется. Фруктоза накапливается в крови и выделяется с мочой. где ее можно обнаружить лаб. методами.Непереносимость дисахаридов —обусл. наруш. расщепления и всас. дисахаридов; выз-т непереносимость лактозы, сахарозы и/или мальтозы; проявл. расстр. пищевар. в виде хронич. фермент. диспепсии.Недост. лактазы проявл. неперенос. материнского и коровьего молока, богатого лактозой. При вскарм. молоком у ребёнка появл. кишеч. колики, метеоризм, упорная диарея, разв. гипотрофия. Испраж. водянистые, пенистые, с кислой р-цией. Недост. сахаразы — неперен. сахарозы, клин. проявляется диареей после включения в пищу сахарозы, клин. картина зависит от кол-ва принятого дисахарида. Испр. водянистые, пенистые, с высоким сод-м молоч к-ты и летучих жирных кислот.
3)(134,129) Фосфолипи́ды — сложные липиды, сложные эфиры многоатомных спиртов и высших жирных кислот. Содержат остаток фосфорной кислоты и соединенную с ней добавочную группу атомов различной химической природы. Они есть во всех живых клетках. 1)глицерофосфолипиды— содержат остаток глицерина :фосфатидилхолин (лецитин);фосфатидилэтаноламин (кефалин);фосфатидилсерин 2)фосфосфинголипиды — содержат остаток сфингозина сфингомиелины;3)фосфоинозитиды — содержат остаток инозитола. Центральную роль в биосинтезе фосфолипидов играют 1,2-диглицериды (в синтезе фосфатидилхолинов и фосфатидилэтаноламинов), фосфатидная кислота (в синтезе фосфатидилинозитов) и сфингозин (в синтезе сфин-гомиелинов). Цитидинтрифосфат (ЦТФ) участвует в синтезе практически всех фосфолипидов. Главный липидный компонент клеточных мембран. Они сопутствуют жирам в пище и служат источником фосфорной кислоты, необходимый для жизни человека. Фосфолипиды являются важной частью клеточных мембран. Они обеспечивают текучие и пластические свойства мембран клеток и клеточных органоидов, в то время как холестерин обеспечивает жёсткость и стабильность мембран. Как фосфолипиды, так и холестерин часто входят в состав липопротеидов клеточных мембран, но имеются в мембранах и в свободном, не связанном с белками состоянии. Соотношение холестерин/фосфолипиды в основном и определяет текучесть либо жёсткость клеточной мембраны.Фосфолипиды участвуют в транспорте жиров, жирных кислот и холестерина. Между плазмой и эритроцитами происходит обмен фосфолипидами, которые играют важнейшую роль, поддерживая в растворимом состоянии неполярные липиды. Будучи более гидрофильными, чем холестерин, благодаря наличию в молекуле остатков фосфорной кислоты, фосфолипиды являются своеобразными «растворителями» для холестерина и других высоко гидрофобных соединений. Среди липидов есть также и вторичные посредники — вещества, участвующие в передаче сигнала от гормонов или других биологически активных веществ внутри клетки. В частности фосфатидилинозитол-4,5-бифосфат (ФИ (4,5) Ф2) задействован в сигнализировании при участии G-белков, фосфатидилинозитол-3,4,5-трифосфат инициирует образование супрамолекулярных комплексов сигнальных белков в ответ на действие определённых внеклеточных факторов, сфинголипиды, такие как сфингомиелин и цермаид, могут регулировать активность протеинкиназы.Гликолипиды-сложные липиды, образующиеся в результате соединения липидов с углеводами. Главной формой гликолипидов в животных тканях явл. Гликосфинголипиды. Они содержат церамид,сост. Из спирта сфингозина и остатка жирной кислоты,и один или неск остатков сахаров. Простейшими гликосфинголипидами явл 1)галактозилцерамиды и 2)глюкозилцерамиды. 1)явл главными сфинголипидами мозга и др нервных тк. 2) Простые гликосфинголипиды в тканях, отличных от нервной, представлены главным образом глюкозилцерамидом; в небольших количествах он имеется и в ткани мозга. Гликосфинголипиды, являющиеся компонентами наружного слоя плазматической мембраны, могут участвовать в межклеточных взаимодействиях и контактах. Некоторые из них являются антигенами, например антиген Форссмана и вещества, определяющие группы крови системы АВ0. Сходные олигосахаридные цепи обнаружены и у других гликопротеинов плазматической мембраны. Ряд ганглиозидов функционирует в качестве рецепторов бактериальных токсинов (например, холерного токсина, который запускает процесс активации аденилатциклазы).Биосинтез фосфолипидов и их биологическая роль. Биосинтез происх. в печени, стенки кишеч., семенниках, яичниах, мол. ж-зе, ЭПС. Центр. роль в биосинтезе играют 1,2-диглицериды и сфингозин. ЦТФ. Фосфатидилэтаноламин-кефалин синт. из этаноламина. и явл. предш. Фосфатидилхолина-лецитин. Сфингомиелин синт-ся в рез-те р-ции церамида с ЦДФ-холином. Различные типы фосфолипаз, лок. в кл. мембранах или в лизосомах, катализируют гидролиз глицерофосфолипидов. Фосфолипиды играют важную роль в струк. и ф-ции клеточ. мембр.. актив. мембр. и лизосомальных ферм., проведении нерв. имп., сверт. крови, иммунологич. р-циях, процессах кл. пролиферации и регенерации тк., переносе эл. в цепи дыхат. ферм. формир. липопрот. комплексы.
4)(156)Из
организма аммиак выводится в
виде конечных продуктов азотистого
обмена: мочевины, аммонийных солей.
Основной р-цией обезвреживания
явл.синтез глутамина.
Глутамин можно считать транспортной формой аммиака, он явл. нейтр.ам-к и способен легко проникать в кл.мембраны путем облегченной диффузии. В печени аммиак обезвреживается путем связывания с СЩ2 и образования карбамоилфосфата, используется 2АТФ. Затем карбамоилфосфат исп. В орнитиновом цикле

Мочевая кислота является фракцией остаточного азота и конечным продуктом обмена пуриновых оснований (аденина и гуанина). М.к-та, выводимая с мочой отражает поступление пуринов с пищей и распад эндогенных пуриновых нуклеотидов
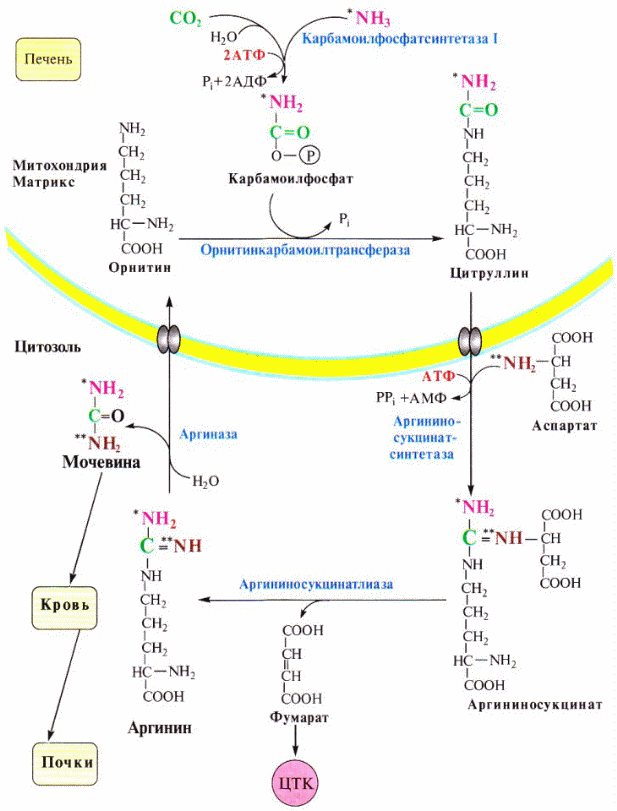
Орнитиновый цикл в печени выполняет 2 ф-ции – превращение азота ам-к в мочевину, кот.экскретируется и помогает избежать накопления аммиака в организме.; синтез аргинина и пополнение его фонда в организме.
2
варик В организме человека подвергается
распаду около 70 г аминокислот в сутки,
при этом в результате реакций
дезаминирования и окисления биогенных
аминов освобождается большое количество
аммиака, являющегося высокотоксичным
соединением. Поэтому концентрация
аммиака в организме должна сохраняться
на низком уровне. Действительно, уровень
аммиака в крови в норме не превышает
60 мкмоль/л (это почти в 100 раз меньше
концентрации глюкозы в крови). В опытах
на кроликах показано, что концентрация
аммиака 3 ммоль/л является летальной.
Таким образом, аммиак должен подвергаться
связыванию в тканях с образованием
нетоксичных соединений, легко выделяющихся
с мочой. Один из путей связывания и
обезвреживания аммиака в организме, в
частности в мозге, сетчатке, почках,
печени и мышцах,– это биосинтез глутамина
(и, возможно, аспарагина). Глутамин и
аспарагин выделяются с мочой в небольшом
количестве. Было высказано предположение,
что они выполняют скорее транспортную
функцию переноса аммиака в нетоксичной
форме. Ниже приводится химическая
реакция синтеза глутамина, катализируемого
глутаминсинтетазой.
Механизм этой синтетазной реакции, подробно изученный А. Майсте-ром, включает ряд стадий. Синтез глутамина в присутствии глутамин-синтетазы может быть представлен в следующем виде:

Биосинтез аспарагина протекает несколько отлично и зависит от природы ферментов и донора аммиака. Так, у микроорганизмов и в животных тканях открыта специфическая аммиакзависимая аспарагинсинтетаза, которая катализирует синтез аспарагина в две стадии:

В животных тканях содержится, кроме того, глутаминзависимая аспа-рагинсинтетаза, которая для синтеза во второй стадии использует амидную группу глутамина:б) Е-аспартил~АМФ + Глн -> Асн + Е + АМФ + Глу.Суммарная ферментативная реакция синтеза аспарагина может быть представлена в следующем виде:Асп + АТФ + NН3 (или Глн) –> Асн + АМФ + РРi + (Глу).Видно, что энергетически синтез аспарагина обходится организму дороже, поскольку образовавшийся РРi далее распадается на ортофосфат.Часть аммиака легко связывается с α-кетоглутаровой кислотой благодаря обратимости глутаматдегидрогеназной реакции. Если учесть связывание одной молекулы аммиака при синтезе глутамина, то нетрудно видеть, что в организме имеется хорошо функционирующая система, связывающая две молекулы аммиака:

Глутамин, кроме того, используется почками в качестве резервного источника аммиака (образуется из глутамина под действием глутаминазы), необходимого для нейтрализации кислых продуктов обмена при ацидозе и защищающего тем самым организм от потери с мочой используемых для этих целей ионов Na+.
5) Что такое гиперурикемия и возможные причины ее возникновения?
)Мочевая кислота выводит избыток азота из организма человека. Мочевая кислота синтезируется в печени и в виде соли натрия содержится в плазме крови. За выведение мочевой кислоты из крови человека отвечают почки. При нарушении деятельности почек, происходит нарушение обмена мочевой кислоты. Как следствие — накопление в крови солей натрия, уровень мочевой кислоты растет, вызывая разнообразные повреждения органов и тканей. Норма мочевой кислоты для детей до 14 лет — 0,120 — 0,320 ммоль/л, для взрослых женщин — 0,150 — 0,350 ммоль/л. Для взрослых мужчин норма уровня мочевой кислоты — 0, 210 — 0,420 ммоль/л. Причины повышения мочевой кислоты Повышение мочевой кислоты или гиперурикемия — основной симптом первичной и вторичной подагры. Гиперурикемия может возникать из за нарушения фермента ФРДФ- синтетаза, гипоксантин-гуанинфософорибозилтрансферраза (синлром Леши-Нихена) или аденинфосфорибоилтрансфераза. В диагностике подагры анализ мочевой кислоты имеет важное значение. Поскольку первичная подагра может протекать бессимптомно, проявляясь только в повышении уровня мочевой кислоты. Вторичная подагра может быть вызвана нарушениями в работе почек,злокачественными образованиями, разрушениями тканей или голоданием. Первичная подагра развивается на фоне замедления вывода мочевой кислоты из организма или при преизбыточном синтезе мочевой кислоты. Кристаллы мочевой кислоты могут откладываться в суставах, подкожной клетчатке, почках. В результате развивается подагра, хронический артрит.
БИЛЕТ №31
1) Вторичная структура ДНК образ-ся за счет взаимод-я нуклеотидов (в больш.степени азот.оснований) между собой, водород.связей. Классический пример вторич.стру-ры ДНК - двойная спираль Днк, состоящая из 2х полинуклеотидных цепей ДНК. Постороение каждой новой цепи осущест-ся по принципу комплиментарности, т.е. кажджому азот.основанию одной цепи ДНК соотв-ет строго опред.основание др.цепи(А-Т, Г-Ц).Относительно втор.структуры тРНК наиболее вероятной представляется модель Р.Холли, плоское изображение в виде *клеверного листа*. Молекула РНК построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки"(несколько шпилек -> клевер), за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не вписывающиеся в двойную спираль.Принцип комплиментарности испол-ся в биосинтезе ДНК, это строгое соответствие соединения азот.оснований, соедененными водород.связями, в кот. Аденин с Тимином, а Гуанин с Цитозином. Денатурация ДНК происходит при нагревании раствора до 70-100 *,а так же в сильнокислой и щелочных средах+в мочевине. В результате разрушения водород. и гидрофоб.связей цепи расходяться и принимают конформацию беспорядочного клубка. Тем-ра денатурации зависит от состава ДНК(больше Г-Ц пар, больше тем-ра). Ренатурация при понижении тем-ры или рН. При резком понижении тем-ры или рН правильное воссоед-е комплем-х цепей затрудняется из-за спарив.оснований локально комплем-х участков в пределах одной или разных цепей. (Ренатурация - обратное от денатурации) Гибритизация ДНК, гибритизация нукл.к-т - комбинирование комплем-х одноцепочных нукл.к-т в одну молекулу. При полной комплементарности объединение происходит легко, а в случае отличий слияние цепочек замедляется, что позволяет оценить степень комплементарности. Возможна гибритизация ДНК-ДНК и ДНК-РНК, используется в молекулярной генетике, суд.медицине, антропологии для установления генетич.родства меджу видами. (9 и 10)
2) (149) Декарбоксилирование ак.
Процесс отщепления карбокс.группы аминок-т в виде СО2, необратимая реакция. R-CH(NH2)-COOH --> R-CH2-NH2 + CO2. Несмотря на огранич.круг аминок-т, подвергающиеся декарбоксилированию в живот.тканях, образующиеся продукты реакции - биогенные амины(гистамин, g-аминомаслян.к-та, серотонин и др) оказывают сильное фармакол.дей-е на физиолог.функции организма. НР: гистамин оказывает сосудорасшир.дей-е, g-аминомаслян.к-та оказывает тормозящее дей-е на ЦНС. (149)
3) Цикл Кребса - общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в кот-е превращ. в процессе катаболизма большая часть орг.молекул, играющих роль "клеточного топлива" углеводов,жир.к-т и аминок-т. Данный цикл проходит в матриксе митох-й и состоит из 8 послед.реа-й. Начинается цикл с присоед-я ацетил-КоА к оксалоацетату и образования цитрата. Затем лиммонюк-та (6ти-углеродное соед-е) путем ряда дегидрирования и 2х дерабоксилирований теряет 2 углеродных атома и снова в ЦТК превращается в оксалоацетат(4х-углеродное соед-е),т.е в рез-те полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула оксалоацетата регенерируется. Ц.Кребса дает паток электронов в высокой энергии связ. НАДН2 и ФАДН2 форме и затем включаются в процесс окислит.фосфорилирования, где уже синтез-ся АТФ и обр-ся вода. При окислении 1 молекулы ацетил-КоА в ЦТК и системе окислит.фосфорилирования может образов-ся 12 АТФ.
Картинка вопрос 52-53
4) (69) Химическое строение гормонов коркового вещества надпочесников.
Гормоны коркого в-ва надпочечников: глюкокортикостероиды(влияют на обмен Б,У,Ж и нукл.к-т) и менералокортикостероиды(обмен солей и воды). к первым - кортикостерон,кортизон,гидрокортизон(кортизол), ко вторым - дезоксикортикостерон и альдестерон. В основе их структуры как и в основе холестрина,желчн.к-т,половых гор-в, лежит конденсированная кольцевая с-ма циклопентанпергидрофенанирена. Для этих гормонов общим в строении оказалось наличие 21 углеродного атома(=>производные прегнана). Кроме того, для всех биоактив.гормонов кор.в-ва надпочечников характерны: наличие двойной связи между 4 и 5 углерод.атомами, кетонной группы (С=О) у 3го углеродн.атома, боковая цепь (-СО-СН2-ОН) у 17го углер.атома. Глюкокортикостероиды- в мыш., лимф., соед. и жир.тканях вызывает снижение проницаемости клет.мембран и торможение поглощения глюкозы и аминок-т, а в печени противоположное дей-е. Итог-гипергликемия. Минералокортикостероиды регулируют обмен Na,K,Cl и воды, способствуют удержанию ионов Cl и Na в организме и выведению с мочой ионов К.
5) Гипераммониемия - это наследственное заболевание обмена веществ, проявляющееся в недостаточности цикла ферментов мочевины, приводящее к отравлению организма аммиаком. При повышении концентрации аммиака (гипераммониемия) до предельных величин может наступить кома и смерть. При хронической гипераммониемии развивается умственная отсталость. Транзиторной гипераммониемией называется также пограничное состояние, присущее новорожденным детям в период адаптации к внеутробной жизни, проявляющееся обычно на вторые – трети сутки жизни. Часть детей не проявляет симптоматики клинической картины гипераммониемии: признаки угнетения центральной нервной системы (вялость, понижение мышечного тонуса, приступы апноэ, ослабленная реакция зрачков на свет, отказ от еды, ступор и кома), а также расстройства дыхательной функции, желтуха, судороги и обезвоживание. Причиной вызывающей гипераммониемию называют кислородное голодание, или гипоксию, во время беременности и в процессе родов. Приобретенная (вторичные) гипераммониемия развивается вследствие заболеваний печени и вирусных инфекций. В крайне тяжелых случаях она проявляется как тошнота, рвота, судороги, нечленораздельная речь, затуманивание зрения, тремор, нарушение координации движений. Наследственные формы гипераммониемии вызваны генетическим дефектом любого из пяти ферментов синтеза мочевины. Соответственно ферменту заболевание делится на пять типов. Первичными признаками гипераммониемий являются сонливость, отказ от пищи, рвота, беспокойство, судороги, нарушение координации движений, тахипноэ, дыхательный алкалоз. Могут развиться печеночная недостаточность, легочные и внутричерепные кровоизлияния. Наиболее частой является гипераммониемия типа II, связанная с недостатком орнитин-карбамоилтрансферазы. Заболевание рецессивно, сцеплено с Х-хромосомой. У матери также наблюдается гипераммониемия и отвращение к белковым продуктам. При полном дефекте фермента наследственные гипераммониемии имеют раннее начало (в период до 48 часов после рождения)
БИЛЕТ №32
1) Окислительное фосфолирование - образование АТФ из аденозиндифосфорной и фосфорной к-т за счет энергии, освоб-ся при ок-ии орг. в-в в живых кл. Каждая ок. р-ция в соответствии с величиной высвобождаемой энергии «обслуживается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. Соотв-но своим ок-восст. потенциалам эти соединения в восстановленной форме подключаются к дыхат. цепи. Разобщение процессов дыхания и окислительного фосфорилированияпроисходит если протоны начинают проникать через внутреннюю мембрану митохондрий. В этом случае выравнивается градиент рН и исчезает движущая сила фосфорилирования. Хим. в-ва - разобщители называются протонофорами, они способны переносить протоны через мембрану. К таковым относятся 2,4 -динитрофенол, гормоны щитовидной железы и др. В норме скорость митохондриального транспорта электронов регул-ся содержанием АДФ. Выполнение кл. ф-ций с затратой АТФ приводит к накоплению АДФ, к-й в свою очередь активирует тканевое дыхание. Т. о., клеткам свойственно реагировать на интенс-тьклет. метаболизма и поддерживать запасы АТФ на необходимом уровне. Это свойство называется дыхательным контролем.(второй варик)
ОКИСЛИТЕЛЬНОЕ
ФОСФОРИЛИРОВАНИЕ, синтез АТФ из
аденозиндифосфата и неорг. фосфата,
осуществляющийся в живых клетках,
благодаря энергии, выделяющейся при
окислении орг. в-в в процессе клеточного
дыхания. В общем виде окислительное
фосфорилирование и его место в обмене
в-в можно представить схемой:
АН2-орг. в-ва, окисляемые в дыхат. цепи (т. наз. субстраты окисления, или дыхания), АДФ-аденозиндифосфат, Р-неорг. фосфат.Поскольку АТФ необходим для осуществления мн. процессов, требующих затраты энергии (биосинтез, совершение мех. работы, транспорт в-в и др.), Окислительное фосфорилирование играет важнейшую роль в жизнедеятельности аэробных организмов. Образование АТФ в клетке происходит также благодаря др. процессам, напр. в ходе гликолиза и разл. типов брожения, протекающих без участия кислорода. Их вклад в синтез АТФ в условиях аэробного дыхания составляет незначит. часть от вклада окислительного фосфорилирования (ок. 5%).Митохондрии окружены белково-фосфолипидной мембраной. Внутри митохондрий (в т. наз. матриксе) идет ряд метаболич. процессов распада пищ. в-в, поставляющих субстраты окисления АН2 для окислительного фосфорилирования. Наиб. важные из этих процессов -трикарбоновых кислот цикл и т. наз.3504-58.jpg-окисление жирных к-т (окислит. расщепление жирной к-ты с образованием ацетил-кофермента А и к-ты, содержащей на 2 атома С меньше, чем исходная; вновь образующаяся жирная к-та также может подвергаться 3504-59.jpg-окислению). Интермедиаты этих процессов подвергаются дегидрированию (окислению) при участии ферментов дегидрогеназ; затем электроны передаются в дыхат. цепь митохондрий-ансамбль окислит.-восстановит. ферментов, встроенных во внутр. митохонд-риальную мембрану. Дыхат. цепь осуществляет многоступенчатый экзэргонич. перенос электронов (сопровождается уменьшением своб. энергии) от субстратов к кислороду, а высвобождающаяся энергия используется расположенным в той же мембране ферментом АТФ-синтетазой, для фос-форилирования АДФ до АТФ. В интактной (неповрежденной) митохондриальной мембране перенос электронов в дыхат. цепи и фосфорилирование тесно сопряжены между собой. Так, напр., выключение фосфорилирования по исчерпании АДФ либо неорг. фосфата сопровождается торможением дыхания (эффект дыхат. контроля). Большое число повреждающих митохондриальную мембрану воздействий нарушает сопряжение между окислением и фосфори-лированием, разрешая идти переносу электронов и в отсутствие синтеза АТФ (эффект разобщения).
Обычно для характеристики эффективности окислительного фосфорилирования используют величины Н+/2е или q/2e, указывающие сколько протонов (либо электрич. зарядов) переносится через мембрану при транспорте пары электронов через данный участок дыхат. цепи, а также отношение Н+/АТФ, показывающее, сколько протонов нужно перенести снаружи внутрь митохондрий через АТФ-синтетазу для синтеза 1 молекулы АТФ. Величина q/2e составляет для пунктов сопряжения 1, 2 и 3 соотв. 3-4, 2 и 4. Величина Н+/АТФ при синтезе АТФ внутри митохондрий равна 2; однако еще один Н+ может тратиться на вынос синтезированного АТФ4- из матрикса в цитоплазму переносчиком адениновых нуклеотидов в обмен на АДФ -3 . Поэтому кажущаяся величина Н+ / АТФнаружн равна 3. В организме окислительное фосфорилирование подавляется мн. токсичными в-вами, к-рые по месту их действия можно разделить на три группы: 1) ингибиторы дыхат. цепи, или т. наз. дыхат. яды (см. Дыхание). 2) Ингибиторы АТФ-синтетазы. Наиб.распространенные ингибиторы этого класса, употребляемые в лаб. исследованиях, - антибиотик олигомицин и модификатор карбоксильных групп белка дициклогексилкарбодиимид. 3) Т. наз. разобщители окислительного фосфорилирования. Они не подавляют ни перенос электронов, ни собственно фосфорилирование АДФ, но обладают способностью уменьшать величину 3504-79.jpg на мембране, благодаря чему нарушается энергетич. сопряжение между дыханием и синтезом АТФ. Разобщающее действие проявляет большое число соед. самой разнообразной хим. структуры. Классич. разобщители - в-ва, обладающие слабыми кислотными св-вами, способные проникать через мембрану как в ионизованной (депротонированной), так и в нейтральной (протонированной) формах. К таким в-вам относят, напр., 1-(2-дицианометилен)гидразино-4-трифтор-метоксибензол, или карбонилцианид-n-трифторметокси-фенилгидразон, и 2,4-динитрофенол (соотв. ф-лы I и II; показаны протонир. и депротонир. формы).Разобщающим действием обладают также ионофоры (напр., грамицидин), повышающие электропроводность мембраны в результате образования ионных каналов или в-ва, разрушающие мембрану (напр., детергенты).Окислительное фосфорилирование открыто В. А. Энгельгардтом в 1930 при работе с эритроцитами птиц. В 1939 В. А. Белицер и Е. Т. Цыбакова показали, что окислительное фосфорилирование сопряжено с переносом электронов в процессе дыхания; к такому же заключению несколько позднее пришел Г. М. Калькар
2)97 98
Глюконеогенез – синтез глюкозы из неуглеводных продуктов. Такими продуктами или метаболитами являются в первую очередь молочная и пи-ровиноградная кислоты, так называемые гликогенные аминокислоты, гли-церол и ряд других соединений. Иными словами, предшественниками глюкозы в глюконеогенезе может быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла трикарбоновых кислот.У позвоночных наиболее интенсивно глюконеогенез протекает в клетках печени и почек (в корковом веществе).Большинство стадий глюконеогенеза представляет собой обращение реакции гликолиза. Только 3 реакции гликолиза (гексокиназная, фосфо-фруктокиназная и пируваткиназная) необратимы, поэтому в процесс глю-конеогенеза на 3 этапах используются другие ферменты. Рассмотрим путь синтеза глюкозы из пирувата.
Образование
фосфоенолпирувата из пирувата. Синтез
фосфоенолпирувата осуществляется в
несколько этапов. Первоначально пируват
под влиянием пируваткарбоксилазы и
при участии СО2и АТФ карбоксилируется
с образованием оксалоацетата:
Затем оксалоацетат в результате декарбоксилирования и фосфорилирования под влиянием фермента фосфоенолпируваткарбоксилазы превращается в фосфоенолпируват. Донором фосфатного остатка в реакции служит гуанозинтрифосфат (ГТФ):

Установлено,
что в процессе образования фосфоенолпирувата
участвуют ферменты цитозоля и
митохондрий.Первый этап синтеза
протекает в митохондриях (рис. 10.6).
Пируват-карбоксилаза, которая катализирует
эту реакцию, является
аллостери-ческиммитохондриальным
ферментом. В качестве аллостерического
активатора данного фермента необходим
ацетил-КоА. Мембрана митохондрий
непроницаема для образовавшегосяоксалоацетата.
Последний здесь же, в митохондриях,
восстанавливается в малат
Реакция протекает при участии митохондриальной НАД-зависимой малатдегидрогеназы. В митохондриях отношение НАДН/НАД+ относительно велико, в связи с чем внутримитохондриальныйоксалоацетат легко восстанавливается в малат, который легко выходит из митохондрии через митохондриальную мембрану. В цитозоле отношение НАДН/НАД+ очень мало, и малат вновь окисляется при участии цитоплазматической НАД-зависимой малатдегидрогеназы:

Дальнейшее превращение оксалоацетата в фосфоенолпируват происходит в цитозолеклетки.Превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат. Фосфо-енолпируват, образовавшийся из пирувата, в результате ряда обратимых реакций гликолиза превращается во фруктозо-1,6-бисфосфат. Далее следует фосфофруктокиназная реакция, которая необратима. Глюконеогенез идет в обход этой эндергонической реакции. Превращение фруктозо-1,6-бис-фосфата во фруктозо-6-фосфат катализируется специфической фосфатазой:

Образование фосфоенол-пирувата из пирувата. 1 - пируваткарбоксилаза; 2 - малатде-гидрогеназа (митохондриальная); 3 -малатдегидрогеназа (цитоплазматиче-ская); 4 - фосфоенолпируват-карбокси-киназа.

. Гликолиз и глюконеогенез. Красными стрелками указаны «обходные» пути глюконеогенеза при биосинтезе глюкозы из пирувата и лактата; цифры в кружках обозначают соответствующую стадию гликолиза.Образование глюкозы из глюкозо-6-фосфата. В последующей обратимой стадии биосинтеза глюкозы фруктозо-6-фосфат превращается в глюкозо-6-фосфат. Последний может дефосфорилироваться (т.е. реакция идет в обход гексокиназной реакции) под влиянием фермента глюкозо-6-фосфатазы:
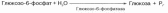
Регуляция глюконеогенеза. Важным моментом в регуляции глюконеоге-неза является реакция, катализируемая пируваткарбоксилазой. Роль положительного аллостерического модулятора этого фермента выполняет ацетил-КоА. В отсутствие ацетил-КоА фермент почти полностью лишен активности. Когда в клетке накапливается митохондриальный ацетил-КоА, биосинтез глюкозы из пирувата усиливается. Известно, что ацетил-КоА одновременно является отрицательным модулятором пируватдегидроге-назного комплекса (см. далее). Следовательно, накопление ацетил-КоА замедляет окислительное декарбоксилированиепирувата, что также способствует превращению последнего в глюкозу.Другой важный момент в регуляции глюконеогенеза – реакция, катализируемая фруктозо-1,6-бисфосфатазой – ферментом, который ингибиру-ется АМФ. Противоположное действие АМФ оказывает на фосфофруктокиназу, т. е. для этого фермента он является аллостерическим активатором. При низкой концентрации АМФ и высоком уровне АТФ происходит стимуляция глюконеогенеза. Напротив, когда величина отношения АТФ/АМФ мала, в клетке наблюдается расщепление глюкозы.Показано, что глюконеогенез может регулироваться и непрямым путем, т.е. через изменение активности фермента, непосредственно не участвующего в синтезе глюкозы. Так, установлено, что фермент гликолиза пиру-ваткиназа существует в 2 формах – L и М. Форма L (от англ. liver – печень) преобладает в тканях, способных к глюконеогенезу. Эта форма ингиби-руется избытком АТФ и некоторыми аминокислотами, в частности ала-нином. М-форма (от англ. muscle – мышцы) такой регуляции не подвержена. В условиях достаточного обеспечения клетки энергией происходит инги-бирование L-формы пируваткиназы. Как следствие ингибирования замедляется гликолиз и создаются условия, благоприятствующие глюконеоге-незу. Наконец, интересно отметить, что между гликолизом, интенсивно протекающим в мышечной ткани при ее активной деятельности, и глюко-неогенезом, особенно характерным для печеночной ткани, существует тесная взаимосвязь. При максимальной активности мышц в результате усиления гликолиза образуется избыток молочной кислоты, диффундирующей в кровь, в печени значительная ее часть превращается в глюкозу (глюконеогенез). Такая глюкоза затем может быть использована как энергетический субстрат, необходимый для деятельности мышечной ткани. Взаимосвязь между процессами гликолиза в мышечной ткани и глюконеогенезом в печени может быть представлена в виде схемы:

3)12.Витамины участвуют во множестве биохимических реакций, выполняя каталитическую функцию в составе активных центров большого количества разнообразных ферментов либо выступая информационными регуляторными посредниками, выполняя сигнальные функции экзогенных прогормонов и гормонов. Коферменты, или коэнзимы — малые молекулы небелковой природы, специфически соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие роль активного центра или простетической группы молекулы фермента. Комплекс кофермента и апофермента образует целостную, биологически активную молекулу фермента, называемую холоферментом Роль коферментов нередко играют витамины или их метаболиты. Например, коферментом фермента карбоксилазы является тиаминпирофосфат, коферментом многих аминотрансфераз — пиридоксаль-6-фосфат.
Кофакторы вещества, необходимые для каталитического действия того или иного фермента. К. — непременный компонент большинства ферментных систем. Флавиновые коферменты принимают участие в большом числе ОВР. Среди них: а) дегид-рогеназы, такие как NADH-дегидрогеназа, являющаяся частью дыхательной цепи; б) флавиноксидазы, например оксидаза D-ами-нокислот; в) флавиноксигеназы, часто участвующие в реакциях гидроксилирования. Особенно важная роль принадлежит флави-новым коферментам в дыхательной цепи.
4)71-72
Предш. - холестерол, к-й поступ. из плазмы в иде ЛПНП, либо синт. в пол.ж-за из ацетил_КоА. Синтез. Половыми железами и корой надпочеч. У эмб. под дейст. андрогенов из вольфова протока обр. придаток яичка.семявыносящ. проток и семенной пузырек. Стимул.клет. деление, стим. формир. вторич. пол. призн. Тестостерон и дигидротестостерон
К МУЖСКИМ ПОЛОВЫМ г относят тестостерон,дигидротестостерон.возникают из холестерина.в основе страктурыциклич ядро стерана.андрогены регул дифф тканей в процессе эмбриогенеза ,обеспечивая разв мужского фенотипа,обуслвозникн вторичных половых признаков в пуберантпериоде,стимул сперматогенез во взрорг,обеспеч спец поведенчреакции,оказанаболич эффект усиливая синтетич процессы
5)32. При каком наследственном нарушении происходит повышение уровня мочевой кислоты в крови?Мочевая кислота выводит избыток азота из организма человека. Мочевая кислота синтезируется в печени и в виде соли натрия содержится в плазме крови. За выведение мочевой кислоты из крови человека отвечают почки. При нарушении деятельности почек, происходит нарушение обмена мочевой кислоты. Как следствие — накопление в крови солей натрия, уровень мочевой кислоты растет, вызывая разнообразные повреждения органов и тканей. Норма мочевой кислоты для детей до 14 лет — 0,120 — 0,320 ммоль/л, для взрослых женщин — 0,150 — 0,350 ммоль/л. Для взрослых мужчин норма уровня мочевой кислоты — 0, 210 — 0,420 ммоль/л. Причины повышения мочевой кислоты Повышение мочевой кислоты или гиперурикемия — основной симптом первичной и вторичной подагры. Гиперурикемия может возникать из за нарушения фермента ФРДФ-синтетаза, гипоксантин-гуанинфософорибозилтрансферраза (синлром Леши-Нихена) или аденинфосфорибоилтрансфераза. Первичная подагра развивается на фоне замедления вывода мочевой кислоты из организма или при преизбыточном синтезе мочевой кислоты. Кристаллы мочевой кислоты могут откладываться в суставах, подкожной клетчатке, почках. В результате развивается подагра, хронический артрит
БИЛЕТ №33
1)(179) УГЛЕВОДЫ органические вещества, содержащие карбонильную группу и несколько гидроксильных групп.Источник углеводов – растительная пища. Суточная норма 365-400г углеводов, из них моно- и дисахаридов 50-100 г. Функции: 1)удовлетворяют 60% энергии2)энергообмен мозга осуществляется глюкозой3)компоненты клеточных структур (гликопептиды, гликопротеиды, гликолипиды, липополисахариды).Строение:Углеводы различают как простые сахара (моносахариды (глюкоза, фруктоза, ксилоза, арабиноза), дисахариды (сахароза, мальтоза, лактоза), трисахариды (рафиноза), тетрасахариды (стахиоза)) и сложные. К сложным углеводам относятся полисахариды крахмал, инулин, гликоген, целлюлоза.Углеводы подразделяются на усвояемые в пищевом тракте (глюкоза, фруктоза, галактоза, сахароза, мальтоза, лактоза, раффиноза, инулин, крахмал) и неусвояемые (пищевые волокна – гемицеллюлозы, целлюлоза, пектиновые вещества, камеди, декстраны, фитиновая кислота). Усваиваются лучше всего моно и дисахариды (фруктоза, глюкоза, сахароза, мальтоза и лактоза). Медленнее усваивается крахмал и декстрины (продукты промежуточного гидролиза крахмала). Углеводы в огррасщепл до сахаров.ЖИРЫ- природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот; входят в класс липидов. В среднем суточная потребность в жирах составляет примерно 100 г. Функции:1)участвуют в обеспечении работы сердечной мышцы2) энергетическая3) фосфолипиды – основной компонент клеточных мембран и источник синтеза стероидных гормонов (холестерин)4) запасающая (накопление подкожном слое в клетках – жировые ткани)5)усвоение жирорастворимых витаминов.Основной компонент – триглицериды и липоидные вещества, к которым относятся фосфолипиды, стерины. В организме жир распадается на триглицериды., затем через гидролиз образуются жирные кислоты.Различают животные и растительные жиры.БЕЛКИ- высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. Функции:1)строительная 2)пластическая 3)дыхательная4)ферментативная5)генетическая6)защитная7)энергетическая Строение: состоят из аминокислот (а.к.), их 80. Под влиянием ферментов протеиназ и пептидаз белки расщепляются до свободных а.к. в кишечнике. А.К., которые синтезируются в организме называются заменимыми: глицин, аланин, цистеин.Нехватка незаменимых а.к.(лизин,триптофан) пагубно влияет особенно на растущий организм.Их невозможно компенсировать ни жирами, ни углеводами. Длительное отсутствие белков в пище ведет к гибели организма.
2)(84) Галактоземия - возникает при нарушении обмена галактозы в рез-те недостатка фермента галактоза-1-фосфатуридилтрансферазы. Проявл. у н/р, питающихся материнским молоком. ранние симптомы - рвота, диарея, дегидратация. уменьш. массы тела. В крови, моче и тканях повышается конц-ция галактозы и галактозо-1-фосфата. Накопление галактозо-1-фосфата в печени приводит к токсич. возд. на гепатоциты. возн. гепатомегалия и жировая дистрофия печени. Непереносимость фруктозы. Наруш.работы 2фермента-фруктокиназы клин. не проявляется. Фруктоза накапливается в крови и выделяется с мочой. где ее можно обнаружить лаб. методами.Непереносимость дисахаридов —обусл. наруш. расщепления и всас. дисахаридов; выз-т непереносимость лактозы, сахарозы и/или мальтозы; проявл. расстр. пищевар. в виде хронич. фермент. диспепсии.Недост. лактазыпроявл. неперенос. материнского и коровьего молока, богатого лактозой. При вскарм. молоком у ребёнка появл. кишеч. колики, метеоризм, упорная диарея, разв. гипотрофия. Испраж. водянистые, пенистые, с кислой р-цией. Недост. сахаразы — неперен. сахарозы, клин.проявляется диареей после включения в пищу сахарозы, клин. картина зависит от кол-ва принятого дисахарида. Испр. водянистые, пенистые, с высоким сод-м молоч к-ты и летучих жирных кислот.
3)(136) Стериды (стероиды) - производные циклических спиртов эргостеринов растительного происхождения и зоостеринов животного происхож¬дения. Среди последних наиболее важен холестерин (холестерол), кото¬рый входит в состав тканей как в свободном виде, так и в виде сложных эфиров с жирными кислотами (рис. 2.6). Биологическое значение холе¬стерина в организме весьма велико:1) Он является важнейшим компонентом клеточных мембран, составляя в них до 1/3 всех липидов. При уменьшении доли холестерина нарушает¬ся барьерная функция мембран, резко возрастает их проницаемость, и клетка может погибнуть.2) В ряде желез внутренней секреции из холестерина синтезируются сте¬роидные гормоны: в надпочечниках — кортикостероиды, в половых же¬лезах - андрогены и эстрогены.3)В коже под действием ультрафиолетового излучения из холестерина образуется холекальциферол - витамин D, биорегулятор обмена каль¬ция и фосфора.4) В печени часть холестерина окисляется в желчные кислоты, которые выводятся в кишечник и играют большую роль в переваривании жиров

4)(157)Глицин входит в состав многих белков и биологически активных соединений. Из глицина в живых клетках синтезируются порфирины и пуриновые основания.Химическая формула: NH2 —CH2 —COOH Глицин также является нейромедиаторной аминокислотой, проявляющей двоякое действие. Глициновые рецепторы имеются во многих участках головного мозга и спинного мозга. Связываясь с рецепторами (кодируемые генами GLRA1, GLRA2, GLRA3 и GLRB), глицин вызывает «тормозящее» воздействие на нейроны, уменьшают выделение из нейронов «возбуждающих» аминокислот, таких, как глутаминовая кислота, и повышают выделение ГАМК. Также глицин связывается со специфическими участками NMDA-рецепторов и, таким образом, способствует передаче сигнала от возбуждающихнейротрансмиттеровглутамата и аспартата.[1] В спинном мозге глицин приводит к торможению мотонейронов, что позволяет использовать глицин в неврологической практике для устранения повышенного мышечного тонуса.
5)Креатинфосфокиназа (КФК) — фермент, участвующий в реакциях энергообразования и содержащийся в наибольшем количестве в сердечной и скелетной мускулатуре.Чаще всего анализ активности этого фермента проводят при инфаркте миокарда, так как он очень чувствителен и специфичен. Нормальная активность в сыворотке крови — до 100 нМ/с л или до 6 ME. Повышение активности отмечается при различных повреждениях сердечной и скелетной мускулатуры — инфаркте миокарда, миокардите, аритмии сердца, прогрессирующей мышечной дистрофии, а также при нарушении мозгового кровообращения, интенсивнойнагрузке, приеме алкоголя и некоторых лекарств.
Практически все ферменты имеют молекулярные разновидности — изоферменты. У каждого фермента имеется их определенное количество — от 2-х до 10. Определение изоферментов— достаточно сложный анализ, который проводится не во всех лабораториях, однако онзначительно более информативен, чем общая активность. У КФК имеется 3 изоформы. В норме они имеют соотношение: I(BB) — 0 —следы, II(MB) - 4-6%, III(MM) — 94-96%. Увеличение II (MB) изоформы происходит в течение первых суток после инфаркта миокарда и 100% подтверждает этот диагноз, однако уже через 2-3 суток происходит нормализация активности фермента, и спустя 2-3 дня после развития инфаркта такой анализ уже не назначается. АСТ (АСаТ, аспартатаминотрансфераза) – это фермент, который также содержится в клетках сердца (в миокарде), печени, мышцах, нервных тканях, и в меньшей степени в легких, почках, поджелудочной железе. Повреждения вышеперечисленных органов приводят в повышению уровня АСТ в крови.
БИЛЕТ №34
1)(48) Различия ферментного состава тканей Для каждой ткани-органа характерен определённый ферментный состав(маркерные ферменты). Для сердечной мышцы маркерными ф-ми являются - аспартатаминотрансфераза(АсТ), креатинкиназа; для печени – аланинаминотрансфераза (АлТ); для предст.железы – кислая фосфатаза ( КФ); для поджел.железы – α-амилаза и т.д.При заболеваниях, сопровождающихся некрозом, фер-ты из повреждённых клеток в большом количестве поступают в кровь, и уровень их активности увеличивается, возникает гиперферментемия. Определение уровня активности маркерных фер-в в сыворотке крови имеет клиническое значение в диагностике и прогнозе ряда заболеваний.
В процессе развития ферм.системы синтезируются неодновременно, поэтому с возрастом ферментный состав тканей изменяется. Возрастные изменения особенно выражены в период эмбрионального развития по мере дифференцировки различных тканей с их характерным набором ферментов. На самых ранних стадиях развития эмбриона преобладают те типы Ф. которые транслируются с материнского ген.материала. В печени выявлены 3 основные группы Ф., появляющиеся в позднем внутриутробном периоде, в периоде новорожденности и в конце периода грудного вскармливания. Содержание некоторых Ф. изменяется в онтогенезе более сложным — фазным образом.
Многие ф. харак-ся наличием изоферментов - молекулярных разновидностей ферментов. Каиализируя одну и ту же реакцию, изоферменты определенного фер-та могут различаться по ряду физ-хим свойств(по первичной структуре, субъединичному составу). Множественные формы включают генетически детерминированные изоферменты (НР: Лактатдегидрогеназа) и негенетич.изоферменты, образующиеся в результате хим.модификации исходного фер-та или его частичного протеолиза(НР: изоф-ты пируваткиназы). Различные изоформы одного Ф. м.б. специфичны для разных органов и тканей или субклеточных фракций. Как правило, многие фер-ты присутствуют в разных концентрациях и часто в разных формах, хотя известны и ф-ты, специфичные для определенных органов.
2) (107-8) Пентозофосфатный путь превращения глюкозы можно разделить на 2 этапа: окислит. и не окислит. Субстратом является глюкозо-6-фосфат. В окислительной фазе Г-6-Ф необратимо окисляется в пентозу - рибулозо-5-фосфат, и образуется восстанов. NADPH. В неокисл.фазе Р-6-Ф обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза. ПФПуть обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным коферментом NADPH, кот. используется в восстан.процесах.


3) ( 127) Мех-м биосинтеза жир.к-т в живот.клетках. Метохондриальная с-ма биосинтеза жир.к-т, включающая несколько модифицированную последовательность реакций B-окисления, осуществляет только удлинение существующих в ор-ме среднецепочечных жир.к-т, в то время как полный биосинтез пальмитиновой к-ты ацетил-КоА активно протекает в цитолизе,т.е вне митохондрий, по другому пути - там идет липогенез, или de novo.

По сравнению с β-окислением биосинтез жирных кислот имеет ряд характерных особенностей: синтез жирных кислот в основном осуществляется в цитозоле клетки, а окисление – в митохондриях; участие в процессе биосинтеза жирных кислот малонил-КоА, который образуется путем связывания СО2 (в присутствии биотин-фермента и АТФ) с ацетил-КоА; на всех этапах синтеза жирных кислот принимает участие ацилпереносящий белок (HS-АПБ); при биосинтезе образуется D(–)-изомер 3-гидроксикис-лоты, а не L(+)-изомер, как это имеет место при β-окислении жирных кислот; необходимость для синтеза жирных кислот кофермента НАДФН.
4) (160) Аспарагиновая и Глутаминовая кислоты являются широко распространенными компонентами белков. Эти дикарбоновые аминокислоты играют важную роль в реакции пере-аминирования и передезаминирования, образуясь или превращаясь при этом в оксалилуксусную и соответственно а-кетоглутаровую кислоты; таким образом, устанавливается связь между обменом белков и углеводов. Глутаминовая кислота является составной частью многих соединений пептидного характера, как, например, глутатиона и фолиевой кислоты.Аспарагиновая и глютаминовая кислоты, всегда имеющиеся в тканях в свободном состоянии, улавливают образующийся аммиак путем реакции амидирования; при этом из глютаминовой кислоты при участии АТФ синтезируется глютамин, а из аспарагино-вой кислоты - соответственно аспарагин.


Значение глутатиона в клетке определяется его антиоксидантными свойствами. Фактически глутатион защищает клетку от таких токсичных агентов, как свобод.радикалы.
5) В крови пациента высокий уровень молочной и ПВК.
Молочная кислота и пирувин.к-та - вещества, образующиеся в процессе метаболизма глюкозы в реакциях гликолиза. Являются показателями адекватной доставки кислорода к органам и тканям и позволяют оценить «кислородное голодание» тканей. Повышение уровня молочной кислоты в крови, обусловленное гипоксией, наблюдается при тяжелой физической нагрузке, шоке, кровотечении, сепсисе, инфаркте миокарда, тромбоэмболии легочной артерии, остановке сердца. При отсутствии явных причин нарушения тканевой перфузии причиной повышенного содержания молочной кислоты в крови могут быть такие заболевания, как сахарный диабет, лейкоз и лимфомы, поражение печени, почечная недостаточность, а также недостаточность некоторых ферментов (болезнь Гирке - дефицит глюкозо-6фосфатазы, недостаточность фруктозо-1,6-бисфосфатазы).
БИЛЕТ №35
1)36.

1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S). 2. Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов (E-X) за одну или несколько стадий. 3. Превращение переходного комплекса в комплекс фермент-продукт (E-P). 4. Отделение конечных продуктов от фермента. Специфичность, т.е. высокая избирательность действия ферментов, основана на комплементарности структуры субстрата и активного центра фермента. Бывает стереоспецифичность – катализ только одного из стереоизомеров, Абсолютная специфичность – фермент производит катализ только одного вещества. Например,расщепление мочевины уреазой. Групповая специфичность – катализ субстратов с общими структурными особенностями, т.е. при наличии определенной связи или химической группы Механизмы катализа: 1. Кислотно-основной– в активном центре фермента находятся группы специфичных аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов.Такие группы представляют собой мощные катализаторы многих органических реакций. 2. Ковалентный – ферменты реагируют со своими субстратами, образуя при помощи ковалентных связей очень нестабильные фермент-субстратные комплексы, из которых в ходе внутримолекулярных перестроек образуются продукты реакции.
2)85 100 101 102
ткани Аэробный гликолиз - процесс окисления глюкозы с образованием двух молекул пирувата. Главный путь утилизации глюкозы. При расщ. 1 молекулы глюкозы в тканях синтезируется 38 молекул АТФ.В результате этих процессов глюкоза распадается до CO2 и H2O, а освобождающаяся энергия используется для синтеза АТФ. при распаде 1 моль ацетил-КоА образуется 12 моль АТФ, следовательно, из 2 моль ацетил-КоА - 24 моль АТФ. Суммируя энергетические эффекты всех этапов распада глюкозы в аэробных условиях, получаем 38 моль АТФ.
Е1 - гексокиназа или глюкокиназа
Е2 - глюкозофосфатизомераза
Е3 - фосфофруктокиназа
Е4 - фруктозодифосфатальдолаза
Е5 – триозфосфатизомераза
2этап: Е6 - глицеральдегид-3-фофатдегидрогеназа
Е7 - фосфоглицераткиназа
Е8 - фосфоглицератфосфомутаза
Е9 - енолгидратаза
Е10
- прируваткиназа


3)32
Вит С:Содержится в свежих фруктах и овощих, явл.производным глюкозы. Участвует в окислительно-восстановительных процессах в качетсве кофермента гидроксилаз,так как его молекула способна отдавать 2 водорода,которые могут вновь присоЕд к дегидроаскорбкте.участвует в обр норадреналина. Авитоминоз: цинга.выпад и ломкость зубов,хрупкиекости,ногти,сосуды,нарушениеобразв. Коллагена соедтк все из-за этого.Участ. В синтезе коллагена, деградации тирозина, синтезе катехоламина и желчных кислот. Участвует в иммунных р-циях, играет антиоксидантную роль – сбережение витамина Е например. Сут. потребность 100 мг.

Витамин
а.сущ витамин А1 и А2. Провитамины-каротины,содерж
в оранжево-красных овощях(морковь,томаты,перчик)
и в зеленых частях растений.ВИТАМИНА
самого много в рыбьем жирке,также в
яичном желточке,слив маслице и
печеночке.превращение каротинов в
витамины происходит в стенке кишечника
и в печени под влиянием каротиндиоксигеназы
и ретинальредуктазы.(происхок и восст)
2 цисретиналь входит в состав родопсина
сетчатки.воздействие света вызывает
распад родопсина и конформац изменение
цис на транс.это инициирует гидролиз
цГМФ и появление медиатора .в резте
образ электрический потенциал нервного
импульса. В темноте наоброт синтез
рдопсина. Ретинолпирофосфатпереносчит
галактозы и маннозы ,участв в
ситезегликопротеинов.ретиноеваякта
способ росту костей и
ткани,стимдиффэпителия.авитоминоз:
тормоз роста,поражкожди и слизистых,
пораж глаз(ксерофтальмия,кератомаляция)сутпотр
1-3 мг.
Ретинолпирофосфат

4)166 Незаменимая ам-к. Биологич.активное в-во-серотонин. Физиол.роль -возбуждающий медиатор средних отделов мозга. При недостатке витамина B6 нарушение образования из триптофана никотиновой кислоты может привести к нарушению синтеза пиридиновых нуклеотидов , NAD + и NADP +. Метаболические нарушения катаболизма триптофан а. Болезнь Хартнупа , наследственное нарушение метаболизма триптофана, характеризуется появлением сыпи на коже , как при пеллагре , перемежающейся мозжечковой атаксией и умственной отсталостью.



5)недостаточность витамина б 12 Витамин В12 (или цианокобаламин, кобаламин) — уникальный витамин в организме человека, содержащий незаменимые минеральные элементы. Большое количество витамина B12 необходимо селезенке и почкам, несколько меньше поглощается мышцами. Кроме того, витамин В12 содержится в молоке матери. Характеристика витамина В12: витамин B 12 необходим для образования и созревания эритроцитов витамин B12 влияет на нервную систему, поддерживая ее в здоровом состоянии, снижает раздражительность витамин Б 12 предотвращает появление анемии цианокобаламин участвует в белковом, жировом и углеводном обмене кобаламин участвует в процессе усвоения, транспорта и распада фолиевой кислоты витамин B12 помогает увеличивать энергию витамин Б12 способствует росту и улучшению аппетита витамин B12 помогает улучшить концентрацию, память и равновесие. В организме не происходит синтез витамина Б12, его поступление происходит с продуктами питания — источниками витамина В12. Содержат кобаламин продукты животного происхождения: печень, говядина, рыба, свинина, яйца, молоко, сыр, почки. Благополучному усвоению витамина В12 помешает одновременное употребление кислот, щелочей, воды, алкоголя, эстрогенов, снотворных таблеток. Для благополучного усвоения витамина B12 необходимо достаточное количество кальция, с которым В12 должен вступить во взаимодействие во время принятия пищи для того, чтобы он мог принести пользу для организма. Распад витамина B 12 происходит очень медленно, из организма цианокобаламин выводится желчью. При дефиците В12 в течение около 5—6 лет развивается В12 дефицитная анемия. Норма витамина Б 12: 180 — 900 пг/мл Рекомендуемая суточная доза B12 В12 для взрослых -3 мкг. Дефицит витамина B12 приводит к серьезным, опасным для здоровья последствиям — развивается B 12-дефицитная анемия. Особенно подвержены В12 анемии вегетарианцы и любители диет, исключившие из свого рациона яйца и молочные продукты. При недостатке цианокобаламина происходят изменения в клетках костного мозга, полости рта, языка и желудочно-кишечного тракта, что ведет к нарушению кроветворения, появлению симптомов неврологических расстройств (психические расстройства, полиневриты, поражение спинного мозга). В12-дефицитная анемия (понижение уровня витамина В12) может привести к заболеваниям печени, почек, заболеваниям крови, онкологическим заболеваниям, лейкозам. Дефицит витамина В12 в молоке матери приводит к мегалобластической анемии у ребенка.
БИЛЕТ №36
1)44.тип катализируемой химической реакции в сочетании с названием субстрата (субстратов) служит основой для систематического наименования ферментов. Согласно Международной классификации, ферменты делят на шесть главных классов, в каждом из которых несколько подклассов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы (синтетазы) (табл. 4.5).

Оксидоредуктазы. К классу оксидоредуктаз относят ферменты, катализирующие с участием двух субстратов окислительно-восстановительные реакции, лежащие в основе биологического окисления. Систематические названия их составляют по форме «донор: акцептор оксидоредуктаза». Например, лактат: НАД+ оксидоредуктаза для лактатдегидрогеназы (ЛДГ). Различают следующие основные оксидоредуктазы: аэробные дегидро-геназы или оксидазы, катализирующие перенос протонов (электронов) непосредственно на кислород; анаэробные дегидрогеназы, ускоряющие перенос протонов (электронов) на промежуточный субстрат, но не на кислород; цитохромы, катализирующие перенос только электронов. К этому классу относят также гемсодержащие ферменты каталазу и пероксидазу, катализирующие реакции с участием перекиси водорода. Трансферазы. К классу трансфераз относят ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов. Наименование их составляется по форме «донор: транспортируемая группа – трансфераза». Различают трансферазы, катализирующие перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных Международная классификация ферментов (оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы)) остатков, азотистых групп, остатков фосфорной и серной кислот и др. Например: метил- и формилтрансферазы, ацетилтрансферазы, амино-трансферазы, фосфотрансферазы и др. Гидролазы. В класс гидролаз входит большая группа ферментов, катализирующих расщепление внутримолекулярных связей органических веществ при участии молекулы воды. Наименование их составляют по форме «субстрат-гидролаза». К ним относятся: зстеразы – ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров; гликозидазы, ускоряющие разрыв гликозидных связей; фосфатазы и пептидгидролазы, катализирующие гидролиз фосфоангидридных и пептидных связей; ами-дазы, ускоряющие разрыв амидных связей, отличных от пептидных, и др.
Лиазы. К классу лиаз относят ферменты, катализирующие разрыв связей С—О, С—С, С—N и других, а также обратимые реакции отщепления различных групп от субстратов не гидролитическим путем. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Ферменты обозначают термином «субстрат-лиазы». Например, фумарат-гидратаза (систематическое название «L-малат-гидролаза») катализирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровой кислоты. В эту же группу входят декарбоксилазы (карбокси-лиазы), амидин-лиазы и др. Изомеразы. К классу изомераз относят ферменты, катализирующие взаимопревращения оптических и геометрических изомеров. Систематическое название их составляют с учетом типа реакции: «субстрат – цис-транс-изомераза». Если изомеризация включает внутримолекулярный перенос группы, фермент получает название «мутаза». К этому же классу относят рацемазы и эпимеразы, действующие на амино- и оксикислоты, углеводы и их производные; внутримолекулярные оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз; внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и другие группы, и т.д. Лигазы (синтетазы). К классу лигаз относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ (или другого нуклеозидтрифосфата). Систематическое название их составляют по форме «X : Y лигаза», где X и Y обозначают исходные вещества. В качестве примера можно назвать L-глутамат: аммиак лигазу (рекомендуемое сокращенное название «глутаминсинтета-за»), при участии которой из глутаминовой кислоты и аммиака в присутствии АТФ синтезируется глутамин.Энзимопатии - нарушение функционирования ферментов в кл. Выделяют энзимопатии наследственные (фенилкетонурия(дефект монооксигеназы, подагра-дефект метаболизма пуриновых оснований и наколпление моч.к-ты, галактоземия и др.) и приобретенные (гипераммониемия при заболеваниях печени, при которых ухудшается синтез мочевины и в крови накапливается аммиак; недостаточность ферментов ЖКТ при заболеваниях желудка,поджелудочной железы или желчного пузыря квашиоркор, различные виды витаминной недостаточности).
2)93.94.
Гликолиз– это последовательность ферментативных реакций, приводящих к превращению глюкозы в пируват с одновременным образованием АТФ.При аэробных условиях пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, как это может иметь место в активно сокращающейся мышце, пируват превращается в лактат. Анаэробный гликолиз – сложный ферментативный процесс распада глюкозы, протекающий в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется АТФ. Суммарное уравнение гликолиза можно представить следующим образом:

В анаэробных условиях гликолиз – единственный процесс в животном организме, поставляющий энергию. Именно благодаря гликолизу организм человека и животных определенный период может осуществлять ряд физиологических функций в условиях недостаточности кислорода. В тех случаях, когда гликолиз протекает в присутствии кислорода, говорят об аэробном гликолизе Последовательность реакций анаэробного гликолиза, так же как и их промежуточные продукты, хорошо изучена. Процесс гликолиза катализируется одиннадцатью ферментами, большинство из которых выделено в гомогенном, клисталлическом или высокоочищенном виде и свойства которых достаточно известны. Заметим, что гликолиз протекает в гиало-плазме (цитозоле) клетки.Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой:

Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.Наиболее важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, т.е. последний служит одновременно и продуктом реакции, и аллостерическим ингибитором. Фермент гексокиназа способен катализировать фосфорилирование не только D-глюкозы, но и других гексоз, в частности D-фруктозы, D-маннозы и т.д. В печени, кроме гексокиназы, существует фермент глюкокиназа, который катализирует фосфорилирование только D-глюкозы. В мышечной ткани этот фермент отсутствуетВторой реакцией гликолиза является превращение глюкозо-6-фос-фата под действием фермента глюкозо-6-фосфатизомеразы во фруктозо-6-фосфат:

Эта реакция протекает легко в обоих направлениях, и для нее не требуется каких-либо кофакторов.Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ:

Данная реакция аналогично гексокиназной практически необратима, протекает в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. Фактически эта реакция определяет скорость гликолиза в целом. Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АМФ . При значительных величинах отношения АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза. Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:

Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидро-ксиацетонфосфата и глицеральдегид-3-фосфата).Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой:

Равновесие данной изомеразной реакции сдвинуто в сторону дигид-роксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глице-ральдегид-3-фосфата. В последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы ди-гидроксиацетонфосфат превращается в глицеральдегид-3-фосфат. Образованием глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая стадия – наиболее сложная и важная. Она включает окислительно-восстановительную реакцию (реакция гликолитической оксидоредукции), сопряженную с субстратным фосфорилированием, в процессе которого образуется АТФ. В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАД (НАДН). Эта реакция блокируется йод- или бромацетатом, протекает в несколько этапов

1,3-Бисфосфоглицерат представляет собой высокоэнергетическое соединение (макроэргическая связь условно обозначена знаком «тильда» ~). Механизм действия глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп последнего. Образовавшаяся связь богата энергией, но она непрочная и расщепляется под влиянием неорганического фосфата, при этом образуется 1,3-бисфосфоглицериновая кислота.Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфогли-цериновой кислоты (3-фосфоглицерат):

Т аким
образом, благодаря действию двух
ферментов (глицеральде-гидфосфатдегидрогеназы
и фосфоглицераткиназы) энергия,
высвобождающаяся при окислении
альдегидной группы глицеральдегид-3-фосфата
до карбоксильной группы, запасается в
форме энергии АТФ. В отличие от
окислительного фосфорилирования
образование АТФ из высокоэнергетических
соединений называется субстратным
фосфорилированием. Восьмая реакция
сопровождается внутримолекулярным
переносом оставшейся фосфатной группы,
и 3-фосфоглицериновая кислота превращается
в 2-фосфоглицериновую кислоту
(2-фосфоглицерат).Реакция легкообратима,
протекает в присутствии ионов Mg2+.
Кофактором фермента является также
2,3-бисфосфоглицериновая кислота
аналогично тому, как в фосфоглюкомутазной
реакции роль кофактора выполняет
глюкозо-1,6-бисфосфат:
аким
образом, благодаря действию двух
ферментов (глицеральде-гидфосфатдегидрогеназы
и фосфоглицераткиназы) энергия,
высвобождающаяся при окислении
альдегидной группы глицеральдегид-3-фосфата
до карбоксильной группы, запасается в
форме энергии АТФ. В отличие от
окислительного фосфорилирования
образование АТФ из высокоэнергетических
соединений называется субстратным
фосфорилированием. Восьмая реакция
сопровождается внутримолекулярным
переносом оставшейся фосфатной группы,
и 3-фосфоглицериновая кислота превращается
в 2-фосфоглицериновую кислоту
(2-фосфоглицерат).Реакция легкообратима,
протекает в присутствии ионов Mg2+.
Кофактором фермента является также
2,3-бисфосфоглицериновая кислота
аналогично тому, как в фосфоглюкомутазной
реакции роль кофактора выполняет
глюкозо-1,6-бисфосфат:

Девятая реакция катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится высокоэргической:

Енолаза активируется двухвалентными катионами Mg2+или Мn2+ и ингибируется фторидом.Десятая реакция характеризуется разрывом высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ (субстратное фосфорилирование). Катализируется ферментом пируваткиназой:

Для действия пируваткиназы необходимы ионы Mg2+, а также одновалентные катионы щелочных металлов (К+ или др.). Внутри клетки реакция является практически необратимой.В результате одиннадцатой реакции происходит восстановление пировиноградной кислоты и образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН, образовавшегося в шестой реакции:

Биологическое значение процесса гликолиза заключается прежде всего в образовании богатых энергией фосфорных соединений. На первых стадиях гликолиза затрачиваются 2 молекулы АТФ (гексокиназная и фосфофрук-токиназная реакции). На последующих образуются 4 молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза в анаэробных условиях составляет 2 молекулы АТФ на одну молекулу глюкозы.
3) 131. Химическое строение желчных кислот и их роль в переваривании липидов (см.130)