
- •171. Трансляция - как процесс реализации генетической информации в структурах синтезируемых на рибосомах полипептидныx цепей
- •87 Синтез гликогена и гликогенолиз-распад
- •18. Фосфопиридоксаль и его роль в клеточном метаболизме. Представление о реакциях трансаминирования.
- •2.(Хз какой вопрос такого в вопроснике нет)Зависимость скорости ферментативной реакции от концентрации субстрата.
- •133. Биосинтез кефалина и лецитина и их биологическая роль(см.135)
- •22. Пантотеновая кислота и ее роль в клеточном метаболизме.
- •4) (Хз какой)механизм действия катехоламинов на клетки-мишени
- •2.Метаболические превращения пвк.
- •5.Протеинурия
- •3. Биосинтез гема и его регуляция. Химизм реакций до порфобилиногена, представление о дальнейших путях синтеза гема. Порфирии.
- •4.Пантотеновая кислота и ее роль в клеточном метаболизме.
- •5.В норме глюкоза в моче отсутствует или обнаруживается в минимальных количествах, в общем анализе мочи не выявляющихся. Повышение уровня (глюкозурия):
БИЛЕТ № 1
1)(139) Холестерин как предшественник других стероидов. Биохимические основы развития атеросклероза.

Холестерин(холестерол) – ненасыщенный спирт.Каждая клетка в организме млекопитающих содержит его. Х-н является источнком образования желчных кислот и стероидных гормонов (половых и кортикоидных). Продукт окисления х-на – 7-дигидрохолестерин под влиянием УФ-излуч в коже превращается в витамин Д3.
Сам х-н может синтез-ся из ацетил-КоА.
АТЕРОСКЛЕРОЗ. Поступление холестерола с пищей не должно превышать 300 мг/сут. Атеросклероз возникает при повышении уровень холестерина в крови (>6 ммоль\л ). Кол-во лонп(липопротеиды очень низк плотн) не должно превышать 3,0 ммоль/л и должно составлять не более 75% от общего уровня липопротеидов. А доля липопротеидов высокой плотности должна составлять примерно 25% от общего холестерина и быть > 1,0 -1,2 ммоль/л.
Факторы риска: курение (наиболее опасный фактор),гиперлипопротеинемия (общий холестерин > 5 ммоль/л, ЛПНП > 3 ммоль/л, ЛП(a) > 50 мг/дл),артериальная гипертензия, сахарный диабет, ожирение, малоподвижный образ жизни, эмоциональное перенапряжении, неправильное питание
2)(39) Специфичность действия ферментов. Классификация и номенклатура ферментов. Изоферменты.
Специфичность, т.е. высокая избирательность действия ферментов, основана на комплементарности структуры субстрата и активного центра фермента. Абсолютная специфичность – фермент производит катализ только одного вещества. Например, расщепление мочевины уреазой. Относительная – катализирует превращения групп субстратов, обладающих сходными структурными свойствами. Так действует пепсин, амилаза. Бывает стереоспецифичность – катализ только одного из стереоизомеров, Двойственная – действие на резко отличающиеся субстраты, напр трипсин гидролизует пептидные связи и сложноэфирные. Выделяют 6 классов: оксидоредуктазы, трансферазы,гидролазы, лиазы, изомеразы, лигазы. Номенклатура: класс, подкласс, подподкласс, порядковый номер.
3)(91) Гликолиз, его биол. значение, последоват. реакций гликолиза в анаэробных условиях. КПД.
Это последовательность реакций, приводящ. к превращению глюкозы в пируват, с образованием АТФ. Этапы анаэробного гликолиза: 1).активирование гексозы с образованием фруктозо-1,6-бисфосфата. 2).дихотомич. распад активированной гексозы пополам с образованием двух фосфотриоз. 3).окисление и фосфорилирование фосфотриоз, сопровождающ. перераспределением энергии и образованием макроэргич. связей, с последующим синтезом 2 АТФ путем первого субстратного фосфорилирования. 4) внутримолекулярное окисление фосфоглицерата (енолазная реакция), ведущая к возникновению макроэргических связей и второму субстратному фосфорилированию с синтезом еще 2 АТФ.5) восстановление пирувата в лактат. Общая схема реакции: C6H12O6+2АДФ=2С3Н3О3+ 2 АТФ
4)(28) Биотин и витамин В12.


Биотин: антисеборейный витамин. содерж.в печени, почках и др.;синтез.микрофлорой.
Участвует в переносе Со2 или НСО3(карбоксилировании), или в транскарбоксилировании. Биотин входит в состав пируваткарбоксилазы участвуя в синтезе оксалоацетата. В составе ацетилКоАкарбоксилазы участвует в синтезе жир.к-т. Биотиновая недестаточность: дерматит, поражение ногтей, волос, себорея, наступ из-за избыточного поступления белка сырых яиц авидина, который связывает биотин и предотвращ его всасывание. Биотин содерж. в: дрожжи, печень, яичн. желток, злаки. Сут. потр. 150-250мкг.
Кофермент Биоцетин состоит из биотина и ак лизина.
В12: источники: только животные продукты. +синтез. микрофлорой жкт.Строение:4пиррольных кольца, ион кобальта, группу CN-.Метаболизм: для всасывания витамина необх.внутренний фактор Касла-гликопротеин, синтез. обкладочными клетками желудка. Внешний фактор Кастла – кобаламин. Биохим.ф-ции: участв.в р-циях изомеризации и трансметилирования*ам-к гомоцистеина при синтезе метионина) . Витаминный дефицит или нарушение всасывания витамина В12 связаны главным образом с прекращением секреции внутреннего фактора. Следствием авитаминоза является мегалобластная анемия. Сут. потр. 2-5 мг.
5)Уровень гамма-глутамилтранспептидазы в сыворотке крови пациента оказался
повышенным. Ваш комментарий.
Микросомальный фермент, участвующий в обмене аминокислот. Катализирует перенос гамма-глутамилового остатка с пептида или пептидоподобного вещества, содержащего концевой глутаматный остаток, на аминокислоту, другой пептид, или иную субстратную молекулу. Содержится в почках, печени, поджелудочной. Увеличение значений ГГТ в сыворотке возрастает при всех формах заболеваний печени. Она наиболее высока в случаях обструктивных поражений печени (внутри- или постпеченочной закупорки), достигая повышения в 5-30 раз от
нормальных значений. Умеренное повышение ГГТ наблюдается при инфекционных гепатитах (в 2-5 раз выше
нормы).
БИЛЕТ №2
1)Протеиногенными называются 20 аминокислот, которые кодируются генетическим кодом и включаются в белки в процессе трансляции.

Протеиногенные аминокислоты удобно классифицировать в зависимости от характера их боковых радикалов. Различают 5 классов аминк-т(по полярности радикалов R-групп): 1.Неполярные(гидрофобные): Глицин, Аланин, Валин,Лейцин,Изолейцин,Пролин; 2.Полярные(гидрофильные,незаряженные): Серин, Треонин, Цистеин, Метионин, Аспарагин, Глутамин; 3. Ароматические: Фенилаланин,Тирозин,Триптофан, 4. Отриц.заряженные: Аспарг.к-та, Глутамин.к-та; 5. Полож.заряженные: Лизин, Аргинин, Гистидин.Физико-химические свойства аминокислот. Кислотно-основные свойства аминокислот. По химическим свойствам аминокислоты - амфотерные электролиты, т. е. сочетают свойства и кислот, и оснований.Влияние рН среды на ионизацию аминокислот. Изменение рН среды от кислой до щелочной влияет на заряд растворенных аминокислот. В кислой среде (рН<7) все аминокислоты несут положительный заряд (существуют в виде катиона), так как избыток протонов в среде подавляет диссоциацию карбоксильной группы. В щелочной среде (рН>7), где имеется избыток ионов ОН-, аминокислоты находятся в виде отрицательно заряженных ионов (анионов), так как диссоциирует NН+3-группа.Следовательно, в зависимости от рН среды аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд. Стереоизомерия аминокислот. Все протеиногенные аминокислоты, за исключением глицина, имеют как минимум один асимметрический атом углерода (С*) и обладают оптической активностью, причем большая часть их относится к левовращающим. Они существуют в виде пространственных изомеров, или стереоизомеров. По расположению заместителей вокруг асимметрического атома углерода стерео-изомеры относят к L- или D-ряду.Аминокислоты треонин и изолейцин имеют по два асимметрических атома углерода, поэтому у них по четыре стереоизомера. Первичная структура белков - линейная полипептидная цепь из аминокислот, соединенных между собой пептидными связями. Перв.структура - простейший уровень структурной организации белковой молекулы. Высокую стабильность ей придают ковалентные пептидные связи между α-аминогруппой одной аминокислоты и α-карбоксильной группой другой аминокислоты.Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме, в частности, в организме человека. Поэтому их поступление в организм с пищей необходимо.
Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треони́н, триптофан и фенилалани́н;
Для детей незаменимыми также являются аргинин и гистидин. Азотистый баланс - это соотношение между сут.приходом и сут.расходом белка(азота), для этого кол-во азота умножают на 6,25 (НР с мочой выделилось 12г. азота, сут.расход - 12*6,25=75г.) Возможны 3 варианта баланса: азот.равновесие, отриц.(расход> приход - опухолевый рост), полож.(приход>расход - рост, беременность, наращивание мыш.массы). Квашиоркор - вид тяж.дистрофии на фоне недостатка белков в пищ.рационе. Обычно у детей 1-4лет, развивающихся стран. Причинами м.б. также врожд.нарушения обмена аминок-т, нар-я всасыв-я в кишечнике. Все это приводит к нар-ю развития ребенка, дистрофическим измен-ям органов и тканей. (сама составляла в шпорах неполный 147)
2) Наиболее активно пентозофосфатный путь превращения глюкозы протекает в жир.ткани, печени, коре надпоч-в, молоч.железы в период лактации, эритроцитах. Реакции окислител.пути протекают только в том случае, если восстановл.кофермент NADPH возвращается в исходное окисленное состояние NADP+ при участии NADPH-зависимых дегидрогеназ (т.е. при условии использования гидрированного NADPH в восстанов.процессах). Если потребности клетки в NADPH незначительны, рибозо-5-фосфат образуется в рез-те обратимых реакций неокислит.этапа ПФПути, используя в качестве исзодных в-в метаболиты гликолиза - глицеральдегид-3-фосфат и фруктозо-6-фосфат.(109-110)
3 )
Синтез жирных кислот протекает в
цитозоле из Ацетил-КоА, образовавшегося
в митохондриях при гликолизе. Для
использования ацетилкоэнзима-А в
процессах, протекающих в цитоплазме
клетки, протекает ряд реакций для
переноса Ацетил-КоА через митохондриальную
мембрану. В митохондриях ацетил-КоА
взаимодействует со Щавелевоуксусной
кислотой (ЩУК), образуется лимонная
кислота. В цитоплазме протекает обратный
процесс. Таким образом, в цитоплазме
образуется Ацетил-КоА. Для синтеза
жирных кислот протекает еще ряд
последовательных реакций, образуется
малонил-КоА. Ацетильная и малонильная
группы переносятся на АПБ при участии
ацетил-и малонил-трансацилаз. АПБ —
ацилпереносящий белок. Далее к Ацетил-АПБ
прибавляется Малонил-АПБ с образованием
Ацетоацетил-АПБ. Наступает цакл реакций,
противоположных бета-окислению жирных
кислот, но вместо КоА носителем является
АПБ, а вместо НАД и ФАД в процессах
гидрирования участвует НАДФН2. Бутирил-АПБ
вступает в новый цикл (взаимодействует
с малонил-АПБ), в результате которого
углеродная цепь удлиняется на 2 атома.
Циклы повторяются, пока цепь включит
16 атомов углерода (пальмитиновая
кислота) или большего четного числа.
)
Синтез жирных кислот протекает в
цитозоле из Ацетил-КоА, образовавшегося
в митохондриях при гликолизе. Для
использования ацетилкоэнзима-А в
процессах, протекающих в цитоплазме
клетки, протекает ряд реакций для
переноса Ацетил-КоА через митохондриальную
мембрану. В митохондриях ацетил-КоА
взаимодействует со Щавелевоуксусной
кислотой (ЩУК), образуется лимонная
кислота. В цитоплазме протекает обратный
процесс. Таким образом, в цитоплазме
образуется Ацетил-КоА. Для синтеза
жирных кислот протекает еще ряд
последовательных реакций, образуется
малонил-КоА. Ацетильная и малонильная
группы переносятся на АПБ при участии
ацетил-и малонил-трансацилаз. АПБ —
ацилпереносящий белок. Далее к Ацетил-АПБ
прибавляется Малонил-АПБ с образованием
Ацетоацетил-АПБ. Наступает цакл реакций,
противоположных бета-окислению жирных
кислот, но вместо КоА носителем является
АПБ, а вместо НАД и ФАД в процессах
гидрирования участвует НАДФН2. Бутирил-АПБ
вступает в новый цикл (взаимодействует
с малонил-АПБ), в результате которого
углеродная цепь удлиняется на 2 атома.
Циклы повторяются, пока цепь включит
16 атомов углерода (пальмитиновая
кислота) или большего четного числа.
4) Никотинамидадениндинуклеотидфосфа́т - широко распространенный в природе кофермент некоторых дегидрогеназ - ферментов, катализирующих окислительно-восстанов.реакции в живых клетках. NADP принимает на себя водород и электроны окисляемого соединения и передает их на др.в-ва. НАДФ отличается от НАД содержанием еще одного остатка фосфор.к-ты, присоедененного к гидроксилу одного из остатков D-рибозы, обнаружен вов сех типах клеток. НАДФ - аллостерич.регулят.фермент энерг.обмена, фер-т ц.Кребса, реакций глюконеогенеза.
5) Триглицериды (ТГ) или нейтральные жиры — это производные глицерина и высших жирных кислот. Триглицериды — главный источник энергии для клеток. Триглицериды поступают в наш организм с пищей, синтезируются в жировой ткани, печени и кишечнике. Уровень триглицеридов в крови зависит от возраста человека. Анализ триглицеридов используют в диагностике атеросклероза и многих других заболеваний. Норма – до 2 ммоль\л
Нормы уровня холестерина ЛПВП для мужчин — 0,7—1,73 ммоль/л, для женщин уровень холестерина крови в норме- 0,86—2,28 ммоль/л.
Глюкоза — основной показатель углеводного обмена. Более половины энергии, которую расходует наш организм, образуется за счет окисления глюкозы. Определение глюкозы — обязательный этап в диагностике сахарного диабета.Концентрация глюкозы в крови регулируется гормонами: инсулин является основным гормоном поджелудочной железы. При его недостатке уровень глюкозы в крови повышается, клетки голодают.Норма глюкозы у детей до 14 лет — 3,33 — 5,55 ммоль/л, у взрослых норма глюкозы в крови — 3,89 — 5,83 ммоль/л, с 60 лет уровень глюкозы в норме возрастает до 6,38 ммоль/л.Повышенное содержание глюкозы указывает на гипергликемию (диабет), а повышенное содержание тагов и холестерина указывает на развитие атеросклероза/
БИЛЕТ №3
Глицин
является единственной из всех входящих
в состав белков аминокислот, в молекуле
которой отсутствует асимметричный
атом углерода. Тем не менееметаболически
он связан с
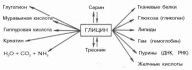 химическимикомпонентами
организма в большей степени, чем любая
другая аминокислота.
химическимикомпонентами
организма в большей степени, чем любая
другая аминокислота.
На
схеме видно, что глицин в некоторых
синтезах играет незаменимую роль, в
частности в образовании белков, пуриновых
нуклеотидов, гема гемоглобина, парных
желчных кислот, креатина, глутатиона
и др. Большинство этих реакций представлено
в соответствующих разделах учебника.
Здесь укажем на реакции, при помощи
которых осуществляются взаимопревращения
глицина, серина и треонина, а также на
реакции катаболизма глицина. Показано,
что в реакции взаимопревращения глицина
и серина участвует тетрагидрофолиевая
кислота; эту реакцию катализирует
пиридоксалевый фермент
серин-оксиметилтрансфераза: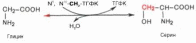
Имеются
также доказательства взаимопревращения
треонина и глицина в треонинальдолазной
реакции: Основным
путем катаболизма глицина в животных
тканях, однако, считается распад его
на СО2, NH3и N5,N10-метилентетрагидрофолиевую
кислоту по уравнению:
Основным
путем катаболизма глицина в животных
тканях, однако, считается распад его
на СО2, NH3и N5,N10-метилентетрагидрофолиевую
кислоту по уравнению:
Механизм
этой реакции, недавно раскрытый К. Тада,
включает участие митохондриальнойглицинрасщепляющей
ферментной системы, отличной от
глицинсинтазы и состоящей из 4 белков:
Р-белка, содержащего пиридоксальфосфат
(глициндекарбоксилаза); Н-белка,
содержащего липое-вую кислоту; Т-белка,
требующего присутствия ТГФК, и L-белка,
названного липамиддегидрогеназой:
Биологический смысл данного пути катаболизма глицина состоит, вероятнее всего, в образовании активного одноуглеродного фрагмента (N5, N10—СН2—ТГФК), используемого в уникальных реакциях синтеза ме-тионина, пуриновых нуклеотидов, тимидиловой кислоты и др. Получены доказательства, что наследственная некетогеннаяглицинемия (повышение уровня глицина в крови) обусловлена недостаточностью Р- или Т-белка глицинрасщепляющей ферментной системы печени или мозга и что каждый из этих белков контролируется отдельным геном.Серин легко превращается в пируват под действием сериндегидратазы. В связи с этим в тканях имеются условия для превращения глицина (через серин) в пируват. Этим путем осуществляется участие глицина в обмене углеводов.
2).)81-83)
Глюкоза
как важнейший метаболит.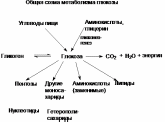
Глюкоза используется как основной вид топлива в тканях млекопитающих. Таким образом, она играет роль связующего между энергетическими и пластическими функциями углеводов
3)(Фосфолипи́ды — сложные липиды, сложные эфиры многоатомных спиртов и высших жирных кислот. Содержат остаток фосфорной кислоты и соединенную с ней добавочную группу атомов различной химической природы. Они есть во всех живых клетках. 1)глицерофосфолипиды— содержат остаток глицерина :фосфатидилхолин (лецитин);фосфатидилэтаноламин (кефалин);фосфатидилсерин 2)фосфосфинголипиды — содержат остаток сфингозина сфингомиелины;3)фосфоинозитиды — содержат остаток инозитола. Центральную роль в биосинтезе фосфолипидов играют 1,2-диглицериды (в синтезе фосфатидилхолинов и фосфатидилэтаноламинов), фосфатидная кислота (в синтезе фосфатидилинозитов) и сфингозин (в синтезе сфин-гомиелинов). Цитидинтрифосфат (ЦТФ) участвует в синтезе практически всех фосфолипидов. Главный липидный компонент клеточных мембран. Они сопутствуют жирам в пище и служат источником фосфорной кислоты, необходимый для жизни человека. Фосфолипиды являются важной частью клеточных мембран. Они обеспечивают текучие и пластические свойства мембран клеток и клеточных органоидов, в то время как холестерин обеспечивает жёсткость и стабильность мембран. Как фосфолипиды, так и холестерин часто входят в состав липопротеидов клеточных мембран, но имеются в мембранах и в свободном, не связанном с белками состоянии. Соотношение холестерин/фосфолипиды в основном и определяет текучесть либо жёсткость клеточной мембраны.Фосфолипиды участвуют в транспорте жиров, жирных кислот и холестерина. Между плазмой и эритроцитами происходит обмен фосфолипидами, которые играют важнейшую роль, поддерживая в растворимом состоянии неполярные липиды. Будучи более гидрофильными, чем холестерин, благодаря наличию в молекуле остатков фосфорной кислоты, фосфолипиды являются своеобразными «растворителями» для холестерина и других высоко гидрофобных соединений. Среди липидов есть также и вторичные посредники — вещества, участвующие в передаче сигнала от гормонов или других биологически активных веществ внутри клетки. В частности фосфатидилинозитол-4,5-бифосфат (ФИ (4,5) Ф2) задействован в сигнализировании при участии G-белков, фосфатидилинозитол-3,4,5-трифосфат инициирует образование супрамолекулярных комплексов сигнальных белков в ответ на действие определённых внеклеточных факторов, сфинголипиды, такие как сфингомиелин и цермаид, могут регулировать активность протеинкиназы.
4)(17)
FAD
— флавинадениндинуклеотид
— кофермент витамина РИБОФЛАВИНА (б2)
принимающий участие во многих
окислительно-восстановительных
биохимических процессах. FAD существует
в двух формах — окисленной и
восстановленной, его биохимическая
функция, как правило, заключается в
переходе между этими формами. Молекула
FADH2 является переносчиком энергии и
восстановленный кофермент может быть
использован как субстрат в реакции
окислительного фосфорилирования в
митохондрии. Молекула FADH2 окисляется
в FAD, при этом выделяется энергия,
эквивалентная (запасаемая в форме) двум
молям ATФ.Основной источник восстановленного
FAD у эукариот — цикл Кребса и бета-окисление
липидов. В цикле Кребса FAD является
простетической группой фермента
сукцинатдегидрогеназы, которая окисляет
сукцинат до фумарата, в бета-окислении
липидов FAD является коферментом
Ac-CoAдегидрогеназы.FAD образуется из
рибофлавина, многие оксидоредуктазы,
называемые флавопротеинами, для своей
работы используют FAD как простетическую
группу в реакциях переноса электронов.
5)Креатинфосфокиназа (КФК) — фермент, участвующий в реакциях энергообразования и содержащийся в наибольшем количестве в сердечной и скелетной мускулатуре. Чаще всего анализ активности этого фермента проводят при инфаркте миокарда, так как он очень чувствителен и специфичен. Нормальная активность в сыворотке крови — до 100 нМ/с л или до 6 ME. Повышение активности отмечается при различных повреждениях сердечной и скелетной мускулатуры — инфаркте миокарда, миокардите, аритмии сердца, прогрессирующей мышечной дистрофии, а также при нарушении мозгового кровообращения, интенсивной нагрузке, приеме алкоголя и некоторых лекарств. Практически все ферменты имеют молекулярные разновидности — изоферменты. У каждого фермента имеется их определенное количество — от 2-х до 10. Определение изоферментов— достаточно сложный анализ, который проводится не во всех лабораториях, однако он значительно более информативен, чем общая активность. У КФК имеется 3 изоформы. В норме они имеют соотношение: I(BB) — 0 —следы,II(MB) - 4-6%, III(MM) — 94-96%. Увеличение II (MB) изоформы происходит в течение первых суток после инфаркта миокарда и 100% подтверждает этот диагноз, однако уже через 2-3 суток происходит нормализация активности фермента, и спустя 2-3 дня после развития инфаркта такой анализ уже не назначается.
БИЛЕТ №4
171. Трансляция - как процесс реализации генетической информации в структурах синтезируемых на рибосомах полипептидныx цепей
Это биосинтез белка на матрице мРНК. Синтез начитнается после переноса инфо и ДНК на мРНК, которая несет инфо об одной полипептидной цепи. Есть 3 основных стадии трансляции: инициация, элонгация, терминация. Во время начальной стадии биосинтеза белков, инициации, обычно метиониновый кодон узнаётся малой субъединицей рибосомы, к которой при помощи белковых факторов инициации присоединена метиониновая транспортная РНК (тРНК). После узнавания стартового кодона к малой субъединице присоединяется большая субъединица и начинается вторая стадия трансляции — элонгация. При каждом движении рибосомы от 5' к 3' концу мРНК считывается один кодон путём образования водородных связей между тремя нуклеотидами (кодоном) мРНК и комплементарным ему антикодоном транспортной РНК, к которой присоединена соответствующая аминокислота. Синтез пептидной связи катализируется рибосомальной РНК (рРНК), образующей пептидилтрансферазный центр рибосомы. Рибосомальная РНК катализирует образование пептидной связи между последней аминокислотой растущего пептида и аминокислотой, присоединённой к тРНК, позиционируя атомы азота и углерода в положении, благоприятном для прохождения реакции. Ферменты аминоацил-тРНК-синтетазы присоединяют аминокислоты к их тРНК. Третья и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковые факторы терминации гидролизуют последнюю тРНК от белка, прекращая его синтез. Таким образом, в рибосомах белки всегда синтезируются от N- к C-концу.
87 Синтез гликогена и гликогенолиз-распад
При полимеризации глюкозы сниж. растворимость образующейся молек. гликогена и её влияние на осмот. давление в кл. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза. Распад гликогена печени служит в основном для поддерж. уровня глюкозы в крови в постабсорбтивном периоде. Гликоген м-ц служит резервом глюкозы - источника энергии при мыш. сокращ. Мыш. гликоген не исп. для поддерж. уровня глюкозы в крови.
Синтез.
Глюкоза, поступ. в кл., фосфорилируется при участии АТФ. Затем глюкозо-6-фосфат превращ. в глюкозо-1-фосфат под действием фермента фосфоглюкомутазы. Чтобы синтез гликогена был термодинамически необратимым, необходима дополнительная стадия образования уридинди-фосфатглюкозы из УТФ и глюкозо-1-фосфата. Фермент, катализирующий эту реакцию, - УДФ-глюкопирофосфорилаза. Образованная УДФ-глюкоза далее используется как донор остатка глюкозы при синтезе гликогена. Эту реакцию катализирует фермент гликогенсинтаза (глюкозилтрансфераза). Так как гликоген в клетке никогда не расщеп. полностью, синтез гликогена осущ. путём удлинения уже имеющейся молекулы полисах. К "затравке" последовательно присоед. молекулы глюкозы. Разветвлённая структура гликогена образуется при участии амило-1,4 →1,6-глюкозилтрансферазы.
.

125. β-окисление жирных кислот с четным и нечетным числом углеродных атомов. Энергетический выход окисления жирных кислот.
Специф. путь катаболизма жир. к-т, при к-м от карбоксильного конца жир. к-ты последовательно отделяется по 2 атома углерода в виде ацетил-КоА. Метаболический путь - β-окисление - назван так потому, что реакции окисления жирной кислоты происх. у β-углеродного атома. Реакции β-окисления и последующего окисления ацетил-КоА в ЦТК служат одним из осн. источ. энергии для синтеза АТФ по механизму ок. фосфорилирования. β-Окисление жир. к-т происходит только в аэр. усл.
Перед тем, как вступить в различные реакции, жирные кислоты должны быть активированы - связаны макроэрг. св. с коферментом А:
RCOOH + HSKoA + АТФ → RCO ~ КоА + АМФ + PPi.
Р -цию
катализ. ацил-КоА-синтетаза. Выд. в ходе
р-ции пирофосфат гидролизуется
пирофосфатазой. Ок-е происх. в матриксе
митох., поэтому после активации жир.
к-ты должны транспортироваться внутрь
митох. Жир. к-оты с длинной углеводородной
цепью переносятся через внутр. мембрану
митох. с пом. карнитина. Ацил-КоА в митох.
подвергается ферментативному
дегидрированию, при этом ацил-КоА теряет
2 атома водорода в α- и β-полож., превращаясь
в еноил-КоА., при участии еноил-КоА-гидратазы
присоед. молекулу воды, обр-ся
β-оксиацил-КоА. β-оксиацил-КоА
(3-гидроксиацил-КоА) затем дегидрируется.
под дейст. НАД+-зависимых ДГ. Расщеп.
3-оксоацил-КоА с пом. тиоловой гр. второй
молекулы КоА, в рез-те обр. укороч. на
два углеродных атома ацил-КоА и
двууглеродный фрагмент в виде ацетил-КоА.
Данная р-ция катал. ацетил-КоА-ацилтрансферазой.
Обр-ся ацетил-КоА подвергается окислению
в ЦТК, а ацил-КоА, укоротившийся на 2
углеродных атома, снова многократно
проходит весь путь β-окисления вплоть
до обр. бутирил-КоА (4-углеродное
соединение), к-ый в свою очередь ок-ся
до 2 молекул ацетил-КоА .
-цию
катализ. ацил-КоА-синтетаза. Выд. в ходе
р-ции пирофосфат гидролизуется
пирофосфатазой. Ок-е происх. в матриксе
митох., поэтому после активации жир.
к-ты должны транспортироваться внутрь
митох. Жир. к-оты с длинной углеводородной
цепью переносятся через внутр. мембрану
митох. с пом. карнитина. Ацил-КоА в митох.
подвергается ферментативному
дегидрированию, при этом ацил-КоА теряет
2 атома водорода в α- и β-полож., превращаясь
в еноил-КоА., при участии еноил-КоА-гидратазы
присоед. молекулу воды, обр-ся
β-оксиацил-КоА. β-оксиацил-КоА
(3-гидроксиацил-КоА) затем дегидрируется.
под дейст. НАД+-зависимых ДГ. Расщеп.
3-оксоацил-КоА с пом. тиоловой гр. второй
молекулы КоА, в рез-те обр. укороч. на
два углеродных атома ацил-КоА и
двууглеродный фрагмент в виде ацетил-КоА.
Данная р-ция катал. ацетил-КоА-ацилтрансферазой.
Обр-ся ацетил-КоА подвергается окислению
в ЦТК, а ацил-КоА, укоротившийся на 2
углеродных атома, снова многократно
проходит весь путь β-окисления вплоть
до обр. бутирил-КоА (4-углеродное
соединение), к-ый в свою очередь ок-ся
до 2 молекул ацетил-КоА .
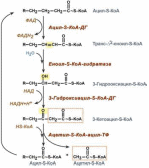
Энергетический выход. При каждом цикле β-окисления обр. 1 молек. ФАДН2 и одна молекула НАДН, к-е в процессе окисления в дых. цепи и сопряженного с ним фосфорилир. дают: ФАДН2 – 2 молекулы АТФ и НАДН – 3 молекулы АТФ. При ок. пальмитиновой к-ты образуется 5 х 7 = 35 молекул АТФ. В пр-се β-ок. пальмитата образуется 8 молекул ацетил-КоА, каждая из которых, «сгорая» в цикле трикарбоновых кислот, дает 12 молекул АТФ, а 8 молекул ацетил-КоА дадут 12 х 8 = 96 молекул АТФ.
Окисление ненасыщ. жир. к-т.
Двойные связи природных ненасыщенных жирных кислот (олеиновой, линолевой и т.д.) имеют цис-конфигурацию, а в КоА-эфирах ненасыщенных кислот, являющихся промежуточными продуктами при β-окислении насыщенных жирных кислот, двойные связи имеют трансконфигурацию. Кроме того, последовательное удаление двууглеродных фрагментов при окислении ненасыщенных жирных кислот до первой двойной связи дает Δ3,4-ацил-КоА, а не Δ2,3-ацил-КоА, который является промежуточным продуктом при β-окислении ненасыщенных жир. к-т. В тк. сущ. фермент, который осущ. перемещ. двойной связи из положения 3–4 в положение 2–3, а также изменяет конфигурацию двойной связи из цис- в транс-положение. Этот фермент получил название Δ3,4-цис –> Δ2,3-транс-еноил-КоА-изомеразы.
Окисление жир. к-т с нечетным числом атомов.
Жирные к-ты с нечетным числом углеродных атомов окисляются таким же образом, как и жир. к-ты с четным числом углеродных атомов, с той лишь разницей, что на последнем этапе расщепления (β-окисления) образуется одна молекула пропионил-КоА и одна молекула ацетил-КоА, а не 2 молекулы ацетил-КоА.

