
- •Билет 1
- •Билет 6
- •Билет 7
- •Билет 9
- •Билет 12
- •Билет 16
- •Билет 18
- •Билет 19
- •Для реакции разложения этана получены следующие значения констант скоростей:
- •Билет 22
- •Билет 23
- •Щелочное омыление этилового эфира уксусной кислоты характеризуется следующими значениями константы скорости реакции при различных температурах:
- •Билет 24
- •Билет 26
- •Билет 28
- •Билет 29
Билет 9
Разложение пероксида водорода на простые вещества протекает как реакция первого порядка. Определите % Н2О2, оставшийся в системе через 1 час после начала реакции, если 1/2 = 584 мин.
Реакция второго порядка протекает за 10 минут на 25%, если начальные концентрации А и В одинаковы и равны 0,01 моль/л. Определите концентрацию вещества В через 25 минут, если для реакции были взяты равные объемы 0,01 М раствора А и 0,1 М раствора В.
Зависимость константы скорости (с-1) газовой реакции от температуры описывается уравнением k = 5,41011е-29300/(RT). За какое время при 423 К парциальное давление исходного вещества достигнет 300 мм рт.ст., если начальное давление газа в системе составляло 1 атм.
По данным зависимости константы скорости реакции от температуры рассчитайте температурный коэффициент и найдите предэкспоненциальный множитель
Температура, К |
823 |
853 |
873 |
903 |
k10-5, c-1 |
2,5 |
12,3 |
35,3 |
114,5 |
В течение часа подвергается распаду 1/6 часть некоторого радиоактивного элемента. Определите период полупревра-щения данного элемента.
Физическая химия Кинетика
Билет 10
Константа скорости реакции равна 24 мин-1л/моль. Определите время, в течение которого израсходуется 90% компонента А, если в начальный момент времени 500 мл раствора содержали 0,1 моль А и 1 моль В.
Определите порядок реакции
НСООС2Н5 + NaOH = HCOONa + C2H5OH
если начальные концентрации эфира и щелочи одинаковы и равны 0,01 моль/л. Концентрация спирта в различные моменты времени приведена в таблице.
Время, мин |
4 |
5 |
6 |
Концентрация C2H5OH, моль/л |
3,1710-3 |
3,6610-3 |
4,4010-3 |
Константа скорости некоторой реакции при 200С равна 0,03, а при 500С - 0,4 усл.ед. Вычислите энергию активации и константу скорости реакции при 300С.
Для реакции C2H5Cl + OH- = C2H5OH + Cl- зависимость константы скорости реакции от температуры представлена уравнением k = 0,7931010Т1/2е-23000/(RT). Определите температурный коэффициент в интервале температур от 0 до 1000С.
В сосуде имеется 0,025 г радона. Период полупревраще-ния радона 3,82 лет. Какое количество радона (в %мас.) останется в сосуде через 5 лет?
Физическая химия Кинетика
Билет 11
Период полураспада изотопа радия равен 19,7 минуты. Какое количество радия ( грамм) останется через 2,5 часа, если исходная масса радия составляла 5 грамм?
Фенилдиазохлорид разлагается по уравнению
С6Н5N2Cl = С6Н5Cl + N2.
При 323 К и начальной концентрации 10 г/л были получены следующие данные
Время, мин |
6 |
12 |
22 |
30 |
|
Объем N2, см3 |
19,3 |
32,6 |
45,0 |
50,4 |
68,3 |
Определить порядок реакции и константу скорости реакции.
Для реакции инверсии тростникового сахара получены следующие значения констант скоростей:
Температура, С |
25 |
40 |
50 |
55 |
k103, с-1 |
9,67 |
73,4 |
268 |
491 |
Определите графически энергию активации реакции и вычислите температурный коэффициент скорости реакции в интервале температур 40-55 С.
Константа скорости реакции второго порядка при 328 и 298К соответственно равна 0,01 и 0,001 мин-1лмоль-1. Вычислите по уравнению Аррениуса, при какой температуре константа скорости реакции будет равна 1 мин-1лмоль-1.
Определить время, в течение которого прореагирует 50 % муравьиного альдегида, если смешать 1 л 1 М Н2О2 с 1 л 0,5 М раствора муравьиного альдегида, если k = 0,7544
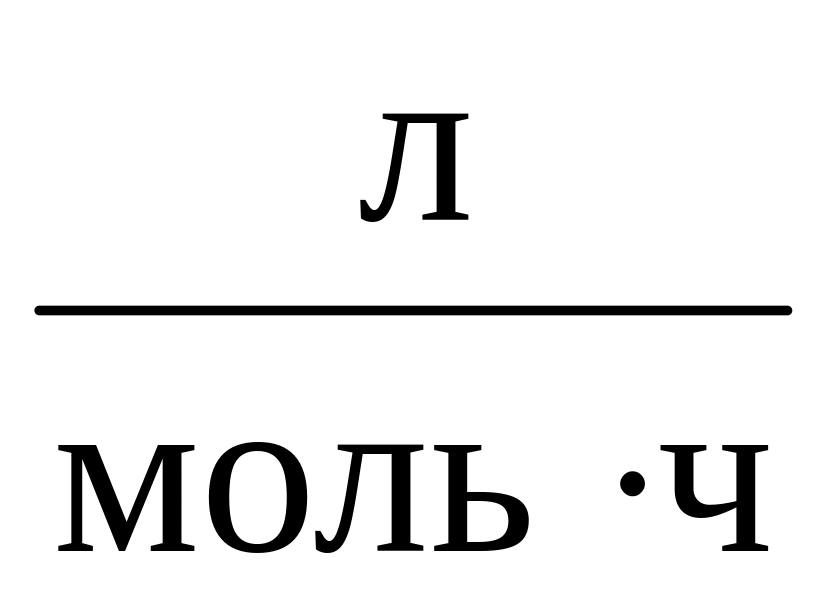 .
.
Физическая химия Кинетика
