
- •7. Бренстед Лоури теориясы тұрғысынан тұздар ерітінділеріндегі протолиттік тепе теңдіктер. Орта тұздар ерітінділерінің рН-ын есептеу формулалары.
- •2. Ерітіндінің иондық күшінің әсері.
- •3.Потенциалға ерітіндінің рН әсері.
- •10. Протолиттік тепе теңдіктер. Күшті және әлсіз қышқылдар мен негіздердің рНтары, Ка және Кв константалардың өзара байланыстарын көрсететін өрнек.
- •11. Вольтамперметрлік талдау әдісі. Полярография әдісін сапалық және сандық талдауда қолдану. Шекті диффузиялық ток пен жартылай толқын потенциалы нені анықтауда қолданылады?
- •18. Эквиваленттік нүкте және титрлеудің соңғы нүктесі. Қышқылды негіздік титрлеудің индикаторлық қателер түрлері, есептеулері.
- •20. Кристалды және аморфтық тұнбалар, оларды алу жағдайлары. Түнбалардың ластану түрлерін атаңыз. Кристалдық және аморфты тұнбалар түзілу жағдайлары.
- •Панет-Фаянс-Ган заңы.
- •21. Комплексонометрлік титрлеу әдісінің мәні. Комплексондар, олардың ерекшеліктері, эквиваленттері, сутек иондарының әсері. Мысал келтіріп жазыңыз.
- •22. Қышқыл негіздік титрлеу индикаторлары, индикаторлық көрсеткіші, индикаторлардың түсі ауысу аралығын анықтау.
- •23. Потенциометрлік титрлеу әдісінде эквивалентті нүктені әртүрлі графикалық тәсілдермен анықтау.
- •24. Амперметрлік титрлеу әдісін талдауда қолдану.
- •25. Амперметрлік титрлеу қисықтарының түрлері. Анықтауларға мысалдар келтіріп жазыңыз.
- •29. Титриметрлік анықтаулар түрлері: тура, кері және орын басу.
- •Химиялық анализдің қателері. Қателер классификациясы
18. Эквиваленттік нүкте және титрлеудің соңғы нүктесі. Қышқылды негіздік титрлеудің индикаторлық қателер түрлері, есептеулері.
Титриметриялық
анализдің дәлдігі ерітінділердің
көлемін өлшейтін ыыдстың дәлдігімен
шектеледі. Лабораториядағы өлшемдік
ыдыстарды пайдаланып көлемдерді
өлшегенде жіберілетін абсолютті қате
±(0,01-0,02) мл. Тек көлемді өлшеуге сәйкес
салыстырмалы қате (СҚ): СҚ=± V\V*100
V\V*100 (0,1-0,2)
(0,1-0,2) Шындығында эквивалентті нүктені
анықтағанда жіберілетін қатені еске
алсақ титриметриялы қанализдің дәлдігі
Шындығында эквивалентті нүктені
анықтағанда жіберілетін қатені еске
алсақ титриметриялы қанализдің дәлдігі
 0,5
болады. Индикаторлы қате эквивалентті
нүкте мен титрлеуді ңсоңғы нүкиесінің
сәйкес келмеуіне байланысты, яғни
эквивалентті нүктедегі ерітіндінің рН
мен пайдаланатын индикатордың титрлеу
көрсеткішіне (рТ) сәйкес рН арасында
айырмашылық болғаны. Сондықтан титрлеудің
соңғы нүктесінде ерітіндіде не анықтайтын
компоненттің, не титранттың артық
мөлшері жүреді. Мысалы, НСl ерітіндісін
NaOH ерітіндісімен титрлегенде pHэ.н.=7
болғанымен, индикатор ретінде метилді
қызылды (рТ=5,5) немесе фенолфталеинді
(рТ=9,0) пайдалануға болады. рТ мен (рНэ.н.)
арасындағы айырмашылықтан туатын қатені
индикаторлы
қате
д.а. Инд . қатені есептегенде олардың
таңбасын көрсету қажет. Индикатордың
мәніне байланысты
0,5
болады. Индикаторлы қате эквивалентті
нүкте мен титрлеуді ңсоңғы нүкиесінің
сәйкес келмеуіне байланысты, яғни
эквивалентті нүктедегі ерітіндінің рН
мен пайдаланатын индикатордың титрлеу
көрсеткішіне (рТ) сәйкес рН арасында
айырмашылық болғаны. Сондықтан титрлеудің
соңғы нүктесінде ерітіндіде не анықтайтын
компоненттің, не титранттың артық
мөлшері жүреді. Мысалы, НСl ерітіндісін
NaOH ерітіндісімен титрлегенде pHэ.н.=7
болғанымен, индикатор ретінде метилді
қызылды (рТ=5,5) немесе фенолфталеинді
(рТ=9,0) пайдалануға болады. рТ мен (рНэ.н.)
арасындағы айырмашылықтан туатын қатені
индикаторлы
қате
д.а. Инд . қатені есептегенде олардың
таңбасын көрсету қажет. Индикатордың
мәніне байланысты
Күшті қышқылды күшті сілтімен титрлегенде немесе керісінше болған жағдайда
рТ< 7 болса, сутектік немесе Н+ - қателік;
рТ >7 болса, гидроксидтік немесе ОН- - қателік орын алады.
Әлсіз қышқылды күшті сілтімен титрлеу барысында қышқыл толық бейтараптанбай тұрып, индикатор түсін өзгерткендіктен қышқылдық қателік орын алады.
Әлсіз негізді күшті қышқылмен титрлеу барысында, әлсіз негіз бейтараптанбай тұрып индикатор түсін өзгерткендіктен, сілтілік қателік орын алады.
Сутектік қателік
Индикатордың титрлеу көрсеткіші рТ, ал кушті қышқылдың нормальді концентрациясы –С1, көлемі – V1 болсын. Титрлеу соңында ерітіндінің көлемі V2 болсын. Титрлеуге алынған сутек иондарының бастапқы эквивалентінің мөлшері n(H+) = C1(H+).V1/1000 Индикатор түсін өзгертетін жағдайға сәйкес келетін сутек иондарының концентрациясы
[H+] = 10-pT.
Титрлеуді аяқтағанда V2 сутек иондарының эквивалентінің мөлшері
n2 = C2(H+).V2/1000 = 10-pT .V2/1000
Титрлеуге дейінгі сутек ионының мөлшері – 100%ал рТ мәніне сәйкес келетін Н+ мөлшері – х % деп сутектік қателік үшін төмендегідей теңдік аламыз:
ΔН+ = 10-pT. V2.100% /C1.V1
Гидроксидтік қателік Күшті сілтіні күшті қышқылмен титрлеу барысында, индикатордың рТ мәнінде, жүйеде сілтінің толық бейтараптанбаунан гидроксидтік қателік туындайды. Титрлеу барысында индикатор түсі рТ мәнінде өзгереді. Осы жағдайға сәйкес келетін гидроксидтік көрсеткіш рОН мәнімен [OH-] тең
pOH = 14 – pT
[OH-] = 10-(14-pT)
Ал гидроксидтік қателік төмендегіше есептелінеді:
ΔOH- = 10-(14-pT).V2.100/C1.V1
Қышқылдық
қате
 Бұл
жағдайда
Бұл
жағдайда
 қатынасы
әлсіз қышқылдың мөлшерін көрсетеді,
себебі титрленген қышқыл ерітіндіде
А-
анионы түрінде жүреді. Егер қышқылдың
протолиздену константасын еске алсақ:
қатынасы
әлсіз қышқылдың мөлшерін көрсетеді,
себебі титрленген қышқыл ерітіндіде
А-
анионы түрінде жүреді. Егер қышқылдың
протолиздену константасын еске алсақ:
 ;
;
 ;
;
 ;
;
 ;
;


Мысалы,
0,1 М
 ерітіндісін
0,1М NaOH ерітіндісімен метилді қызыл
(рТ=5) индикаторы қатысында титрлесе
қышқылдық қате
ерітіндісін
0,1М NaOH ерітіндісімен метилді қызыл
(рТ=5) индикаторы қатысында титрлесе
қышқылдық қате
 өте
үлкен мән. Егер индикатор ретінде
фенолфталеинді (рТ=9) пайдаланса,
өте
үлкен мән. Егер индикатор ретінде
фенолфталеинді (рТ=9) пайдаланса,
 .
Теңдігін пайдаланып титрлеуге қажетті
инликаторды таңдап алуға болады, ол
үшін қышқылдық қате өлшеу қатесінен
(0,1 %) аспайтындай болу керек, яғни:
.
Теңдігін пайдаланып титрлеуге қажетті
инликаторды таңдап алуға болады, ол
үшін қышқылдық қате өлшеу қатесінен
(0,1 %) аспайтындай болу керек, яғни:

 ,
не
,
не
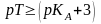
Әлсіз
қышқылды титрлегенде индикатор ретінде
титрлеу көрсеткіші (рТ) қышқылдық
көрсеткіштен ( )
ең кем дегенде үш бірлікке артық
индикаторды алу керек. Қышқылдық қате
сияқты негіздік
қатені
былай есептеуге болады:
)
ең кем дегенде үш бірлікке артық
индикаторды алу керек. Қышқылдық қате
сияқты негіздік
қатені
былай есептеуге болады:
 пайдаланатын индикатордың титрлеу
көрсеткіші
пайдаланатын индикатордың титрлеу
көрсеткіші
 болу
керек.
болу
керек.
19. Гравиметрлік талдау әдісінің мәні және оны қолдану шектері. Гравиметрияда қатты фаза түзілуінің механизмін жазып көрсетіңіз. Гравиметрлік әдіс дегеніміз анықталынатын заттың құрамы тұрақты қатты фаза күйінде бөліп, массасын дәл өлшеуге негізделген сандық анализдің бір түрі. Гравиметрлік талдаудың аналитикалық сигналы – масса. Химиялық анализдердің ішінде гравиметрлік әдіс ең дәл тәсілдердің біріне жатады: оның дұрыстығы – 0,1-0,2%, ал анықтау шегі 0,1%. Гравиметрлік әдісте алмасу, орын басу, ыдырау, комплекс түзу реакциялары пайдаланады және бұл әдіс келесі химия заңдарына негізделеді: құрам тұрақтылық заңына; химиялық эквивалент заңына; масса сақталу заңына.Гравиметрлік анықтаудың дәлдігі жоғары болу үшін ірі кристалдық, ерігіштігі төмен, өзі таза, жақсы сүзілетін тұнба алынуы қажет.Тұнбаның қасиеті көбінесе тұнбаның пайда болу механизмінің екі сатысымен анықталады. Ол: 1. кристалдану орталықтар пайда болуы. 2. пайда болған орталықтардың өсуі.Жаңадан пайда болған бөлшектердің мөлшері осы екі сатының қайсысы басым болатына байланысты. Егер тұну бірінші жолмен жүрсе, тұнба өте ұсақ бөлшектерден тұрады; егер екінші жол басым болса – ірі кристалды тұнба алынады. Сапалық түрде қандай тұнба түзілетіні көрсететін Веймарн ұсынған салыстырмалы асақанығу деген ұғым (СА)пайдаланылады.

Бұл ереже бойынша тұнба түзілу барысында тұнба бөлшектерінің шамасы мен салыстырмалы аса қанығу арасында кері пропорционалдық байқалады:
СА – салыстырмалы аса қанығу;
S – тепе-теңдік күйдегі тұнбаның ерігіштігі, моль/л
G – тұнба түзетін ерітінділерді бір-біріне қосқанда ерітінділердің бастапқы мольдік концентрациясы.
Кристалдану орталықтарының түзілу жылдамдығы мен I-ші және II-ші механизмдердідің жылдамдықтары мен салыстырмалы аса қанығудың арасындағы тәуелділік экспоненциалдық заңдылыққа бағынады. Ал кристалдық орталықтарының өсу жылдамдығы мен аса қанығудың арасындағы тәуелділік тура сызықты.Кристалдық тұнбаларды алу үшін тұндыруды жоғары температурада (S↑), сұйытылған ерітіндіден (G↓) жүргізеді. Және тұндырғышты тамшылатып, араластыра отырып қосады (G↓). Керісінше жағдайда амарфты тұнба түзіледі.
