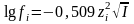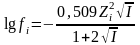- •7. Бренстед Лоури теориясы тұрғысынан тұздар ерітінділеріндегі протолиттік тепе теңдіктер. Орта тұздар ерітінділерінің рН-ын есептеу формулалары.
- •2. Ерітіндінің иондық күшінің әсері.
- •3.Потенциалға ерітіндінің рН әсері.
- •10. Протолиттік тепе теңдіктер. Күшті және әлсіз қышқылдар мен негіздердің рНтары, Ка және Кв константалардың өзара байланыстарын көрсететін өрнек.
- •11. Вольтамперметрлік талдау әдісі. Полярография әдісін сапалық және сандық талдауда қолдану. Шекті диффузиялық ток пен жартылай толқын потенциалы нені анықтауда қолданылады?
- •18. Эквиваленттік нүкте және титрлеудің соңғы нүктесі. Қышқылды негіздік титрлеудің индикаторлық қателер түрлері, есептеулері.
- •20. Кристалды және аморфтық тұнбалар, оларды алу жағдайлары. Түнбалардың ластану түрлерін атаңыз. Кристалдық және аморфты тұнбалар түзілу жағдайлары.
- •Панет-Фаянс-Ган заңы.
- •21. Комплексонометрлік титрлеу әдісінің мәні. Комплексондар, олардың ерекшеліктері, эквиваленттері, сутек иондарының әсері. Мысал келтіріп жазыңыз.
- •22. Қышқыл негіздік титрлеу индикаторлары, индикаторлық көрсеткіші, индикаторлардың түсі ауысу аралығын анықтау.
- •23. Потенциометрлік титрлеу әдісінде эквивалентті нүктені әртүрлі графикалық тәсілдермен анықтау.
- •24. Амперметрлік титрлеу әдісін талдауда қолдану.
- •25. Амперметрлік титрлеу қисықтарының түрлері. Анықтауларға мысалдар келтіріп жазыңыз.
- •29. Титриметрлік анықтаулар түрлері: тура, кері және орын басу.
- •Химиялық анализдің қателері. Қателер классификациясы
1. Реалды жәәне идеалды ерітінділердің айырмашылығы. Активтік концентрация, активтілік коэффициент, Дебай Гюккель заңы.
Vt=kt
[A]*[B] және vt=kt
заттардың
кез келген конц. сәйкес деп есептелінеді.
Бірақ тәжірибеде бұл теңдіктер
реакцияласатын заттардың өте төменгі
конц. ғана әділетті, ал заттың жоғарғы
конц. толық сақталмайды. Реагенттердің
конц өскен сайын жүйенің теңдіктерінен
ауытқуы артады. Реагенттердің конц
өзгеруімен тепе теңдік конц мәні де
өзгере бастайды, демек тепе теңдік конст
тұрақтылығы сақталмайды. Массалар
әрекеттесу заңына толық бағынатын
жүйелерді идеалды
жүйелер
деп атайды. Бұл реагенттердің конц өте
төмен жүйелер, ал ерітінділерде шексіз
сұйытылған ерітінділер. Реалды
ерітінділерде иондардың алғашқы конц
осы иондардың шын химиялық активтігіне
сәйкес келмейді. Айырмашылығы: реалды
жүйелерде әрекеттесетін бөлшектерге
иондар мен молекулалардың әсер етуіне
байланысты реакцияласатын заттардың
конц.нан олардың шындық химиялық
активтігі төмен болады. Айырмашылығының
тағы бір себебі: электростатикалық ион
ион, диполь диполь, ион диполь рекеттесулері.
Иондардың эффектілі конц ескеру үшін
активтік
конц
α=f*c; f
активтік коэф,
иондардың бір біріне әсері мен бөлшектердің
химиялық реакцияға қабілеттігінің
арасындағы байланысты көрсетеді. Идеалды
жүйелерде ƒ-1, α~c.
Реалды жүйелерде активтік коэф.ң бірден
айырмашылығы болғандықтан алғашқы конц
тең емес. Ерітіндінің иондық күші мен
активтік коэф арасындағы жалпы
матеметикалық байланыс Дебай Гюккель
lgƒi=A*zi2* µ/1+Ba
µ.
А-еріткіштің диэлектрикалық тұрақтылығы
(D) мен абсолютті температураға (T)
байланысты мән.
µ/1+Ba
µ.
А-еріткіштің диэлектрикалық тұрақтылығы
(D) мен абсолютті температураға (T)
байланысты мән.
I, моль/дм3 |
Автор |
Теңдеу |
≤ 0,01 |
Дебай мен Хюккель |
|
< 0,1 |
Дебай мен Хюккель |
|
≤ 0,1 |
Киланд |
(бейорганикалық иондар үшін)
(органикалық иондар үшін)
|
> 0,1 |
Дэвис |
|
2. Массалар әрекеттесу заңы. Термодинамикалық, концентрациялық және шартты тепе тендік константалардың бір бірімен байланыстары. Массалар әрекеттесу заңы бойынша хим. реакцияның жылдамдығы реакцияға қатысатын заттардың концентрациясының көбейтіндісіне пропорционалды. Массалар әрекеттесу заңы тұрғысында тікелей реакцияның жылдамдығы: Vt=kt [A]*[B]. kt- пропорционалды коэф. ол реакция жылдамдығының константасы д.а. Егер А мен В мәні 1моль\дм3 тең болса онда Vt=kt. Қайтымды реак. жалпы түрі: К=[C]c*[D]d\[A]a*[B]b. Егер тепе теңдік константасының теңдігіне реакцияласатынзаттардың жалпы конц. қойсақ, шартты тепе теңдік конст (Кш) аламыз:
Кш=Ccc*CDd\CAa*CBb=[C]c*[D]d*αAa* αBb\[A]a*[B]b*αCc* αDd=Kk*αα\αα.
Kk=Kш*αCc*αDd\αAa*αBb
Термодинамикалық не шындық тепе теңдік константасы Кт ерітіндінің иондық күшіне және бөгде реакциялардың жүруіне байланысты емес:
Кт= αCc*αDd\αAa*αBb Бұл константа тек температура мен қысымға байланысты. Ал концентрациялық конст Кк температура мен қысымнан басқа ерітінділердің иондқы күшіне де тәуелді. Кк мен Кт константалары бір бірімен былай байланысқан: Кк=Кт*ƒAa*ƒBb\ƒCc*ƒDd немесе lgKk=lgKT+ vi*lg/ƒi , vi=стехиометриялық коэф. Шартты тепе теңдік конст қысымға, температураға, ерітіндінің иондық күшіне және реакцияласатын бөлшектердің бөгде химиялық өзгеріске түсуіне байланысты. Үш константалардың жалпы бір бірімен байланысы:
КТ=Kk* ƒCc*ƒDd \ ƒAa*ƒBb=Кш* αCc* αDd* ƒCc*ƒDd \ αAa*αBb* ƒAa*ƒBb
3. Бренстед Лоуридің протолиттік ілімі. Қосарласқан қышқылдар мен негіздер жұптарының протолиттік тепе теңдіктеріне сәйкес реакциялары. 1923 ж Бренстед пен Лоури қышқылдар мен негіздердің протолиттік теориясын ұсынды. Теория бойынша протонды бөліп шығаратын заттар қышқылдар қатарына жатады, протонды қосып алатын заттар негіздер. Қышқыл<=>негіз + протон; А<=>В+Н+. Әр қышқылға сәйкес негіз пайда болады. Бір протолиттік жүйеге сәйкес қышқыл мен негізді қосарласқан жұп дейді. Реалды жағадйда қышқылды негіздік реакция екі қосарласқан жүптың арасында жүреді. Жұптың біреуі протонды береді(донор), ал екіншісі оны қосып алады(акцептор). Мысалы:
HCl <=>H++Cl-
H++H2O<=>H3O+
HCl+H2O<=> H3O+ + Cl- Бұл жағдайда HCl протонның доноры(қышқыл), ал H2O протонның акцепторы (негіз). Жалпы түрде қышқыл мен негіздің диссоциациялануын былай жазуға болады:
HA+HSolv<=>H2Solv++A- немесе A-+HSolv<=>HA+Solv-. Қышқылдық та негіздік те қасиет көрсететін еріткіштерді амфипротты не амфипротонды еріткіштер дейді. Мысалы, таза суда мынадай протолиттік реакция жүреді: H2O + H2O<=> H3O++ OH-.
4. Автопротолиз. Судың иондық көбейтіндісі. Қышқылдық негіздік қасиеттерге еріткіштердің ниверлеу және дифференциалдау әсерлері. Протонның бірдей бөлшектердің арасында бірінен біріне ауысуын автопротолиздену, не қышқылды негіздік диспропорциялану процесі деп атайды. Таза суда H3O+ және OH- иондарының конц бірдей. Судың конц тұрақты болғандықтан (55.3моль\л) реакцияныың тепе теңдік конст: Kw=aH3O+*aOH- Бұл мәнді автопротолиздену конст не судың иондық көбейтіндісі (Kw) деп атайды. Автопротолиздену тепе теңдігі солдан оңға қарай ығысқандықтан H3O+, OH- иондарының активтіктері аз. Сондықтан тәжірибеде бұл мәндердің теріс логарифмін пайдаланған ыңғайлы: -lg Kw=pKw ; -lg aH3O=pH ; -lgOH=pOH ол былай жазылады: pKw=pH+pOH. Автопротолиздену реак жүргенде бірдей мөлшерде H3O+ және OH- иондары пайда болады. Сондықтан ортаның бейтараптығы осы екі иондардың активтіктерінің теңдіктерімен анықталады: aH3O+= aOH- ; pH=pOH=1\2pKw Егер гидроксоний ионының активтігі гидроксил ионның активтігінен көп болса орта қышқылдық болады: aH3O+>aOH- ; pH<pOH Керісінше гидроксил ионның активтігі гидроксоний ионның активтігінен көп болса орта негіздік(сілтілік) болады: aH3O+<aOH- ; pH>pOH. Таза суда және сүйытылған сулы ерітінділерде активтікті конц ауыстыруға болады: Kw=[ H3O+]*[ OH-] ; pKw=pH+pOH=14 автопротолиз константасының көрсеткіші. HCl, HClO4, H2SO4 сияқты толық ионизацияланатын күшті қышқылдардың судағы қышқылдығы бір біріне тең, себебі олардың күші H3O+ иондарының қышқылдық қасиетімен анықталады. Мұндай әсерді еріткіштің нивелирлеу (тегістеу) әсері дейді. Гидроксил ионынан гөрі күшті негіздер судағы ерітіндіде OH- деңгейіне дейін нивелирленеді.
5. Буферлі ерітінділер, олардың pH-ның тұрақтылығын түсіндіріңіз. Буферлі сыйымдылық. Буферлі ерітінділердің рНы оларды сұйылтқанда, не аздап қышқыл мен негіз қосқанда іс жүзінде өзгермейді.Буферлі ерітіндіні сұйылтқанда қоспаның құрамындағы компоненттердің конц бірдей өзгереді, сондықтан олардың қатынасы тұрақты болып қалады: [ H3O+]= Ka* CHA\CA-; pH=pKa-lg * CHA\CA-
pH=
pKw-pOH=
pKw-pKb+
lg
* CHA\CA-
Егер бұл ерітіндіге H3O+
конц өзгертетін күшті қышқыл қоссақ:
-;
pH=pKa-
CHA+[
H3O+]\
CA--[
H3O+]
Керісінше күшті негіз қоссақ pH=pKa-
CHA-[OH
-]\
CA-+[OH-]
. Буферлі қоспа аналитикалық химияда
кең қолданылады. Буферлі қоспа буферлік
сыйымдылық:
 бұл 1л ерітіндінің pH-ын бірлікке өзгертуге
жеткілікті қышқыл мен сілтінің мөлшері
(моль). Ең жоғарғы буферлік сыйымдылық
бар ерітінді: компоненттердің қатынасы
1:1 тең ерітінді.
бұл 1л ерітіндінің pH-ын бірлікке өзгертуге
жеткілікті қышқыл мен сілтінің мөлшері
(моль). Ең жоғарғы буферлік сыйымдылық
бар ерітінді: компоненттердің қатынасы
1:1 тең ерітінді.
6.
Комплексті қосылыстар, олардың
термодинамикалық, концентрациялық және
шартты тұрақтылық константаларының
бір бірімен байланыстарын көрсетіңіз.
Комплексті
қосылыстар орталық ионнан (атом) М және
онымен байланысқан лигандтардан L
тұрады. Орталық ион комплекстүзгіш.
Лигандтардың координациялық байланыс
түзу қабілеттігі дентаттықпен сипатталады.
Монодентатты лиг: Cl-,
NH3,
H2O2,
CN-;
координациялық орталықпен
тек
бір атоммен (ионмен) байланысып
координациялық сферада те кбір орын
алады. Полидентатты лиг: С2O42-,
PO43-,
органикалық лигандтар; комплекстүзгіштің
бірден артық атомдармен байланысып
координациялық сферада бірден артық
орын алады. Комплекстүзгіш координациялық
санмен сипатталады. Ол комплекстүзгіш
пен лигандтардың арасындағы байланыс
саны. Полидентатты лигандтармен түзілген
комплекстер хелатты ішкі комплексті
қосылыстар д.а. Тұрақтылық конст:
 n=aMLn\aM*aLn
; Концентрациялық тұрақтылық конст
ерітіндінің иондық күшіне байланысты:
n=[MLn]*ƒMLn\[M]*[L]n*ƒM*ƒLn
;
n(C)=
[MLn]\ [M]*[L]n=
n
* ƒM*ƒLn\
ƒMLn
Иондық
күші тұрақты ерітінділерде конц
тұрақтылық конст мәні өзгермей тұрақты
болып қалады, сондықтан
n(C)
пайдаланып тікелей ерітінділердегі
тепе теңдік конц есептеуге болады.
Ерітіндіде жүретін қосымша реакцияларды
ескеру үшін шартты түрақтылық конст
пайдаланған жөн:
n(ш)=
[MLn]\CM*CLn
Шартты тұрақтылық конст есептеу үшін
қосымша реакциялардың коэф білу керек
αM,
αL:
αM=[M]\CM,
αL=[L]\CL
сонда
`=
n(ш)=
[MLn]\ [M]*[L]n*αM*αLn=
n(C)*
αM*αLn.
αM
және αLn
M және L бөлшектерінің белгілі жағдайдағы
мольдік үлесін көрсетеді.
n=aMLn\aM*aLn
; Концентрациялық тұрақтылық конст
ерітіндінің иондық күшіне байланысты:
n=[MLn]*ƒMLn\[M]*[L]n*ƒM*ƒLn
;
n(C)=
[MLn]\ [M]*[L]n=
n
* ƒM*ƒLn\
ƒMLn
Иондық
күші тұрақты ерітінділерде конц
тұрақтылық конст мәні өзгермей тұрақты
болып қалады, сондықтан
n(C)
пайдаланып тікелей ерітінділердегі
тепе теңдік конц есептеуге болады.
Ерітіндіде жүретін қосымша реакцияларды
ескеру үшін шартты түрақтылық конст
пайдаланған жөн:
n(ш)=
[MLn]\CM*CLn
Шартты тұрақтылық конст есептеу үшін
қосымша реакциялардың коэф білу керек
αM,
αL:
αM=[M]\CM,
αL=[L]\CL
сонда
`=
n(ш)=
[MLn]\ [M]*[L]n*αM*αLn=
n(C)*
αM*αLn.
αM
және αLn
M және L бөлшектерінің белгілі жағдайдағы
мольдік үлесін көрсетеді.
7. Бренстед Лоури теориясы тұрғысынан тұздар ерітінділеріндегі протолиттік тепе теңдіктер. Орта тұздар ерітінділерінің рН-ын есептеу формулалары.
Бренстед-Лоуридің протолиттік теориясы тұздардың гидролиз процессін қышқыл-негіздік тепе-теңдікпен түсіндіруге мүмкіндік береді. Тұздар гидролизі астында иондардың сумен алмаса әрекеттесуі болатыны белгілі, нәтижесінде ортаның рН мәні өзгереді.
Аниондар гидролизі келесідей теңдікпен сипатталады:
А1 В1
CH3COO- + H2O ↔ CH3COOH + ОН-
В2 А2
K1 = K = Ka1 / Ka2 = Kw / Ka2; рК1 = 14 – рКа
Гидролиз костантасы К1 түйіскен негіздердің CH3COO- негіздік константасы қызметінде атқарады.
Катиондар бойынща гидролиз келесі теңдікпен өрнектеледі:
В2 А2
[Fe(H2O)6]3+ + H2O ↔ [Fe(H2O)5 (ОН)]2+ + H3O+
А1 В1
K1 = K = Ka1 / Ka2 = Kа1 =Kw / Kb2; рК1 = рKa = 14 – рКb
Бұл жағдайда гидролиз константасы – бұл түйіскен қышқылдардың [Fe(H2O)6]3+ қышқылдық константасы. 1.53-суретте көрсетілген диограмма судың дифференционалданатын аймағы ішіндегі қышқыл мен негіздер үшін гидролиздің ығысуы туралы қорытынды шығаруға көмектеседі. Қышқыл әлсіз болған сайын аниондар гидролизі күштірек, ал негіз әлсіз болған сайын катиондар гидролизі күштірек бола түседі. Гидролиз тепе-теңдігі көбінесе солға бағытталған Кг˂˂1. Гидрлизді рН ерітіндінің өзгеруі арқылы есептеугеде болады.
Мысалы, натрий ацетаты ерітіндісінің рН есептеу үшін гидролиз константасы қолданылады:

Тұздардың концентрациясын С есептесек:
[ОН-]2- = (C-[OH-]) * (Kw/Ka), ал [OH-] ˂˂ C
2pOH = -lgC + 14-pKa немесе pH = 14 –рOH = 7 + 1/2pKa + 1/2lgC
Онда 0,01 М ерітінді үшін NaCH3COO рН=7+2,38-1=8,38.
Гидролиз сұйылтқанда, қыздырғанда немесе байланыстыратын иондары (OH- немесе H3O+) бар заттар қосқанда күшейеді. Алюминий хлориді және натрий карбонаты ерітінділері әрекеттескенде гидролиздің бірлескен кұшеюі пайда болады және реакция соңына дейін жүреді:
![]()
8. Тотығу тотықсыздану потенциалға әсер ететін факторлар(температура, иондық күш, концентрация, рН). Формалды потенциал. Тотығу-тотықсыздану потенциалға тотықтырғыш және тотықсыздандырғыш иондарының концентрациялары әсер етеді: Нернст теңдеуінен потенциал [Ox]/]Red] қатынасына тәуелді екенін көруге болады, сондықтан концентрациялардың қатынастарын өзгерту арқылы потенциалды өзгертуге болады. Мысалы:

2. Ерітіндінің иондық күшінің әсері.
Иондық күштің өзгеруі иондардың активтік коэффициентін өзгертеді. Сондықтан Нернст теңдеуіне стандарт потенциалы орнына формалды потенциал шамасы койылады. Мысалы:
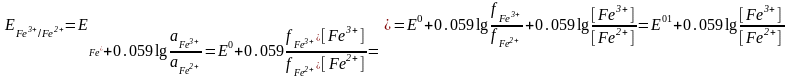
Е01 – формалды потенциал, ол иондық күшкежәне бөгде электролиттер концентрацияларына тәуелді.
3.Потенциалға ерітіндінің рН әсері.
1) Көптеген сулы ерітінділерде өтетін тотығу-тотықсыздану реакцияларына сутек-иондары қатысады. Осындай жүйелердің потенциалдыры ерітіндінің рН-на тәуелді болады:

2) Ерітіндінің рН-нің өзгеруі жүйенің потенциалының өзгеруіне әкеледі, және рН мәніне сәйкес әртүрлі заттар түзілуіне себеп болады. Мысалы:
рН˂˂7

рН=7

pH˃7

Ерітіндінің рН-ның өзгеруі тотығу-тотықсыздану реакцияның бағытын да өзгерте алады.
3) Потенциалға жүйеде комплексті қосылыс түзілуінің әсері.
Тотығу-тотықсыздану жұбының компоненттері қосымша комплекстүзу реакциясына қатысуы потенциалға өте үлкен әсер етеді. Себебі, жүйеде комплекс түзетін заттың активтігі азаяды. Мысалы,

Осы жүйеге KCN ерітіндісін қосқан кезде, күміс иондары цианидты комплекс түзеді:


Осыдан бос күйдегі күміс иондарының концентрациясы азайғанын көруге болады. Осы шаманы Нернст теңдеуіне қойып, келесі тәуелділікті аламыз

Егер
[Ag(CN)2-]
=[CN-]
= 1 болса


Алдында қарастырылған Ag+/Ag жұбына NaCl ерітіндісі қосылатын болса, онда


Cол себептен күміс иондарының концентрациясы кемиді, және осы шаманы Нернст теңдеуіне қойсақ, потенциалдың өзгеретінің көруге болады:

9. Тт-тсзд потенциалына рН әсері, рН арқылы Тт-тсзд реакциялардың бағытын өзгерту жолдары. 1) Көптеген сулы ерітінділерде өтетін тотығу-тотықсыздану реакцияларына сутек-иондары қатысады. Осындай жүйелердің потенциалдыры ерітіндінің рН-на тәуелді болады:
2) Ерітіндінің рН-нің өзгеруі жүйенің потенциалының өзгеруіне әкеледі, және рН мәніне сәйкес әртүрлі заттар түзілуіне себеп болады. Мысалы:
рН˂˂7
рН=7
pH˃7
Ерітіндінің рН-ның өзгеруі тотығу-тотықсыздану реакцияның бағытын да өзгерте алады. Тотығу-тотықсыздану реакциялардың бағытын анықтау
Тотығу-тотықсыздану реакциялардың бағытын электр қозғауыш күшінен және тепе-теңдік константасынан анықтауға болады. Егер ЭҚК ˃0 болса, реакция тура бағытты жүреді, ал егер ЭҚК ˂0 – кері реакция жүреді.
Мысалы,



Мыс ионы – тотықтырғыш, темір – тотықсыздандырғыш.
Э.Қ.К. = EOx- ERed= 0.34 – (-0.44) = 0.78 B ˃0
Тотығу-тотықсыздану реакциясында тепе-теңдік орналғанда екі жұптың потенциал шамалары теңеседі
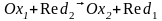
 тепе-теңдік
жағдайда
тепе-теңдік
жағдайда
Мұнда n – толық тотығу-тотықсыздану реакцияға қатысатын жалпы электрон саны.

Электр қозғауыш күшінен тек реакцияның бағытын анықтауға болса, ал тепе-теңдік константаның шамасы тотығу-тотықсыздану реакцияның бағытын және тереңдігін көрсетеді:
Кт-т0 ˃1 – реакция тура бағытта жүреді
Кт-т0 ≥ 108 – реакция аяғына дейін жүреді
Мысалы:

Сондықтан реакция аяғына дейін оң жаққа қарай жүреді.