
- •1. Қатты денеде химиялық байланыс түрлерін талдаңыз.
- •2. Аумақтық теорияға сәйкес қатты денелердегі талдаңыз
- •3. Материалдардың классификациясын меншікті электрлік кедергісі бойынша түсіндіріңіз
- •4. Материалдық, термодинамикалық және физика-химиялық жүйелердің негізгі анықтамаларын, жабық, адиабаттық , ашық және жеке (жабық) жүйелерді сипаттаңыз
- •5. Химиялық байланыстың түрлері қатты материалдардың механикалық қасиеттеріне қалай әсер етеді?
- •6. Химиялық байланыстың түрлері қатты материалдардың электрлік қасиеттеріне қалай әсер етеді?
- •7. Фазалардың негізгі қандай түрлері қатты күйде түзілуі мүмкін?
- •8. Жүйенің тепе-теңдік күйін, гетеро – және гомогенді жүйеледі сипаттаңыз
- •9. Фаза, компоненттер, жүйелер, фазалық тепе-теңдіктер, аллотропия (полиморфизм) ұғымдарын анықтаңыз
- •10. Қатты ерітінділер түрлерін, жүйе компоненттерін (компоненттер саны) сипаттаңыз
- •13. Гиббстің фазалар ережесін түсіндіріңіз
- •14. Нақты металдардың құрылысын, кристалдық құрылымдағы ақауларды түсіндіріңіз
- •15. Негізгі фазалары талдаңыз (қоспалар, қатты ерітінділер, механикалық қоспалар)
- •16. Шексіз еритін екілік жүйенің фазалық тепе-теңдігінің т – х диаграммасын сипаттаңыз. Ликвидус, солидус, фигуративті нүктелер және канода сызықтарына анықтама беріңіз
- •17. Шексіз ерігіштік фазалардың болуының қажетті және жеткілікті шарттарын түсіндіріңіз.??
- •18. Эвтектикалық ауысуы бар күй диаграммаларын түсіндіріңіз
- •19. Шексіз ерігіштен шекті ергіштікке өту шарттарын түсіндіріңіз
- •20. Атомдардың құрылысы мен химиялық байланысын түсіндіріңіз
19. Шексіз ерігіштен шекті ергіштікке өту шарттарын түсіндіріңіз
Термодинамический анализ позволяет качественно, а во многих случаях и количественно, объяснить переход от диаграммы с неограниченной растворимостью к другим типам фазовых диаграмм. Исходным пунктом для решения вопроса о результатах взаимодействия атомов разного сорта при их смешении является знак изобарно-изотермного потенциала смешения:
|
Величина
 сложно зависит от ряда факторов, основными
из которых являются два:
сложно зависит от ряда факторов, основными
из которых являются два:
1) химический, учитывающий степень химического сродства компонентов (их валентность, электроотрицательность, тип решетки);
2)
геометрический, учитывающий разницу в
«размерах атомов» взаимодействующих
компонентов при образовании раствора:
 ,
где
,
где
 и
и
 – атомные радиусы компонентов А
и В, определяемые
химической связью, возникающей при
образовании раствора.
– атомные радиусы компонентов А
и В, определяемые
химической связью, возникающей при
образовании раствора.
Усиление
химического сродства компонентов
уменьшает внутреннюю энергию фазы
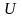 и,
следовательно, величину энтальпии,
поскольку
и,
следовательно, величину энтальпии,
поскольку
-

(3.47)
поэтому
в этом случае
 должно быть отрицательным.
должно быть отрицательным.
Увеличение
разницы в размерах взаимодействующих
атомов
 должно вызывать возрастание внутренней
энергии
и соответственно энтальпии
должно вызывать возрастание внутренней
энергии
и соответственно энтальпии
 ,
в том числе в случае твердого раствора
за счет увеличения энергии упругой
деформации решетки (
,
в том числе в случае твердого раствора
за счет увеличения энергии упругой
деформации решетки ( );
при
этом
должно быть положительным.
);
при
этом
должно быть положительным.
Нужно
различать случаи химического взаимодействия
при образовании твердого раствора между
ближайшими соседними атомами одного
сорта (А–А)
или
(В–В)
и
взаимодействие между ближайшими
соседними атомами разного сорта (А–В).
Соответствующие
энергии связи (энтальпии) обозначим
 и
и
 .
.
В случае идеального раствора энергия связи пар атомов разного сорта будет равна среднему арифметическому от энергии связи пар атомов одного сорта, т. е.
-

(3.48)
В этом случае энтальпия смешения = 0, так же как и параметр взаимодействия Ω = 0 (см. табл. 3.4).
В
реальном растворе
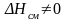 .
Знак величины энтальпии смешения зависит
от знака Ω. Величина
,
так же как и Ω,
может
быть отрицательной или положительной.
.
Знак величины энтальпии смешения зависит
от знака Ω. Величина
,
так же как и Ω,
может
быть отрицательной или положительной.
Следует,
однако, учитывать, что результат
взаимодействия компонентов определяется
величиной
только при низких температурах: Т→0. С
повышением температуры в соответствии
с выражением (3.27) становится значительной
роль произведения
 (так
называемого энтропийного
члена).
(так
называемого энтропийного
члена).
20. Атомдардың құрылысы мен химиялық байланысын түсіндіріңіз
Атом құрылысы - 1897 жылы көптеген электр құбылыстарын түсiндiруге мүмкiндiк беретiн жаңалық ашылды. Ағылшын ғалымы Дж. Дж. Томсон элементар заряд тасымалдаушысы болып табылатын бөлшектi тапты. Бұл бөлшекті электрон деп атады.
Электрон массасы m=9,1*10-31 кг-ға тең және табиғаттағы ең жеңiл сутегi атомы массасынан 3700 еседей аз болып шықты. Электр зарядын арттыруға және азайтуға болады. Яғни олар әр түрлі мәнге ие болуы мүмкін. Ендеше электр заряды физикалық шама.
Резерфорд атомының құрылысын Күн жүйесiне ұқсатты. Күн жүйесiндегi планеталар оған тартылып айналғаны сияқты, электрондар да ядроға тартылып оны айнала қозғалады. Осындай ұқсастығы үшiн Резерфорд ұсынған модельдi планетарлық модель деп атаған. Ядро мен электронның ара қашықтығы олардың өлшемдерiне қарағанда өте үлкен. Егер атомды ойша үлкейткенде ядроның диаметрi он теңгелiктей болса, онда ядро мен электрон ара қашықтығы шамамен бiр километрдей болар едi. Егер барлық электрондар атомдық ядроларға тығыз орналасса, онда ересек адамның денесiнiң көлемi бiр куб миллиметрдiң миллионнан бiр бөлiгiндей болатындығы есептелген. Бұдан адам денесiнiң 99%-ын (кез-келген дененiң) бостық жайлайтындығын көремiз. Бiр тектi атомдар жиынтығы химиялық элемент деп аталады. Әр түрлi химиялық элементтердiң атомдары бiр-бiрiнен ядроларының зарядымен және сол ядроны айнала қозғалатын электрондар санымен ерекшеленедi. Мысалы, сутегi атомында жалғыз электрон бар, оттегi атомында – сегiз электрон, ал уран атомында – тоқсан екi. Атомдағы электрондар саны элементтiң Д.И. Менделеев кестесіндегі реттiк нөмiрiмен сәйкес келедi. Осы нөмiр атом ядросының зарядын да анықтайды. Белгiлеу енгiзейiк: Z – элементтiң реттiк нөмiрi, е = атомдағы электрондар саны. Онда атом ядросының және атомдағы барлық электрондардың жалпы заряды үшiн былай жазуға болады: qядро = + Ze, qэл-н = – Ze. Атомдағы электрондардың жалпы зарядын, атом ядросының зарядына қоссақ нөл шығады. Бұл атомның толықтай бейтарап екендiгiн көрсетедi. Бейтарап атомдардан тұратын заттардың молекулалары да бейтарап болады. Кейбiр жағдайларда (мысалы, соқтығысқанда) атомдар бiрнеше электронын жоғалтуы мүмкiн. Атомдар электрондармен бiрге өздерiнiң терiс зарядының бiр бөлiгiн жоғалтып, бейтарап емес жүйеге айналады. Осының салдарынан пайда болған оң зарядталған атомды оң ион деп атайды. Керi жағдайлар да болуы мүмкiн: бейтарап атом өзiне артық электрон қосып алып, терiс зарядталады. Мұндай атомды терiс ион деп атайды.
Атом ортасында оң зарядталған ядродан және оның қабықшасын құрайтын, орасан зор жылдамдықпен қозғалатын электрондардан тұрады
Элементар электр заряды е=-1,6*10-19 Кл. Электронның массасы m =9,1 * 10-31 кг
Ядроның құрамына оң зарядталған бөлшек протон және нейтрон деп аталатын бейтарап бөлшек кіреді
Ядродағы нейтрондардың саны протондардың санына тең
Ядроның заряды оң және абсолют мәні бойынша атомдағы барлық электрондардың зарядына тең
Оң ион-кандай да бір өзара эрекеггесу нәтижесінде электрондарынан айрылған атом
Теріс ион - қандай да бір өзара әрекеттесу нәтижесінде артық электрондарды қосып алған атом
Атомның өлшемі өте кіші 10-10 м
Атом ядросының өлшемі (10-14 м ), атомнан он мың есе кіші.
Химиялық байланыстар — химиялық элементтер арасындағы тұрақты тепе-тең күйдегі жүйе жасауға келіп тірелетін (молекула, ион, радикал) электромагниттік әсерлесу жиынтығы.
Химиялық байланыс — атомдардың химиялық қосылыс түзіп әрекеттесуі.
19 ғасырдың басында К.Бертолле Химиялық байланыс түзілуінің гравитациялық,
1810 жылы Й.Я Берцелиус электрхимиялық,
1861 жылы орыс ғалымы А.Н Бутлеров заттардың химиялық құрылыс теориясын,
1915 жылы неміс физигі Кассель,
1916 жылы ағылшын ғалымы Г.Льюис электрондық теорияларын ұсынды.
Кванттық механика көзқарасы тұрғысынан Химялық байланыс валенттілік сұлба және молекулалық орбиталдар әдісімен түсіндіріледі. Химиялық байланыс түзілуіне қарай төртке бөлінеді:
иондық
ковалентті
металдық
сутектік
Иондық Химиялық байланыс электр терістілігі бойынша айырмашылығы үлкен металл мен бейметалл атомдары арасында түзіледі. Химиялық әрекеттескенде валенттік электрондарын беріп, оң зарядты иондарға (катиондарға): К־–е–К+ бейметалл атомдары электрондар қосып алып, теріс зарядты иондарға (аниондарға) айналады: Cl+е–Cl־. Әр аттас зарядты иондар бірін-бірі тартып молекула құрайды: K+ + Cl ־= KCl. Иондық Химиялық байланыс қарама-қарсы зарядталған иондардың электрстатикалық тартылысы нәтижесінде жүзеге асады. Иондар түзілу арқылы жүзеге асатын байланыстарды иондық байланыс, қосылыстың өзін иондық қосылыс деп атайды.
Ковалентті Химиялық байланыста — әрекеттесуші атомдарға ортақ электрондар жұбы пайда болып, олардың санына қарай бір немесе бірнеше еселенген байланыстар түзіледі. Мысалы, сутек молекуласы атомдары арасында бір (Н:Н), оттек молекуласында қос (:О::О:), азот молекуласында үш (:N:::N:) еселенген ковалентті Химиялық байланыс бар. Ковалентті Химиялық байланыстар электрон жұбының атомдардың арасында орналасуына қарай полюсті және полюссіз деп екіге бөлінеді.
Полюсті молекулада Химиялық байланыс түзетін ортақ электрондар электр терістілігі күшті атомға ығыса орналасады. Молекуланың полюстілігі диполь моменті арқылы көрсетіледі. Полюстік молекулалардың қайнау және балқу температурасы төмен, полюсті еріткіштерде үйектеліп иондарға ыдырайды.
Полюссіз ковалентті Химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде ортада орналасқан. Полюссіз Химиялық байланыстағы қосылыстардың қайнау және балқу температуралары төмен, полюсті еріткіштерде иондар түзбейді, электр тоғын өткізбейді.
Химиялық байланысының негізгі сипаттамалары:
байланыс энергиясы,
байланыс ұзындығы,
валенттік бұрыш.
Байланыс энергиясы — өзара байланысқан атомдарды не иондарды бір-бірінен ажырату үшін жұмсалатын энергия. Байланыс ұзындығы — Химиялық байланыстағы атомдар ядроларының арасындағы қашықтық, валенттік бұрыш — байланысқан атомдар ядролары арқылы жүргізілетін жорамал сызықтар арасындағы бұрыш. Бұл көрсеткіштер зат молекуласының құрылысын, пішінін және беріктігін сипаттайды.
Химиялық байланыстардың түрлері
Ковалентті байланыс ортақ электрон жұбы түзілу арқылы іске асады.
Химиялық байланыстың түзілуін электртерістілік ұғымын қолданып түсіндіруге болады.
Электртерістіліктері бірдей элемент атомдарының арасында (Н2, О2, N2, С12) байланыста болатын сутек молекуласының түзілу мысалында қарастырайык. Сутек атомының электрондық формуласы 1s1. Сутектің электротерістілігі 2,1. S-электрондарының электрон бұлттары сфера (шар) тәрізді, олардың өзара әсерлесуін былай көрсетуге болады:
Полюссіз ковалентті байланыста байланыстырушы электрон жұбының бұлты ядролардан бірдей қашықтықта орналасады.
α - байланыс дегеніміз электрон бұлттарының қабысу ауданы ядролардың қосылу сызығының бойында жатқанда түзілетін байланыс (а). Ал pi-байланыс — электрон бұлттарының қабысу ауданы ядроларды қосатын сызықтың екі жағында орналасқанда түзіледі (ә).
Иондық байланыс - иондардың арасында электрстатикалық тартылыс күшінің әсерінен түзілетін байланыс.
Оң зарядты иондар - катиондар, ал теріс зарядты иондар - аниондар.
Нағыз металдар (I, ІІА) мен нағыз бейметалдардың (VI-VIIА) арасында иондық байланыстар түзіледі. Иондық байланыс тұздарда, негіздерде және қышқылдарда да байқалады. Иондардың зарядтары араб цифрларынан кейін көрсетіліп, элемент таңбасының оң жағын ала жазылады

