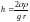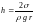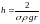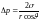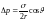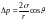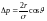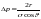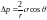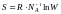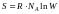Уровень1
1
V2 |
Изопроцестерге жатады |
1 |
изотермдік |
0 |
конвекциялық |
1 |
изобаралық |
0 |
жұмыс |
1 |
изохоралық |
0 |
тұтқырлық |
0 |
жылу беру |
0 |
жылуалмасу |
2
V2 |
СИ
жүйесіндегі { |
1 |
|
0 |
|
0 |
|
1 |
|
1 |
|
0 |
|
0 |
|
0 |
|
3
V2 |
СИ жүйесіндегі {Больцман, Авогадро және универсал газ тұрақтыларының} өлшем бірліктері |
0 |
Дж/(кг× К) |
1 |
Дж/(моль× К) |
0 |
Дж× моль /К |
1 |
Дж/К |
1 |
1/моль |
0 |
К /(моль × Дж) |
0 |
Дж/кг |
0 |
Дж/моль |
4
V2 |
Күй функциялары |
1 |
ішкі энергия |
0 |
жұмыс |
1 |
энтальпия |
0 |
жылуөткізгіштік |
1 |
энтропия |
0 |
тұтқырлық |
0 |
конвекция |
0 |
жылу мөлшері |
5
V2 |
Қайтымсыз процестерге жатады |
1 |
диффузия |
0 |
изоэнтальпиялық |
1 |
тұтқырлық |
0 |
адиабаталық |
0 |
ылуалмасу |
0 |
жылу беру |
1 |
жылуөткізгіштік |
0 |
конвекция |
6
V2 |
Изопроцестерде өзгермейді |
1 |
қысым |
0 |
жұмыс |
0 |
жылу мөлшері |
0 |
ішкі энергия |
1 |
температура |
1 |
көлем |
0 |
тығыздық |
0 |
масса |
7
V2 |
Термодинамикалық жүйенің макропараметрлері |
1 |
қысым |
0 |
ішкі энергия |
0 |
энтропия |
0 |
тығыздық |
1 |
температура |
0 |
ішкі энергия |
0 |
жылу |
1 |
көлем |
8
V2 |
Идеал газ заңдары |
1 |
Шарль |
1 |
Бойль-Мариотт |
0 |
Джоуль |
0 |
Дальтон |
0 |
Авогадро |
0 |
Больцман |
1 |
Гей-Люссак |
0 |
Клапейрон |
9
V2 |
Термодинамикалық потенциалдар |
1 |
U(S,V ) |
0 |
G(T,p) |
0 |
H(S,T) |
0 |
F(S,T) |
1 |
H(S,p) |
0 |
U(T,P) |
1 |
F(T,V) |
0 |
G(T,V) |
10
V2
|
Тасымалдау коэффициенттерінің {диффузия, жылуөткізгіштік және динамикалық тұтқырлық коэффициенттерінің} қысымға тәуелділігі |
0 |
тұтқырлық коэффициенті өте жоғары емес қысымда, қысымға тура пропорционал |
0 |
тұтқырлық коэффициенті өте жоғары емес қысымда, қысымға кері пропорционал |
1 |
тұтқырлық коэффициенті өте жоғары емес қысымда, қысымға тәуелді емес |
1 |
жылуөткізгіштік коэффициенті өте жоғары емес қысымда, қысымға тәуелді емес |
0 |
жылуөткізгіштік коэффициенті өте жоғары емес қысымда, қысымға кері пропорционал |
0 |
жылуөткізгіштік коэффициенті өте жоғары емес қысымда, қысымға кері пропорционал |
0 |
диффузия коэффициенті өте жоғары емес қысымда, қысымға тура пропорционал |
1 |
диффузия коэффициенті өте жоғары емес қысымда, қысымға кері пропорционал |
11
V2 |
Идеал газдың тығыздығы келесі формулалармен есептелінеді |
1 |
|
0 |
|
1 |
|
0 |
|
0 |
|
0 |
|
0 |
|
1 |
|
12
V2 |
Тасымалдау коэффициенттерінің{диффузия, жылуөткізгіштік және динамикалық тұтқырлық коэффициенттерінің} температураға тәуелділігі |
0 |
тұтқырлық коэффициенті өте жоғары емес температурада, температураға тура пропорционал |
0 |
тұтқырлық коэффициенті өте жоғары емес температурада, температураға кері пропорционал |
1 |
жылуөткізгіштік коэффициенті өте жоғары емес температурада, түбір астындағы температураға тура пропорционал+ |
0 |
жылуөткізгіштік коэффициенті өте жоғары емес температурада, температураға тәуелді емес |
1 |
тұтқырлық коэффициенті өте жоғары емес температурада, түбір астындағы температураға тура пропорционал |
1 |
диффузия коэффициенті өте жоғары емес температурада, түбір астындағы температураға тура пропорционал |
0 |
диффузия коэффициенті өте жоғары емес температурада, температураға кері пропорционал |
0 |
диффузия коэффициенті өте жоғары емес температурада, температураға тура пропорционал |
13
V2 |
СИ жүйесіндегі {диффузия, жылуөткізгіштік және тұтқырлық}коэффициенттерінің өлшем бірлігі |
0 |
кг× м2 /с |
0 |
кг× м/ К |
0 |
м2 /с. |
0 |
м /с2 |
1 |
м2 × с |
1 |
кг/м× с |
0 |
кг× м/ с× К |
1 |
кг× м/ с3× К |
14
V2 |
Идеал газда изотермдік процесте тұрақты болып қалады |
1 |
энтальпия және энтропия |
1 |
энтропия және ішкі энергия |
1 |
ішкі энергия және энтальпия |
0 |
энтальпия және температура |
0 |
температура және қысым |
0 |
қысым және көлем |
0 |
көлем және тығыздық |
0 |
тығыздық және масса |
15
V2 |
Идеал газдың күй теңдеуі өзара байланыстырады |
1 |
көлем |
0 |
жылу мөлшері |
0 |
жылдамдық |
1 |
температура |
0 |
тығыздық |
1 |
қысым |
0 |
орташа кинетикалық энергия |
0 |
ішкі энергия |
16
V2 |
Температураның дұрыс тұжырымдамасы |
0 |
температура – дененің қыздырылу деңгейі |
0 |
температура – дененің энергиясына пропорционал физикалық шама |
1 |
температура – хаосты қозғалыстағы молекулалардың ілгерілемелі қозғалысының орташа кинетикалық энергиясына пропорционал физикалық шама |
0 |
температура - хаосты қозғалыстағы молекулалардың толық кинетикалық энергиясына пропорционал физикалық шама |
0 |
температура - өзара молекулааралық әрекеттесудің потенциальдық энергиясына тура пропорционал физикалық шама |
0 |
температура – молекулалардың сыртқы күштер өрісіндегі потенциальдық энергиясына тура пропорционал физикалық шама |
1 |
температура – өте көп бөлшектерден тұратын жүйеге тән физикалық қасиет |
1 |
температура – өте көп бөлшектерден тұратын жүйені сипаттайтын статистикалық шама |
17
V2 |
СИ жүйесіндегі {Больцман, Лошмидт және Универсал газ} тұрақтыларының өлшем бірліктері |
0 |
Дж/(моль×К) |
0 |
Дж/моль |
1 |
Дж/К |
0 |
Дж×моль |
0 |
Дж×К |
1 |
Дж/(моль×К) |
1 |
кг∙м2/(с2∙К) |
0 |
1/м3 |
18
V2 |
Идеал газдың күй теңдеуі (m – газ массасы, M – молярлық масса) |
0 |
|
0 |
|
1 |
|
0 |
|
0 |
|
1 |
|
1 |
|
0 |
|
19
V2 |
Орташа
квадраттық
|
0 |
|
0 |
|
0 |
|
1 |
|
0 |
|
1 |
|
1 |
|
0 |
|
20
V2 |
Орташа
арифметикалық
|
0 |
|
1 |
|
0 |
|
0 |
|
0 |
|
1 |
|
1 |
|
0 |
|
21
V2 |
Ең
ықтимал
|
0 |
|
0 |
|
1 |
|
0 |
|
0 |
|
1 |
|
1 |
|
0 |
|
22
V2 |
Кез-келген
моль үшін Дюлонг-Пти заңы |
1 |
|
1 |
|
0 |
|
0 |
3R |
0 |
6R |
0 |
2R |
1 |
25 |
0 |
|
23
V2 |
Жылу мөлшеріне арналған дұрыс формулалар |
1 |
|
1 |
|
0 |
|
1 |
|
0 |
|
0 |
|
0 |
|
0 |
|
24
V2 |
Изопроцестердегі ішкі энергияның өзгерісі |
0 |
dU = RT |
1 |
dU = dQ |
0 |
dU = 3RT |
1 |
dU = – dA |
0 |
dU = 0 |
0 |
dU = kT |
1 |
dU = dQ – dA |
0 |
dU = – dQ |
25
V2 |
Термодинамиканың бірінші бастамасының дұрыс формулалары |
1 |
|
0 |
|
0 |
|
0 |
|
0 |
|
0 |
TdS= - dU+pdV |
1 |
TdS=dU+pdV |
1 |
dU= pdV - TdS |
26
V2 |
СИ жүйесіндегі {Больцман, Лошмидт және Универсал газ} тұрақтыларының өлшем бірліктері |
0 |
Дж/(моль×К) |
0 |
Дж/моль |
1 |
Дж/К |
0 |
Дж×моль |
0 |
Дж×К |
1 |
Дж/(моль×К) |
1 |
кг∙м2/(с2∙К) |
0 |
1/м3 |
27
V2 |
Бір моль идеал газдың ішкі энергиясына арналған дұрыс формуласы |
1 |
|
0 |
|
0 |
|
0 |
|
0 |
|
1 |
|
1 |
|
0 |
|
28
V2 |
СИ жүйесіндегі {Больцман, Лошмидт және Универсал газ} тұрақтыларының өлшем бірліктері |
0 |
Дж/(моль×К) |
0 |
Дж/моль |
1 |
Дж/К |
0 |
Дж×моль |
0 |
Дж×К |
1 |
Дж/(моль×К) |
1 |
кг∙м2/(с2∙К) |
0 |
1/м3 |
29
V2 |
Энтальпияға арналған дұрыс формулалар |
0 |
Н = U - pV |
1 |
Н = U + pV |
0 |
Н = U ∙ pV |
0 |
Н = U - TS |
0 |
Н = U + TS |
1 |
pV = Н - U |
1 |
U = Н - pV |
0 |
Н = pV |
30
V2 |
Больцман формуласының дұрыс түрлері |
0 |
S = kT ln W |
0 |
W = k ln S |
1 |
S = k ln W |
0 |
|
0 |
S = W ln k; |
1 |
|
1 |
|
0 |
S = ln W |
31
V2 |
Жылу ағынының туындау себебтері |
0 |
жылдамдықтың біртексіз үлестірілімі |
0 |
тұтқырлықтың біртексіз үлестірілімі |
1 |
температураның біртексіз үлестірілімі |
0 |
реттелген қозғалыс энергияларының біртексіз үлестірілімі |
0 |
орта тығыздығының біртексіз үлестірілімі |
1 |
ортадағы температура градиенті нөлге тең емес |
1 |
ортадағы температура градиенті теңсіздігінің нөлге теі еместігі |
0 |
орта қозғалысының жылдамдығының нөлге тең еместігі |
32
V2 |
Сұйықтың қатты денеге {жұғатын және жұқпайтын} сұйықтың шектік бұрыштарының өзгеру аумағы |
1 |
|
0 |
|
0 |
|
0 |
|
0 |
|
1 |
|
1 |
|
0 |
|
33
V2 |
Беттік керілу s коэффициентінің дұрыс анықтамасы … |
0 |
сұйықтың бірлік бетінің қайтымды адиабаттық жұмыс арқылы құрылуы |
0 |
сұйық бетінің қайтымды адиабаттық құрылымына жұмсалатын жұмыс |
0 |
сұйықтың бірлік бетінің қайтымды изобаралық жұмыс арқылы құрылуы |
1 |
сұйықтың бірлік бетінің қайтымды изотермдік жұмыс арқылы құрылуы |
0 |
сұйықтың бірлік бетінің қайтымды изотермдік құрылымына жұмсалатын жұмыс |
1 |
сұйықтағы бетке жанама бағытталған контурдың бірлік ұзындығына сәйкес контурға перпендикуляр әсер ететін күш |
1 |
сұйықтағы беттік қабаттағы бірлік бетке сәйкес еркін энергия |
0 |
сұйықтағы бетке жанама бағытталған контурға перпендикуляр әсер ететін күш |
34
V2 |
Диффузиялық ағынның тууындау себебтері |
0 |
орта импульсінің уақыт бойынша өзгеруі |
0 |
бей-берекет қозғалыс импульсінің біртексіз үлестірілуі |
0 |
қоспа компоненттерінің біртексіз үлестірілуі |
1 |
қоспа компоненттері концентрацияларының біртексіз үлестірілуі |
0 |
қоспа компоненттері үйкеліс күштерінің біртексіз үлестірілуі |
1 |
қоспа компоненттерінің градиенттерінің нөлге тең емес |
1 |
қоспа компоненттерінің градиенттерінің нөлден ауытқуы |
0 |
қоспа компоненттерінің градиенттері нөлге тең |
35
V2 |
Көлемі V, p қысымы және температурасы T ыдыстағы молекулалар саны |
0 |
|
0 |
|
1 |
|
0 |
|
0 |
|
1 |
|
1 |
|
0 |
|
36
V2 |
А оқиғасының P(A) ықтималдылығының өзгеру шектері |
0 |
0 ³ P(A)³1 |
0 |
0 £ P(A) ³ 1 |
1 |
0 £ P(A) £ 1 |
0 |
0 ³ P(A) £ 1 |
0 |
0 ³ P(A) = 1 |
1 |
0% ³ P(A)³100% |
1 |
А оқиғасының P(A) ықтималдылығы 0 -ден 1-ге дейінгі шекте өзгереді |
0 |
А оқиғасының P(A) ықтималдылығы 1-ден үлкен |
37
V2 |
Көлемі V ыдыстың ішінде қысымы P екі атомды газдың ішкі энергиясының қанша бөлігі молекулалар ілгерілемелі қозғалысының үлесіне бөлінеді |
0 |
0,4 |
0 |
0,3 |
1 |
0,6 |
0 |
0,5 |
0 |
0.8 |
1 |
3/5 |
1 |
30/60 |
0 |
0,8 |
38
V2 |
Идеал газ изобарадан, изохорадан және изотермадан тұратын цикл жасайды, ал изотермдік процесс циклдың ең кіші температурасында жүреді. Циклдың қай бөлігінде газ жылу алынады (Q > 0) және қай бөлігінде жылу беріледі (Q < 0)
|
0 |
Q12 > 0, Q23> 0, Q31<0 |
0 |
Q12 < 0, Q23< 0, Q31>0 |
1 |
Q12 > 0, Q23< 0, Q31<0 |
0 |
Q12 < 0, Q23> 0, Q31>0 |
0 |
Q12 > 0, Q23< 0, Q31 =0 |
1 |
Q31 < 0, Q12 > 0, Q23 < 0 |
1 |
Q23 < 0, Q12 > 0, Q31 < 0 |
0 |
Q31 < 0, Q12 > 0, Q23 > . |
39
V2 |
Жүйе 1-ші күйден 2-ші күйге көшкенде газдың {V мен P} өзгерісі
|
1 |
артады |
0 |
белгісіз |
0 |
өзгермейді |
0 |
газдың массасын білу қажет |
0 |
әртүрлі газдар үшін жауап әртүрлі |
1 |
кемиді |
0 |
артады |
1 |
кемиді |
40
V2 |
Джоуль-Томсон құбылысы байқалады |
1 |
идеал газдарда құбылыс байқалмайды |
1 |
нақты газдарда газ қызады |
1 |
нақты газдарда газ суйды |
0 |
нақты газдарда құбылыс байқалмайды |
0 |
идеал газдарда байқалады |
0 |
идеал газдарда газ қызады |
0 |
идеал газдарда газ суйды |
0 |
нақты газдарда байқалуы немесе байқалмауы |
41
V2 |
Оттегі
молекулаларының орташа квадраттық
жылдамдығы
|
0 |
411 К |
0 |
104 К |
1 |
205 К |
0 |
309 К |
0 |
(205-273) 0С |
1 |
- 680С |
1 |
478 К |
0 |
515 К |
42
V2 |
Дұрыс формулаларды анықтаңыз |
1 |
|
0 |
|
1 |
|
0 |
|
0 |
|
1 |
|
0 |
|
0 |
|
43
V2 |
Тұрақты көлемдегі (Не) гелийдің молярлық жылусиымдылығы |
0 |
120 кДж/(моль∙ К) |
0 |
2,5 Дж/(моль ∙ К) |
0 |
1,2 кДж/(моль ∙ К) |
0 |
12 Дж/(кмоль ∙ К) |
1 |
12 Дж/(моль ∙ К) |
0 |
124 кДж/(моль ∙ К) |
1 |
0,12 ∙ 102 Дж/(моль ∙ К) |
1 |
0,012 ∙103 Дж/(моль ∙ К) |
44
V2 |
{Изотермдік, изобаралық және изохоралық} процестерге берілген жылудың жұмсалуы |
1 |
термодинамикалық жүйеге берілген жылу тек жұмыс жасауға жұмсалады |
1 |
термодинамикалық жүйеге берілген жылу ішкі энергияны арттыруға және жұмыс жасауға жұмсалады |
0 |
термодинамикалық жүйе ішкі энергияның кемуі арқылы жұмыс жасайды |
0 |
термодинамикалық жүйеге берілген жылу жүйенің массасын арттыруға жұмсалады. |
0 |
термодинамикалық жүйеге берілген жылу жүйенің моль санын арттыруға жұмсалады. |
1 |
термодинамикалық жүйеге берілген жылу тек жүйенің ішкі энергиясын арттыруға жұмсалады |
0 |
термодинамикалық жүйеге берілген жылу жүйенің жылусиымдылығын арттыруға жұмсалады |
0 |
термодинамикалық жүйеге берілген жылу жүйенің жылуын арттыруға жұмсалады |
45
V2 |
{Изотермдік, изобаралық және адиабаталық} процестерге берілген жылудың жұмсалуы |
1 |
термодинамикалық жүйеге берілген жылу тек жұмыс жасауға жұмсалады |
1 |
термодинамикалық жүйеге берілген жылу ішкі энергияны арттыруға және жұмыс жасауға жұмсалады |
0 |
термодинамикалық жүйеге берілген жылу толық энергиясын арттыруға жұмсалады. |
0 |
термодинамикалық жүйеге берілген жылу жүйенің массасын арттыруға жұмсалады. |
0 |
термодинамикалық жүйеге берілген жылу тек жұмыс жасауға жұмсалады |
1 |
термодинамикалық жүйе ішкі энергияның кемуі арқылы жұмыс жасайды |
0 |
термодинамикалық жүйеге берілген жылу жылу жүйенің жылусиымдылығын арттыруға жұмсалады |
0 |
термодинамикалық жүйеге берілген жылу жүйенің жылуын арттыруға жұмсалады |
46
V2 |
Термодинамиканың аксиомалары |
1 |
термодинамикалық тепе-теңдік күйдің болуы |
1 |
энергияның аддитивтілігі |
0 |
температураның аддитивтілігі |
0 |
термодинамикалық тепе-теңдік күйдің болмауы |
0 |
термодинамиканың бірінші заңы |
1 |
термодинамиканың нөлдік заңы |
0 |
термодинамиканың екінші заңы |
0 |
термодинамиканың үшінші заңы |
47
V2 |
Экстенсивті параметрлерге жатады |
1 |
ішкі энергия |
1 |
көлем |
0 |
қысым |
0 |
температура |
0 |
жұмыс |
1 |
энтропия |
0 |
концентрация |
0 |
тығыздық |
48
V2 |
Дұрыс формулалар (g - адиабата теңдеуіндегі дәреже көрсеткіші, i - молекулалардың еркіндік дәрежесінің саны) тізбегі |
0 |
|
0 |
|
1 |
|
1 |
|
0 |
|
0 |
|
0 |
|
1 |
|
49
V2 |
Интенсивті параметрлерге жатады |
0 |
ішкі энергия |
0 |
көлем |
1 |
қысым |
1 |
температура |
0 |
жұмыс |
0 |
энтропия |
0 |
энтальпия |
1 |
концентрация |
50
V2 |
{Жылу мөлшері, жұмыс және ішкі энергия} шамаларының дұрыс анықтамалары |
1 |
жылу мөлшері – процесс |
1 |
жұмыс – процесс |
0 |
жылу мөлшері - күй функциясы |
0 |
жұмыс – күй функциясы |
0 |
жұмыс – процесс, ал ішкі энергия және жылу мөлшері- күй функциясы |
1 |
ішкі энергия- күй функциясы |
0 |
жылу мөлшері – процесс, ал ішкі энергия және жұмыс - күй функциясы |
0 |
жылу мөлшері – күй функциясы, ал жұмыс - күй функциясы |
51
V2 |
Толық жұқпайтын сұйықтың шектік бұрышы |
1 |
|
1 |
|
0 |
|
0 |
|
0 |
|
1 |
|
0 |
|
0 |
|
52
V2 |
Толық жұғатын сұйықтың шектік бұрышы |
0 |
|
0 |
|
0 |
|
1 |
|
0 |
|
1 |
|
1 |
|
0 |
|
53
V2 |
Қалайы (М= 119 г/моль) үшін Дюлонг және Птидің классикалық заңы меншікті жылусиымдылықтың мәнін береді |
0 |
120 Дж/(кг∙ К) |
0 |
2,5 Дж/(кг ∙ К) |
0 |
3,2 кДж/(кг ∙ К) |
0 |
12 Дж/(кг ∙ К) |
1 |
0,021 Дж/(кг ∙ К) |
0 |
124 Дж/(кг ∙ К) |
1 |
0,21 кДж/(кг∙ К) |
1 |
210 Дж/(кг ∙ К) |
54
V2 |
Екінші Карно теоремасының дұрыс жазылған түрі (Т1 – қыздырғыштың температурасы, Т2 – мұздатқыштың температурасы) |
0 |
|
1 |
|
0 |
|
0 |
|
0 |
|
1 |
|
0 |
|
1 |
|
55
V2 |
Қалайы (М= 119 г/моль) үшін Дюлонг және Птидің классикалық заңы меншікті жылусиымдылықтың мәнін береді |
0 |
120 Дж/(кг∙ К) |
0 |
2,5 Дж/(кг ∙ К) |
0 |
3,2 кДж/(кг ∙ К) |
0 |
12 Дж/(кг ∙ К) |
1 |
0,021 Дж/(кг ∙ К) |
0 |
124 Дж/(кг ∙ К) |
1 |
0,21 кДж/(кг∙ К) |
1 |
210 Дж/(кг ∙ К) |
56
V2 |
Пайдалы әсер коэффициентінің жүйесіндегі өлшем бірлігі |
1 |
ПӘК - өлшемсіз шама |
1 |
ПӘК – пайызбен өлшенеді |
0 |
ПӘК – моль арқылы өлшенеді |
0 |
ПӘК – тің өлшем бірлігі L |
0 |
ПӘК – джоуль арқылы өлшенеді |
1 |
ПӘК- тің өлшем бірлігі бірге тең |
0 |
ПӘК – ньютон арқылы өлшенеді |
0 |
ПӘК – кельвин арқылы өлшенеді |
57
V2 |
Идеал газдың дұрыс анықтамасы |
1 |
молекулалары материальдық нүкте ретінде және олар өзара әрекеттеспейтін газ |
0 |
молекулалары абсолютті қатты шар ретінде және олар өзара әрекеттеспейтін газ |
0 |
молекулалары материальдық нүкте ретінде және олар өзара әрекеттеспейтін газ ал олардың арасындағы тебу күші арақашытыққа кері пропорционал |
0 |
молекулалары материальдық нүкте ретінде және олар өзара әрекеттеспейтін газ ал олардың арасындағы тартылыс күші арақашытыққа кері пропорционал |
0 |
молекулалары абсолютті қатты шар ретінде ретінде және ал олардың арасындағы тартылыс күші арақашытыққа тура пропорционал |
1 |
молекулалардың өзіндік өлшемдері есепке алынбайды және молекулалардың өзара әрекеттесуінің потенциальдық энергиясы есептелінбейді |
1 |
молекулалардың өзіндік өлшемдері есепке алынбайды және молекулааралық әрекеттесулер күштері есептелінбейтін модель |
0 |
молекулалары абсолютті қатты шар ретінде ретінде және ал олардың арасындағы тебу күші арақашытыққа кері пропорционал |
58
V2 |
Максвелл қатынастары |
1 |
|
0 |
|
1 |
|
0 |
|
0 |
|
0 |
|
1 |
|
0 |
|
59
V2 |
Авагадро NA.тұрақтысының дұрыс сандық мәні |
1 |
NA = 6,02×1023 моль-1 |
0 |
NA = 6,02×10-23 моль-1 |
0 |
NA = 1023 моль-1 |
0 |
NA = 6,02×10-23 моль-1 |
0 |
NA = 6,02×1015 моль-1 |
0 |
NA = 10 -15 моль-1 |
1 |
NA = 6,02×1026 кмоль-1 |
1 |
NA = 6,02×1023 1/моль |
60
V2 |
Кез-келген масса үшін идеал газдға арналған U ішкі энергияның дұрыс формуласы (m – газдың массасы, M – молярлық масса) |
0 |
|
0 |
|
0 |
|
0 |
|
1 |
|
1 |
|
1 |
|
0 |
|
61
V2 |
Бір моль идеал газға арналған дұрыс күй формулалары (m – газ массасы, M – молярлық масса) |
1 |
|
0 |
|
0 |
|
0 |
|
0 |
|
1 |
|
1 |
|
0 |
|
62
V2 |
Қысымға арналған дұрыс формула |
1 |
|
0 |
|
0 |
|
0 |
|
0 |
|
1 |
|
1 |
|
0 |
|
63
V2 |
Изохоралық процестің дұрыс формуласы |
0 |
|
0 |
|
0 |
|
0 |
|
1 |
|
1 |
|
1 |
|
0 |
|
64
V2 |
Изобаралық процестің дұрыс формуласы |
0 |
|
0 |
|
0 |
|
0 |
|
1 |
|
1 |
|
1 |
|
0 |
|
65
V2 |
Изотермдік процестің дұрыс формуласы |
1 |
|
0 |
|
0 |
|
0 |
|
0 |
|
1 |
|
1 |
|
0 |
|
66
V2 |
Ықтималдылықтың дұрыс нормировкасы |
0 |
|
0 |
|
1 |
|
0 |
|
0 |
|
1 |
|
1 |
кездейсоқ оқиғалардың ықтималдылықтарының барлық қосындысы 1 –ге тең |
0 |
кездейсоқ оқиғалардың ықтималдылықтарының барлық қосындысы 1 –ден үлкен |
67
V2 |
Өзара бірін-бірі болдырмайтын А және В екі оқиға ықтималдылықтарының дұрыс формуласы |
0 |
|
0 |
|
0 |
|
1 |
|
0 |
|
1 |
өзара бірін-бірі болдырмайтын А және В екі оқиға ықтималдылығы А және В оқиғаларының ықтималдылықтарының қосындысына тең |
1 |
өзара бірін-бірі болдырмайтын А және В екі оқиғаның біреуінің болу ықтималдылығы А және В оқиғаларының болу ықтималдылықтарының қосындысына тең |
0 |
өзара бірін-бірі болдырмайтын А және В екі оқиға ықтималдылығы А және В оқиғаларының ықтималдылықтарының айырымына тең |
68
V2 |
Жүйедегі флуктацияның рөлі туралы тұжырым |
0 |
флуктуациялар қарастырылатын аймақтардың өсуіне байланысты салыстырмалы түрде артады |
1 |
флуктуациялардың салыстырмалы рөлі, олар қарастырылатын аймақтардың кемуіне байланысты өседі |
0 |
флуктуациялардың салыстырмалы рөлі, олар қарастырылатын аймақтардың өлшеміне тәуелді емес |
0 |
флуктуациялар қарастырылатын аймақтардың кемуіне байланысты, флуктуациялардың салыстырмалы рөлі салыстырмалы түрде кемиді |
0 |
әртүрлі оқиғалар үшін әртүрлі жауаптар болуы мүмкін |
1 |
қарастырылатын аймақ кіші болған сайын флуктуацияның рөлі артады |
1 |
флуктуациялар қарастырылатын аймақ үлкен болған сайын, жүйедегі флуктуацияның рөлі өте аз |
0 |
жүйедегі флуктуацияның рөлі аймақтың өлшеміне тәуелді емес |
69
V2 |
Термодинамиканың бірінші заңының дұрыс түрі |
0 |
dU = dQ+dA |
1 |
dQ= dU+dA |
0 |
dQ= dU-dA |
0 |
dA = dU+dQ |
0 |
dA = dU-dQ |
1 |
dU = dQ-dA |
1 |
dA = dQ - dU |
0 |
dQ=dU+dA |
70
V2 |
Энтропияға S арналған дұрыс формула (процесс қайтымды) |
0 |
|
0 |
|
1 |
|
0 |
dS = dQ×T |
0 |
dS = dA×T |
1 |
|
1 |
|
0 |
|
71
V2 |
Молекулалардың еркін жүру жолы <l> изохоралық процестегі T температураға тәуелділік формуласы |
1 |
< l > = const |
0 |
<l>~ |
0 |
<l>~ |
0 |
<l>~ |
0 |
<l>~ |
1 |
<l> өзгермейді |
0 |
<l> температура T артқан сайын өседі |
1 |
<l> тұрақты |
72
V2 |
Молекулалық физикада бірлік масса ретінде көміртегі атомының 1/12 масасы қолданылатын болса, бірлік массаның мөлшері |
0 |
|
0 |
|
1 |
|
0 |
|
0 |
|
1 |
|
1 |
|
0 |
кг |
73
V2 |
Дөңгелек капиллярдағы толық жұғу кезіндегі сұйық h деңгейін анықтайтын дұрыс формуласы (s – беттік керілу коэффициенті, r - капилляр радиусы, r – сұйықтың тығыздығы) |
0 |
|
0 |
|
0 |
|
1 |
|
0 |
|
1 |
|
1 |
|
0 |
|
74
V2 |
Радиусы r дөңгелек капиллярдағы қисық беттің астындағы Dр қосымша қысымды анықтайтын дұрыс формула (q - шектік бұрыш) |
0 |
|
0 |
|
1 |
|
0 |
|
0 |
|
1 |
|
1 |
|
0 |
|
75
V2 |
Энтропияға арналған Больцман формуласы (W – термодинаикалық ықтималдылық) |
0 |
S = kT ln W |
0 |
W = k ln S |
0 |
S = ln W |
0 |
S = W ln k |
1 |
S = k ln W |
1 |
|
1 |
|
0 |
|
76
V2 |
Изотермдік процестегі алынған жылу мөлшері жұмсалады |
0 |
жылуды өзгертуге |
1 |
жұмыс істеуге |
0 |
ішкі энергияның өзгерісіне |
0 |
жүйенің құрылымын өзгертуге |
0 |
жылусиымдылықты өзгертуге |
1 |
сыртқы күштерге қарсы істелетін жұмысқа және газды кеңейтуге |
1 |
изотермдік процесте жылу алу кезінде газ ұлғаяды және оң жұмыс жасайды |
0 |
изотермдік процесте жылу алу кезінде газ ұлғаяды және теріс жұмыс жасайды |
77
V2 |
Адиабаталық процесс деп айтамыз |
0 |
тұрақты жылудағы жүретін процесс |
0 |
бұл процесс температура өзгермейтін кезде өтеді |
0 |
қоршаған ортамен жұмыс жасамайтын процесс |
0 |
бұл процесс ішкі энергия өзгермейтін кезде өтеді |
1 |
қоршаған ортамен жылу алмаспайтын процесс |
1 |
бұл процесс қоршаған ортамен жылу алмаспайды |
1 |
бұл процесс жылулық оқшауланған жүйеде өтеді |
0 |
бұл процесс жүйе қоршаған ортадан жылу алатын процесс |

 моль санының, көлемнің, тығыздықтың}
өлшем бірліктері
моль санының, көлемнің, тығыздықтың}
өлшем бірліктері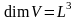
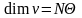


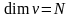
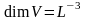
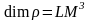


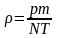

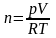

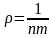
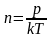
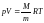


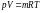


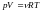
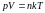
 жылдамдықтың дұрыс формуласы
жылдамдықтың дұрыс формуласы
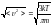
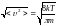
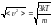

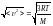
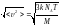
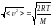
 жылдамдықтың дұрыс формуласы
жылдамдықтың дұрыс формуласы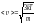
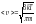
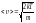


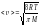
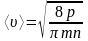

 .жылдамдықтың
дұрыс формуласы
.жылдамдықтың
дұрыс формуласы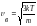
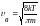
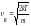
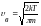





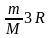

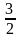 R
R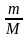


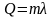
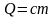
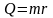

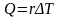
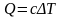
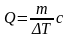
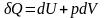
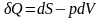

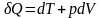

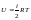
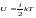

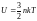

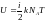


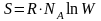
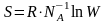 ;
;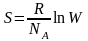

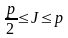
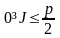
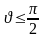
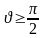
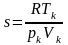
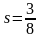

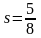



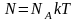
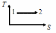

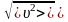 =
400 м/с болғандағы температура
=
400 м/с болғандағы температура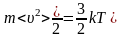

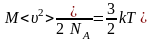
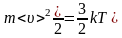

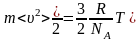
 ~
Eкин + Eпот
~
Eкин + Eпот

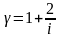
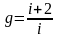
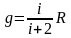
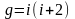


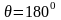
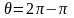

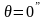
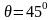
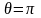

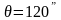

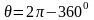
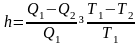


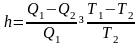
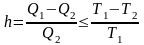



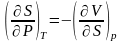





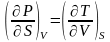
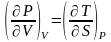


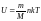



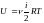
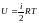
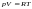
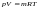
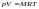
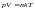
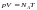

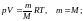

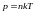
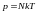
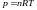
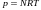
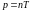

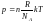
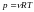
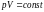
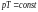
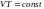
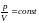
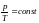
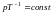
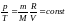
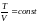
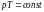
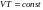

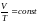
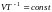
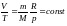
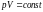



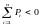
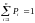
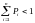
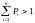
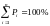
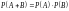
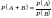
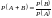
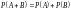

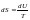

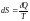

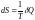

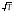
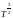

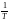
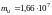 кг
кг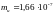 кг
кг кг
кг кг/моль
кг/моль г
г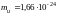 г
г г
г