
- •Канд. Хим. Наук доцент о.М. Иванкина
- •1. Правила техники безопасности
- •2. Основы кинетики химических реакций
- •2.1. Основные понятия химической кинетики
- •2.2. Зависимость скорости реакции от концентрации реагентов
- •2.3. Зависимость скорости реакции от температуры
- •2.4. Влияние катализаторов на скорость реакции
- •2.5. Химическое равновесие. Принцип Ле-Шателье-Брауна
- •2.6. Лабораторная работа №1
- •2. Влияние температуры на скорость реакции
- •3. Влияние катализатора на скорость реакции
- •Химическое равновесие
- •2.7. Контрольные вопросы
- •3. Растворы
- •Основные понятия
- •3.2. Способы выражения содержания растворенного вещества в растворе
- •3.4. Контрольные вопросы
- •Реакции с изменением степени окисления. Основы электрохимии
- •4.1. Окислительно – восстановительные реакции
- •4.2. Электрохимические процессы
- •Катодные процессы
- •4.3. Лабораторная работа № 3 окислительно – восстановительные реакции (овр). Электрохимические процессы
- •4.4. Контрольные вопросы
- •5. Список рекомендуемой литературы
- •Содержание
- •5. Список рекомендуемой литературы………………………..…………….39
- •400131, Г. Волгоград, пр. Ленина, 28, корп. 1.
3.4. Контрольные вопросы
Вариант 1
1. Что называют раствором, растворителем и растворенным веществом?
2. Определите массовую долю соли в насыщенном растворе, если при 20 0С коэффициент растворимости хлорида кальция составляет 74,5 г на 100 г воды.
3. Какие твердые вещества называются практически нерастворимыми?
4. Определите массу растворенного вещества в 200 мл 0,1М раствора серной кислоты.
5. Рассчитайте моляльность раствора, полученного при смешении 100 г NaOH и 300 г воды.
Вариант 2
1. Чем отличается раствор от механической смеси? От химического соединения?
2. В каком объеме воды следует растворить 50 г сульфата натрия с получением насыщенного раствора, если растворимость составляет 19,4 г на 100 г воды?
3. Какую воду называют кристаллизационной?
4. Определите эквивалентную концентрацию раствора, содержащего в 500 мл 2,8 г фосфорной кислоты.
5. Сколько граммов растворенного вещества содержится в 500мл раствора азотной кислоты с молярностью 0,2?
Вариант 3
1. Какие растворы называются насыщенными и ненасыщенными?
2. Массовая доля хлорида натрия в насыщенном растворе при 20 0С составляет 26,6 %. Определите коэффициент растворимости хлорида натрия.
3. Выберите из приведенных соединений кристаллогидраты: KOH, CuSO4·5H2О, FeSO4, C6H12O6, Na2SO4·10H2О.
4. Какой объем 0,5 н раствора серной кислоты можно приготовить из 20 г H2SO4?
5. Рассчитайте мольную долю йода в растворе, содержащем 20 г I2 в 500 г тетрахлорида углерода ССl4.
Вариант 4
1. По каким признакам растворы подразделяются на разбавленные и концентрированные?
2. Сколько граммов нитрата серебра необходимо растворить в 50 г воды, чтобы получить раствор с массовой долей AgNO3, равной 10% ?
3. Что называется кристаллогидратом?
4. Определите массу CuSO4, содержащуюся в 100 мл 0,01н раствора.
5. Рассчитайте мольную долю хлорида натрия в растворе, содержащем 50 г NaCl в 350 г воды.
Вариант 5
1. Какие факторы и как влияют на растворимость жидких и твердых веществ?
2. В 420 г воды растворено 180 г нитрата кальция. Определите массовую долю соли в растворе.
3. Что называется растворимостью и коэффициентом растворимости?
4. Определите молярную концентрацию раствора, содержащего 15 г хлорида натрия в 300 мл раствора.
5. Определите титр раствора КОН, содержащего 5 г КОН в 100 мл раствора.
Реакции с изменением степени окисления. Основы электрохимии
4.1. Окислительно – восстановительные реакции
Реакции, протекающие с изменением степени окисления, называются окислительно – восстановительными. Степень окисления (С.О.) – условный заряд атома в соединении, вычисленный из предположения, что оно состоит только из ионов. С.О. может иметь «+», «─» и «0» значения, которые выражаются арабскими цифрами и ставятся над элементом.
H+N+5O3─2, Cl2 0, Fe+3Cl3─
Для определения С.О. пользуются правилами:
1. С.О. атомов в простых веществах равна нулю: Н20, О30 и т.д.
2. Кислород имеет С.О. -2 во всех соединениях, кроме пероксидов (Н2+1О2-1, Ва+2О2-1) и фторида кислорода O+2F2-1.
3. С.О. +1 во всех соединениях имеет водород, за исключением гидридов активных металлов, в них водород имеет С.О. – 1 (Na+1H-1, Ca+2H2 -1).
4. Атомы элементов I - III групп периодической системы, отдающие свои электроны, имеют постоянную положительную С.О., равную номеру группы.
За исключением: Cu (+1,+2), Au (+1,+2), Hg (+1,+2).
5. Атомы элементов IVА - VIIА групп могут проявлять несколько степеней окисления:
Высшую положительную, равную номеру группы (VI А группа – S+6);
Промежуточную, на 2 единицы меньше, чем высшая (S+4 );
Низшую, равную разности между номером группы и число 8 (S─2).
Исключение: N (+1,+2,+3,+4,+5, -3).
6. Атомы элементов VII А группы – галогены (кроме фтора) могут иметь в соединениях все нечетные С.О. от ─1 до +7 (─1, +1, +3,+5,+7)
7. Алгебраическая сумма С.О. всех частиц в молекуле равна нулю, а в ионе – заряду иона.
K2+Cr2+6O7-2, K+Mn+7O4-2
Окислением называется процесс отдачи электронов, степень окисления атома при этом повышается: Al0 - 3ē → Al+3 ;
Восстановлением называется процесс присоединения электронов, степень окисления при этом понижается: S0 + 2ē → S―2;
Вещества, атомы которых присоединяют электроны, называются окислителями. В процессе реакции окислители восстанавливаются. Вещества, атомы которых отдают электроны, называются восстановителями. В реакции восстановители окисляются.
Окислителями могут быть: неметаллы в свободном состоянии (O20, N20, S0 и т.д.); неметаллы и металлы в высшей степени окисления (Н2S+6О4, HN+5O3, K2Cr2+6O7 и т.д.). Восстановителями могут быть: металлы и водород в свободном состоянии (Н20, Al0, Mg0 и т.д.); металлы и неметаллы в низшей степени окисления (N—3H3 , Sn+2Cl2 , HCl―1 и т.д.).
Вещества, в состав которых входит элемент в промежуточной степени окисления, проявляют окислительно-восстановительную двойственность: по отношению к окислителю они являются восстановителями, а по отношению к восстановителям – окислителями.
ОВР - это единство 2-х противоположных процессов – окисления и восстановления. Число электронов, которое отдает восстановитель, равно числу электронов, которое присоединяет окислитель. На этом основан способ подбора коэффициентов в ОВР методом электронного баланса.
Различают три основных типа окислительно- восстановительных реакций:
1. Межмолекулярные ОВР – это реакции, которые протекают с изменением степени окисления атомов в молекулах разных веществ:
2Ca0 + O20 → 2Ca+2O―2
2. Внутримолекулярные ОВР – это реакции, которые протекают с изменением степени окисления разных атомов в одной молекуле:
2Hg+2O―2 → 2Hg0 + O20
3. Реакции диспропорционирования – это реакции, протекающие с изменением степени окисления одинаковых атомов в молекуле одного и того же вещества:
Cl20 + H2O → HCl― + HCl+1O
Межмолекулярные ОВР уравниваются слева направо, а внутримолекулярные и диспропорционирования – справа налево.
Основные этапы составления уравнения методом электронного баланса рассмотрим на примере реакции
Na2SO3 + KMnO4 + H2SO4 → Na2SO4 + MnSO4 + K2SO4 + H2O
1. Определяем элементы, атомы которых изменяют степень окисления:
Na2+1S+4O3―2 + K+1Mn+7O4―2 + H2+1S+6O4―2 →
→ Na2+1S+6O4―2 + Mn+2S+6O4―2 + K2+1S+6O4―2 + H2+1O―2
2. Находим окислитель и восстановитель в данной реакции и записываем отдельно электронные уравнения процессов окисления и восстановления:
S+4 – 2 ē → S+6 (окисление)
Mn+7 + 5 ē → Mn+2 (восстановление)
Степень окисления серы повысилась от +4 до +6, следовательно, Na2SO3 – восстановитель и в процессе реакции окисляется. Степень окисления марганца понижается от +7 до +2, следовательно, KMnO4 – окислитель и в процессе реакции восстанавливается.
3 .
Для числа отданных и принятых электронов
находим наименьшее общее кратное и
определяем основные коэффициенты:
.
Для числа отданных и принятых электронов
находим наименьшее общее кратное и
определяем основные коэффициенты:
S+4 – 2 ē → S+6 2 5 (окисление 10 ē)
10
Mn+7 + 5 ē → Mn+2 5 2 (восстановление 10 ē)
Наименьшее общее кратное – число 10. Разделив это число на 2, получаем коэффициент 5 при восстановителе Na2SO3, а разделив 10 на 5, получаем коэффициент 2 при окислителе KMnO4.
4. Переносим основные коэффициенты в молекулярное уравнение ОВР:
5Na2SO3 + 2KMnO4 + H2SO4 → 5Na2SO4 + 2MnSO4 + K2SO4 + H2O
5. Сопоставляя левые и правые части уравнения, находим коэффициенты для остальных участников реакции в следующем порядке: сначала уравниваем число атомов металлов, далее – число атомов неметаллов (кроме водорода); в последнюю очередь уравнивается число атомов водорода. Окончательно уравнение будет иметь вид:
5Na2SO3 + 2KMnO4 + 3H2SO4 → 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Для проверки правильности подобранных коэффициентов подсчитываем баланс атомов кислорода в левой и правой частях уравнения.
Если число элементов, атомы которых изменяют степени окисления, больше двух, то определяют общее число электронов, отдаваемых восстановителем, и общее число электронов, принимаемых окислителем.
Рассмотрим реакцию:
FeS + O2 → Fe2O3 + SO2
1. Определяем элементы, атомы которых изменяют степень окисления:
Fe+2S―2 + O20 → Fe2+3O3―2 + S+4O2―2
2. Находим окислитель и восстановитель в данной реакции и записываем отдельно электронные уравнения процессов окисления и восстановления:
Fe+2 – 1 ē → Fe+3 (окисление)
S―2 – 6 ē → S+4 (окисление)
2O0 + 4 ē → 2O―2 (восстановление)
Степень окисления серы повысилась от - 2 до +4, а железа от +2 до +3, следовательно, FeS – восстановитель и в процессе реакции окисляется. Степень окисления кислорода понижается от 0 до -2, следовательно, О2 – окислитель и в процессе реакции восстанавливается.
3 .
Для общего числа отданных атомами железа
и серы электронов (7ē) и принятых кислородом
электронов (4ē) находим наименьшее общее
кратное (28) и определяем основные
коэффициенты:
.
Для общего числа отданных атомами железа
и серы электронов (7ē) и принятых кислородом
электронов (4ē) находим наименьшее общее
кратное (28) и определяем основные
коэффициенты:
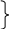 Fe+2
– 1 ē → Fe+3
7 4
Fe+2
– 1 ē → Fe+3
7 4
S―2 – 6 ē → S+4 28
2O0 + 4 ē → 2O―2 4 7
4. Окончательное уравнение ОВР будет иметь вид:
4FeS + 7O2 → 2Fe2O3 + 4SO2
