
РДС_Аряев
.pdf
Раздел ІV. Патология неонатального периода
10% й раствор глюкозы, со вторых суток с учетом диуреза начинают добавлять электролиты. Характер и темп инфузионной терапии зависит от результатов мониторинга за основными клинико лабораторными параметрами.
2.Поддержание адекватной перфузии и артериального давления.
3.Устранение судорог.
4.Обеспечение адекватной оксигенации (на фоне мониторирования газов крови и кислотно щелочного состояния).
5.Коррекция гипогликемии (мониторирование уровня глюкозы в сыворот ке крови).
Профилактика перинатальной асфиксии предусматривает: своевременное определение факторов риска асфиксии; адекватное ведение беременных из груп пы высокого риска; своевременную диагностику и лечение внутриутробной ги поксии плода; мониторирование состояния плода во время родов и адекватное ведение родов.
Прогноз. Летальность при асфиксии тяжелой степени достигает 10–20 %, ча стота отдаленных психоневрологических осложнений тоже достаточно велика
ипри гипоксически ишемической энцефалопатии тяжелой степени составляет 20–40 %. Отдаленный прогноз при острой интранатальной асфиксии более бла гоприятный, чем при асфиксии новорожденного, которая развилась на фоне хро нической внутриутробной гипоксии.
ГЛАВА 4. ЗАБОЛЕВАНИЯ И ПОРОКИ РАЗВИТИЯ ДЫХАТЕЛЬНОЙ СИСТЕМЫ
СИНДРОМ РЕСПИРАТОРНЫХ (ДИСТРЕСС) РАССТРОЙСТВ У НОВОРОЖДЕННОГО
Синдром респираторных (дистресс) расстройств у новорожденных чаще на зывают респираторным дистресс синдромом (РДС), или болезнью гиалиновых мембран (БГМ). Острое нарушение функции дыхания развивается преимуще ственно у недоношенных детей в первые часы жизни и обусловлено незрелос тью легких, дефицитом сурфактанта.
Частота заболевания обратно пропорциональна гестационному возрасту но ворожденного: при сроке гестации менее 26 нед — 90 %, 28–30 нед — 50–70 %, 30–32 нед — 20 %, 35–36 нед — 5 %, у доношенных детей — менее 1 %.
Этиология. Причина развития РДС заключается в дефиците сурфактанта. Это было доказано в пятидесятые годы исследованиями Е. М. Avery и А. Mead. Дефицит сурфактанта может быть связан с недостаточным его синтезом, нару шением выброса, повышенным разрушением или ингибированием.
Предрасполагающие факторы развития РДС: недоношенность, внутриутроб ная гипоксия плода и асфиксия новорожденного, внутриутробные инфекции, кесарево сечение, сахарный диабет у матери, многоплодная беременность, ох лаждение новорожденного, гиповолемия плода и новорожденного.
255

Неонатология
Сурфактант легких — это поверхностно активное вещество, выстилающее поверхность альвеол. Он синтезируется альвеолоцитами II типа и безволоско выми бронхиолярными клетками Кларка. Сурфактант состоит из липидов (90 %) и неплазменных сурфактант ассоциированных протеинов (10 %). Ли пидная фракция включает 10 % нейтральных липидов и 80 % фосфолипидов: фосфатидилхолин (лецитин) — 70 %, фосфатидилглицерол — 5 %, фосфатидил этаноламин — 3 % и другие фосфолипиды. Наиболее важную роль в снижении поверхностного натяжения играют молекулы дипальмитоил фосфатидилхоли на, составляющие 60 % фосфатидилхолина. Сурфактант ассоциированные про теины A, B, C, D влияют на секрецию и поглощение фосфолипидов, играют роль в местном иммунитете.
Сурфактант выполняет следующие функции: снижает поверхностное натя жения альвеол, что препятствует спадению альвеол на выдохе; защищает аль веолярный эпителий; улучшает «отлипание» мокроты и мукоцилиарный кли ренс; повышает местный иммунитет за счет антистафилококковой и антипнев мококковой активности и стимуляции макрофагальной реакции легких; умень шает проницаемость стенок альвеол, препятствует развитию отека легких.
Продукция легочного сурфактанта начинается на 20–24 й неделе внутриут робного развития. До 34–35 й недели гестации основной фосфолипид — фос фатидилхолин — синтезируется путем метилирования фосфатидилэтанолами на с помощью метилтрансферазы. Этот путь синтеза фосфатидилхолина легко нарушается при гипоксии, гипотермии и ацидозе. После 35 й недели гестации этот фосфолипид синтезируется из цитидиндифосфатхолина в присутствии фосфатидилхолинтрансферазы. Этот путь синтеза фосфатидилхолина устойчив к действию неблагоприятных факторов, поэтому считается, что к этому сроку сурфактант созревает. У ребенка, родившегося до 35–36 й недели гестации, имеющиеся запасы сурфактанта обеспечивают начало дыхания. Патологичес кое течение беременности до 35–36 нед гестации, сопровождающееся метабо лическими нарушениями у плода (гиповолемия, гипоксия, ацидоз), усугубляет дефицит сурфактанта. У детей, рожденных матерями с сахарным диабетом, при достаточном количестве фосфатидилхолина имеется дефицит фосфатидилгли церола, что также может привести к развитию РДС даже у доношенных ново рожденных.
Патогенез. При отставании темпов синтеза сурфактанта от темпов его рас пада происходит спадение альвеол на выдохе, что создает необходимость в даль нейшем прикладывать дыхательные усилия при каждом вдохе, как при первом. Ателектазы, возникшие при этом, обуславливают нарушение газообмена в лег ких и развитие в организме новорожденного гипоксии, гиперкапнии и респи раторно метаболического ацидоза. Ацидоз и гипоксия вызывают спазм легоч ных артериол и отек альвеолярой стенки, тормозят синтез сурфактанта, пре кращая его при рН ниже 7,15–7,20. Спазм артериол ведет к повышению давле ния в сосудах легких и шунтированию крови справа налево, объем которого может составлять 75 % объема выброса правого желудочка. Вследствие гипо перфузии легких развивается гипоксическое повреждение стенок легочных ка пилляров, облегчающее пропотевание элементов плазмы в просвет альвеол с последующим выпадением фибрина и образованием гиалиновых мембран на их поверхности. Гиалиновые мембраны блокируют дыхательную поверхность
256

Раздел ІV. Патология неонатального периода
легких, инактивируют сурфактант и тормозят его синтез. Имеющийся у ново рожденного ребенка дефицит прокоагулянтов, выраженные гемодинамические нарушения, порожденные гипоксией, могут привести к геморрагическим про явлениям вплоть до кровоизлияния в легкие, ЦНС и другие органы.
Клиника. Симптомы РДС могут развиться у ребенка сразу после рождения или в течение первых 6 час жизни. Появляются учащение дыхания более 60 в 1 мин, асинхронность движения грудной клетки и брюшной стенки (дыхание типа «качелей»), втяжение грудины и межреберий, раздувание крыльев носа, участие вспомогательной мускулатуры в акте дыхания. Для РДС характерны экспираторные шумы, возникающие как компенсаторный механизм, в резуль тате спазма голосовой щели на выдохе, что способствует увеличению остаточ ной емкости легких. При аускультации выслушивается сначала ослабление ды хания, затем появляются крепитация, сухие и влажные хрипы в легких. Харак терным симптомом считается резко выраженный акроцианоз или генерализо ванный цианоз. У ребенка выявляются гипотермия, гипотония («поза лягуш ки»), гипорефлексия, гиподинамия, периферические отеки, артериальная ги потония, олигурия, вздутие живота. Со стороны сердечно сосудистой системы отмечается тахикардия, приглушенность сердечных тонов. Развивается легоч ная гипертензия, ведущая к функционированию фетальных шунтов. В связи с повышенной проницаемостью сосудов нарастают гиповолемия, сгущение кро ви, что может привести к ДВС синдрому.
Для оценки тяжести дыхательных расстройств при РДС используется шка ла Сильвермана (табл. 29).
|
|
Таблица 29 |
|
Шкала Сильвермана |
|
|
|
|
Стадия 0 |
Стадия I |
Стадия II |
|
|
|
Верхняя часть грудной |
Отсутствие синхронности |
Заметное опущение верхней |
клетки и передняя |
или минимальное опуще |
части грудной клетки при |
брюшная стенка синх |
ние верхней части груд |
подъеме передней брюшной |
ронно участвуют в |
ной клетки при подъеме |
стенки на вдохе |
акте дыхания |
передней брюшной стенки |
|
|
на вдохе |
|
Отсутствие втяжения |
Легкое втяжение межребе |
Заметное втяжение межребе |
межреберий на вдохе |
рий на вдохе |
рий на вдохе |
Отсутствие втяжения |
Легкое втяжение мечевид |
Заметное втяжение мечевид |
мечевидного отростка |
ного отростка грудины |
ного отростка грудины на |
грудины на вдохе |
на вдохе |
вдохе |
Отсутствие движения |
Опускание подбородка |
Опускание подбородка на |
подбородка при дыха |
на вдохе, рот закрыт |
вдохе, рот открыт |
нии |
|
|
Отсутствие шумов на |
Экспираторные шумы |
Экспираторные шумы («экс |
выдохе |
(«экспираторное хрюка |
пираторное хрюканье») |
|
нье») слышны при аускуль |
слышны при поднесении фо |
|
тации грудной клетки |
нендоскопа ко рту или без |
|
|
фонендоскопа |
|
|
|
257

Неонатология
Каждый симптом в графе «Стадия 0» оценивается в 0 баллов, «Стадия I» — в 1 балл, «Стадия II» — в 2 балла. Оценка в 10 баллов соответствует крайней тяжести РДС, 6–9 баллов — тяжелой степени, 5 баллов — средней тяжести, ниже 5 баллов — начинающийся РДС.
Наибольшая тяжесть состояния наблюдается у детей в первые 24–72 ч жиз ни. В результате грубых метаболических и гемодинамических нарушений у не доношенного ребенка (наиболее часто при массе тела менее 1500 г) в первые 30 ч жизни нередко развиваются кровоизлияния в боковые желудочки мозга — внутрижелудочковые кровоизлияния (ВЖК). На фоне РДС также могут воз никать и другие осложнения: некротизирующий энтероколит, острая почечная недостаточность, ДВС синдром; отек легких, легочное кровотечение, синдром утечки воздуха, осложнения, связанные с интубацией. При массивной кисло родотерапии, длительной ИВЛ возможно развитие бронхолегочной дисплазии, ретинопатии. Присоединение вторичной инфекции при РДС приводит к раз витию пневмонии у половины больных.
Диагностика. Пренатальная диагностика зрелости сурфактанта основана на том, что легочная жидкость плода из воздухоносных путей попадает в около плодные воды, и по их фосфолипидному составу можно судить о зрелости лег ких плода. Околоплодные воды можно получить при амниоцентезе, или соби рая вытекающие воды из родовых путей матери. Наиболее точный результат дает определение в околоплодных водах соотношения фракций фосфолипидов
— лецитина и сфингомиелина. Если соотношение лецитин/сфингомиелин (Л/С) более 2, то вероятность развития РДС — 2 %, то есть легкие зрелые. Если Л/С — 1–2, то риск РДС — 50 %, если Л/С менее 1 — риск РДС — 75 %. Загряз нение околоплодных вод кровью, меконием или творожистой смазкой затруд няет трактовку результатов. Исключением является трактовка теста при сахар ном диабете у матери и при отечной форме гемолитической болезни плода. При этих состояниях функциональной зрелости соответствует соотношение Л/С равное 3.
О степени зрелости легких плода и новорожденного можно судить по «пен ному тесту». В стеклянную пробирку помещают 0,5 мл околоплодных вод или содержимого желудка новорожденного, полученного в первый час жизни. В про бирку добавляют 0,5 мл 95% го этилового спирта. Смесь встряхивают в тече ние 15 с, а через 15 мин оценивают результат. Тест положителен (вероятность развития РДС 4 %), если на поверхности одиночное (+++) или двойное (++++) кольцо пузырьков. Тест отрицателен (вероятность РДС 60 %), если пузырьков нет (–). Тест слабоположителен (вероятность РДС 20 %), если имеются еди ничные пузырьки, заполняющие 1/3 окружности (++) и менее (+).
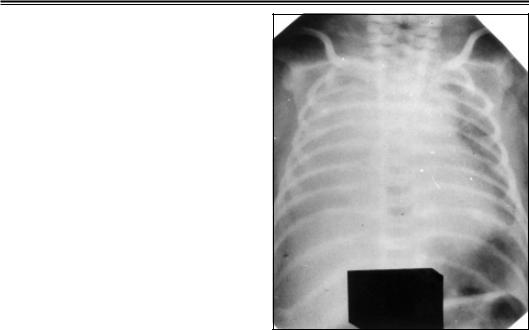
Рентгенологическая картина РДС зависит от стадии заболевания: при начи нающемся РДС определяется нодозно ретикулярный рисунок легких, затем на фоне пониженной пневматизации легких выявляются воздушные бронхограм мы, в терминальную фазу— «белые легкие» (рис. 27).
При изучении газового состава крови и КОС определяются гипоксемия, ги перкапния, декомпенсированный ацидоз смешанного характера. Гематокрит превышает норму, гиперкоагуляция сменяется гипокоагуляцией.
Лечение. Основная задача терапии РДС заключается в поддержке жизненно важных функций организма ребенка и профилактике осложнений до того мо
258
Раздел ІV. Патология неонатального периода
мента, как он сможет самостоятельно |
|
обеспечивать дыхание. |
|
Уход направлен на создание опти |
|
мальных температурных условий с мо |
|
мента рождения на протяжении всего |
|
периода лечения. Необходимо контро |
|
лировать температуру тела каждые 1 — |
|
2 час. Важно предупреждать неощути |
|
мые потери воды при использовании |
|
источников лучистого тепла. Для вы |
|
хаживания детей с РДС предпочти |
|
тельнее использовать кювезы. Осмот |
|
ры и манипуляции должны быть ко |
|
роткими и щадящими. При спонтан |
|
ном дыхании необходимо укладывать |
|
ребенка со слегка запрокинутой голо |
|
вой для улучшения проходимости ды |
|
хательных путей. Для этого же следу |
|
ет отсасывать жидкое содержимое ды |
|
хательных путей. Периодически необ |
|
ходимо менять положение ребенка. |
Рис. 27. Рентгенограмма органов груд |
Энтеральное питание через орогас |
|
тральный зонд можно попытаться на |
ной клетки новорожденного ребенка 1 го |
чать через 24–48 ч после рождения при |
дня жизни с РДС тяжелой степени. Белые |
условии стабильной сердечной дея |
легкие |
тельности. Если кормить новорожден ного через соску при частоте дыхания более 70 в 1 мин, создается высокий риск
аспирации. При невозможности осуществлять энтеральное кормление ребенка необходимо начать парентеральное питание. Для предотвращения гипоглике мии уже через 1 ч после рождения новорожденному начинают внутривенное введение раствора глюкозы под контролем её уровня в сыворотке крови (2,6– 5,5 ммоль/л).
Парентеральное введение жидкости в первые сутки жизни осуществляют в объеме 60 мл/кг, в последующие дни объем инфузии увеличивается на 20 мл/кг ежедневно (при достаточном диурезе). Растворы электролитов назначают со вторых суток жизни. Растворы аминокислот можно использовать со вторых– третьих суток жизни, парентеральные растворы липидов начинают вводить на день позже. Обосновано парентеральное введение витамина А 2000 ЕД через день для уменьшения риска хронической бронхолегочной дисплазии.
Для поддержки сердечной деятельности используется дофамин, начиная с дозы 5 мкг/(кг·мин). При этом необходимо контролировать артериальное давление у новорожденного. При появлении у ребенка признаков отека легких, либо при раз витии острой почечной недостаточности показано назначение фуросемида.
В связи с невозможностью достоверно исключить наличие врожденной пнев монии, а также с высоким риском присоединения инфекции всем детям с РДС рекомендуется назначать антибиотики: цефалоспорины 1–2 го поколения в со четании с аминогликозидами.
259

Неонатология
Введение экзогенного сурфактанта используется с 1980 г. У глубоконедоно шенных детей (масса тела менее 1350 г) и детей с незрелостью легких (Л/С ме нее 2, отрицательный пенный тест) применение экзогенных сурфактантов дает хороший эффект в профилактике и лечении РДС. С целью профилактики эк зогенный сурфактант следует вводить эндотрахеально в первые 2 ч жизни с пос ледующей ветиляцией легких. С лечебной целью эти препараты вводятся но ворожденным с клиническими и рентгенологическими признаками РДС, нахо дящимися на аппаратной ИВЛ через интубационную трубку трижды с интер валом 6–8 ч в возрасте 2–48 ч.
Препараты экзогенного сурфактанта могут быть природного происхождения, их экстрагируют из легких животных (коров, телят, поросят): Surventa (Abbot Labopatories), Alveofact (Boehringer). Некоторые экзогенные сурфактанты син тезируют искусственно (частично или полностью): Exsosurf Neonatal (Burroughs Wellcome Company), Pneumactant (Britannia Pharmaceuticals).
В зависимости от тяжести состояния проводится респираторная терапия в виде кислородотерапии, спонтанного дыхания под постоянным положительным давлением, ИВЛ.
При проведении кислородотерапии необходимо мониторировать газовый состав крови и КОС на газоанализаторах и/или осуществлять чрескожный кон троль газов крови и насыщение гемоглобина кислородом (сатурация — SаO2 — в норме 90–92 %). Нормальные показатели в артериальной крови: рН 7,35–7,45, РО2 — 55–65 мм рт. ст., РСО2 — 35–45 мм рт. ст. (при вдыхании комнатного воз духа); в капиллярной крови: рН 7,30–7,35, РО2 — 40–60 мм рт. ст., РСО2 — 40– 45 мм рт. ст.; в венозной крови: рН 7,25–7,30, РО2 — 30–45 мм рт. ст., РСО2 — 45–50 мм рт. ст.
Недоношенным детям массой тела более 1500 г до развития проявлений РДС или при начальных его симптомах при отсутствии апноэ осуществляется до полнительная подача кислорода с помощью маски, кислородной палатки или в кювез.
Показание к использованию СДППД — падение РО2 с 60 до 50 мм рт. ст. при дыхании 60 % кислорода. Наиболее часто при СДППД используют положитель ное давление на выдохе 2–4 см вод. ст., но при РДС целесообразно применять более высокое давление на выдохе — 6–10 см вод. ст. Для СДППД используют поток воздушно кислородной смеси 4–5 л/мин. Начальная концентрация кис лорода составляет 60 % (FiO2 — 0,6). Постоянное положительное давление в дыхательных путях создается с помощью носовых канюль или аппаратами ИВЛ через интубационную трубку в режиме СРАР (continuous positive airway pressure). Новорожденного, которому проводится СДППД не через интубаци онную трубку, а другим способом, не следует кормить энтерально. Эти методы респираторной терапии не применяют при наличии заболеваний желудочно кишечного тракта, повышенной нервно рефлекторной возбудимости, при тяже лом поражении ЦНС, у новорожденных с очень низкой массой тела.
Проводится ИВЛ при прогрессировании дыхательной недостаточности у де тей с РДС, неэффективности СДППД, у глубоконедоношенных детей, при вы раженных нарушениях частоты и ритма дыхания (тахипноэ, брадипноэ или ап ноэ). Формальными лабораторными критериями для начала ИВЛ служат: рН артериальной крови 7,20, РО2 ниже 50 мм рт. ст. и РСО2 выше 60 мм рт. ст. при
260

Раздел ІV. Патология неонатального периода
дыхании 100% м кислородом. Необходимо учитывать, что лабораторные пока затели имеют второстепенное значение по сравнению с клиническими крите риями. Важно начать ИВЛ до того, как состояние больного ухудшится крити чески.
Чаще используют следующие начальные параметры ИВЛ: FiO2 — 0,5–0,6; поток — 5–6 л/мин; продолжительность вдоха — 0,4–0,6 с; продолжительность выдоха — 0,6–0,8 с; соотношение продолжительности вдоха и выдоха — 1:1,5 или 1:1; частота дыхания — 40–60 в 1 мин; давление на вдохе — 20–25 см вод. ст.; давление на выдохе — 2–4 см вод. ст.
После подключения ребенка к аппарату ИВЛ необходимо добиться удовлет ворительной экскурсии грудной клетки и синхронизации дыхания ребенка с работой респиратора. Если экскурсия грудной клетки недостаточная, через каж дые несколько вдохов увеличивают давление на вдохе на 1–2 см вод. ст. до тех пор, пока она станет удовлетворительной и над всей поверхностью грудной клет ки будет удовлетворительно выслушиваться дыхание. При чрезмерной экскур сии грудной клетки давление на вдохе постепенно уменьшают. Если сохраня ется цианоз или SаO2 менее 90 %, можно ежеминутно увеличивать FiO2 на 5– 10 %, пока ребенок порозовеет и SаO2 окажется в пределах 91–96 %. Превыше ние SаO2 более 96 % требует постепенного снижения FiO2 на 5 % за один шаг, пока показатель снизится до 91–96 %. При отсутствии синхронизации дыха ния ребенка с аппаратом необходимо ввести пациенту ГОМК и реланиум. При неэффективности указанных препаратов переходят к введению морфина или промедола, в особо сложных случаях используются миорелаксанты (тракриум, ардуан). Дальнейшую оптимизацию параметров ИВЛ проводят, исходя из ре зультатов анализа газового состава крови и сатурации кислорода. Приемлемые показатели при ИВЛ: РО2 — 50–80 мм рт. ст.; SаO2 — 91–96 %; РСО2 — 35– 48 мм рт. ст.
Переход от ИВЛ к самостоятельному дыханию должен осуществляться по этапно: ИВЛ — вспомогательная ИВЛ — СДППД — экстубация — СДППД — кислородотерапия.
К новым методам респираторной терапии, требующим специального доро гостоящего оборудования, относятся экстракорпоральная оксигенация крови и экстракорпоральная элиминация углекислоты. Эти методы применяются при тяжелых повреждениях легочной паренхимы и большом право левом шунте, позволяют проводить оксигенацию крови вне организма и дают возможность легким «отдохнуть», ликвидируя гипоксемию, гиперкапнию, нормализуя жиз недеятельность всех органов и систем.
Профилактика. Возникновение родовой деятельности у беременной женщи ны в сроке гестации 28–34 нед при сохраненном плодном пузыре и отсутствии признаков отслойки плаценты требует назначения токолитиков, и проведения профилактики РДС.
Беременной женщине назначают глюкокортикоиды. Механизм действия глю кокортикоидов, введенных беременной, обусловлен их взаимодействием со спе цифическими рецепторами альвеолоцитов II типа и индукцией ферментной системы синтеза сурфактанта. Глюкокортикоиды усиливают выделение депо нированного сурфактанта из альвеолоцитов II типа на поверхность альвеол пло да. Эффект развивается не сразу после введения, а через 24–48 ч. Поэтому глю
261
