
- •3 Конспекты лекций по физике (молекулярная физика и термодинамика) Основы Молекулярной физики и термодинамики Статистический и термодинамический методы исследования
- •Основные положения молекулярно-кинетической теории – мкт
- •Силы межмолекулярного взаимодействия
- •О собенности строения твердых, жидких и газообразных веществ
- •Основные понятия молекулярной физики
- •Мкт идеального газа
- •Уравнение состояния идеального газа (уравнение Менделеева –Клапейрона)
- •Основное уравнение мкт газов
- •Внутренняя энергия идеального газа
- •Первое начало термодинамики
- •Адиабатный процесс
- •Теплоемкость
- •Теплоемкости газов. Уравнение Майера
- •Изохорный процесс
- •Изобарный процесс
- •Второе начало термодинамики Термодинамическое равновесие. Квазистатические состояния
- •Обратимые и необратимые процессы
- •Цикл Карно
- •Второе начало термодинамики
- •Понятие энтропии
Адиабатный процесс
Адиабатным называется процесс,
протекающий без теплообмена с окружающей
средой, то есть при
![]() .
.
Осуществление такого процесса возможно в двух случаях:
В теплоизолированной системе;
Быстро во времени, чтобы система не успела обменяться теплом с окружающей средой
Математическая запись адиабатического (адиабатного) процесса:
![]()
Здесь γ – коэффициент Пуассона.
Первое начало термодинамики для
адиабатического процесса записывается,
исходя из того, что
.
Тогда
![]() и, следовательно:
и, следовательно:
![]() ,
,
Отсюда следует, что работа газа при его
расширении совершается за счет запасов
внутренней энергии. Внутренняя энергия
при этом уменьшается, значит, газ
охлаждается. Если работа отрицательна,
то есть газ сжали внешние силы, то
![]() :
при адиабатическом сжатии внутренняя
энергия увеличивается и газ нагревается.
:
при адиабатическом сжатии внутренняя
энергия увеличивается и газ нагревается.
Теплоемкость
Способность тела поглощать тепло при нагревании характеризуется теплоемкостью.
Теплоемкость тела
![]() - количество теплоты, необходимое для
нагревания данного количества вещества
на 1K (или выделяемое при
охлаждении на 1 K).
- количество теплоты, необходимое для
нагревания данного количества вещества
на 1K (или выделяемое при
охлаждении на 1 K).
Чаще используют удельную теплоемкость вещества:
![]()
Удельная теплоемкость вещества c - количество теплоты, необходимое для нагревания на 1K 1 кг вещества. Поскольку 1 K=1˚C, то справедливо также:
![]()
Молярная теплоемкость вещества C - количество теплоты, необходимое для нагревания на 1K 1 моля вещества:
![]()
где - число молей вещества.
Единицы измерения теплоемкостей:
![]() ;
;
![]() ;
;
![]() .
.
Очевидно, что количество теплоты, поглощенное телом при нагревании или выделенное при охлаждении, равно:
![]() (или
(или
![]() )
)
Здесь
![]() .
.
Установим связь между удельной c и молярной C теплоемкостями:
![]()
Значит,
![]()
Теплоемкости газов. Уравнение Майера
Основываясь на первом начале термодинамики, получим значения теплоемкости газов для изохорного и изобарного процессов. Молярная теплоемкость: . Получим выражение для теплоемкостей газа, подставляя в числитель формулы соответствующее выражение для Q из первого начала термодинамики.
Изохорный процесс
Учитывая, что в этом случае
![]() ,
где
,
где
![]() ,
для теплоемкости запишем
,
для теплоемкости запишем
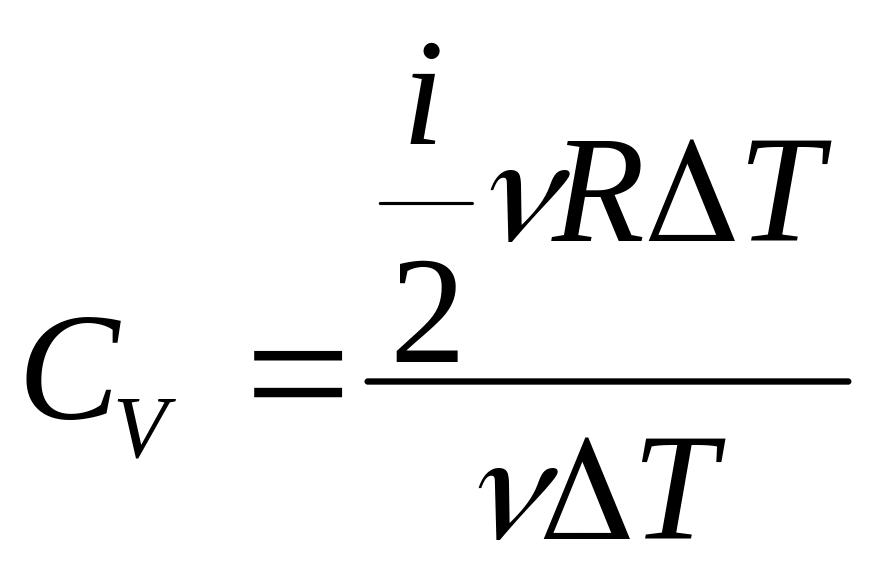 или после сокращений:
или после сокращений:
![]() - молярная теплоемкость газа
при постоянном объеме.
- молярная теплоемкость газа
при постоянном объеме.
1-атомный газ (аргон, неон, криптон) |
|
12,5 Дж/моль·К |
2-атомный газ (водород, кислород, азот) |
|
20,8 Дж/моль·К |
3-атомный газ (водяной пар) |
|
25,0 Дж/моль·К |
Изобарный процесс
В этом случае
.
Здесь , как всегда,
.
Работа при изобарном процессе
![]() .
.
Из уравнения Менделеева –
Клапейрона
![]()
Тогда
![]()
и
 ,
то есть
,
то есть
![]() - молярная теплоемкость газа при
постоянном давлении
- молярная теплоемкость газа при
постоянном давлении
Итак,
и
![]() .
Очевидно, что
.
Очевидно, что
![]() :
:
при постоянном давлении требуется больше тепла для того, чтобы повысить температуру моля газа на 1 К, чем при постоянном объеме. Это понятно, так как при постоянном объеме все подводимое тепло идет на нагрев, поскольку работа не совершается (газ не расширяется и не сжимается). При постоянном давлении лишь часть подводимого тепла расходуется на нагрев, а другая часть – на совершение работы.
Какова разность
![]() и
и
![]() ?
?
![]()
Таким образом,
![]() - уравнение Майера для молекулярных
теплоемкостей газов.
- уравнение Майера для молекулярных
теплоемкостей газов.
Очевидно, что
![]() .
.
Отношение молярных теплоемкостей
называют коэффициентом
Пуассона:
![]() .
.
Коэффициент Пуассона – показатель адиабаты .
Значение γ определяется числом степеней свободы молекул газа.
1-атомный:

2-атомный:
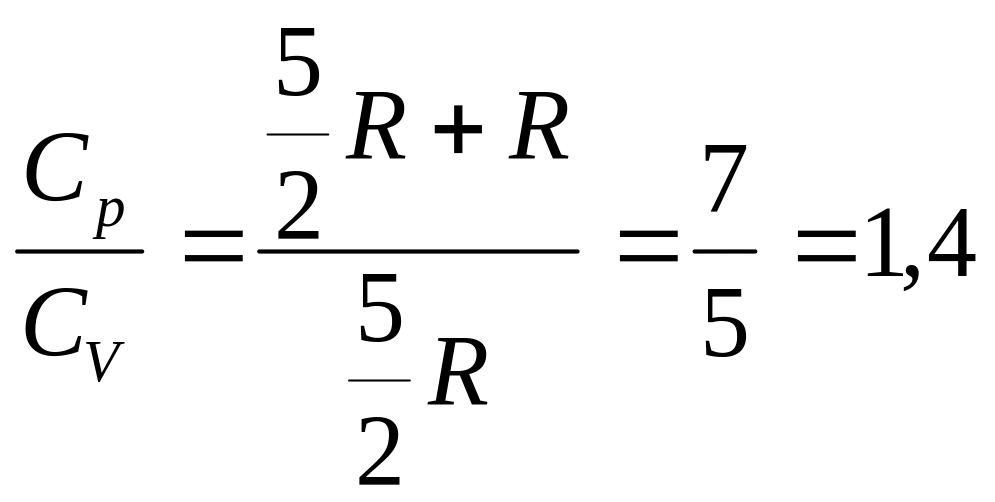
3-атомный:

Для воздуха, который представляет собой смесь газов, в которой 80% азота N2 и почти 20% кислорода O2 , γ=1,4.
