
- •3 Конспекты лекций по физике (молекулярная физика и термодинамика) Основы Молекулярной физики и термодинамики Статистический и термодинамический методы исследования
- •Основные положения молекулярно-кинетической теории – мкт
- •Силы межмолекулярного взаимодействия
- •О собенности строения твердых, жидких и газообразных веществ
- •Основные понятия молекулярной физики
- •Мкт идеального газа
- •Уравнение состояния идеального газа (уравнение Менделеева –Клапейрона)
- •Основное уравнение мкт газов
- •Внутренняя энергия идеального газа
- •Первое начало термодинамики
- •Адиабатный процесс
- •Теплоемкость
- •Теплоемкости газов. Уравнение Майера
- •Изохорный процесс
- •Изобарный процесс
- •Второе начало термодинамики Термодинамическое равновесие. Квазистатические состояния
- •Обратимые и необратимые процессы
- •Цикл Карно
- •Второе начало термодинамики
- •Понятие энтропии
Основные понятия молекулярной физики
Массы молекул, выраженные в обычных единицах массы (кг) чрезвычайно малы, поэтому используют относительные величины. Относительная масса молекулы:
![]()
Здесь
![]() - масса молекулы вещества в кг,
- масса молекулы вещества в кг,
![]() - атомная
единица массы,
- атомная
единица массы,
где
![]() - масса атома углерода С.
- масса атома углерода С.
![]()
Так как в ядре атома углерода 12 нуклонов (протоны и нейтроны), 1 a.e..m. примерно равна массе нуклона.
Помимо массы в молекулярной физике используется понятие количества вещества
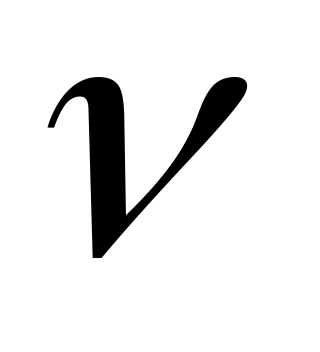 (ню) – число молекул (атомов) в веществе.
(ню) – число молекул (атомов) в веществе.
![]() =моль
– размерность в СИ
=моль
– размерность в СИ
Моль
- единица количества вещества такая,
что в одном моле различных веществ
содержится число
Авогадро молекул:
![]() .
.
Используется понятие молярной массы
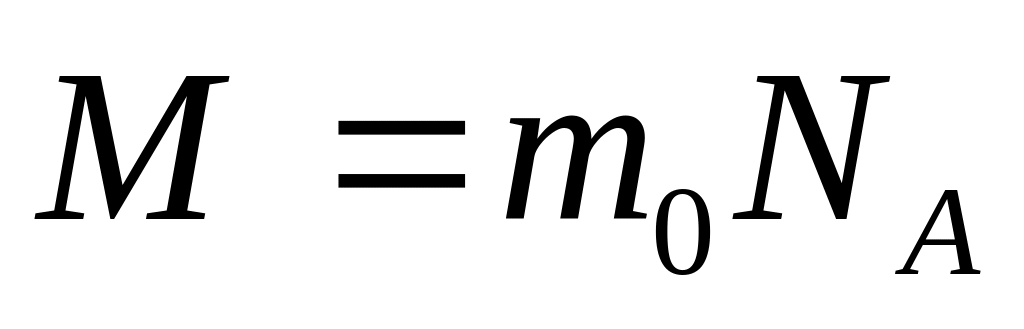
Размерность молярной
массы:
![]() =кг/моль
=кг/моль
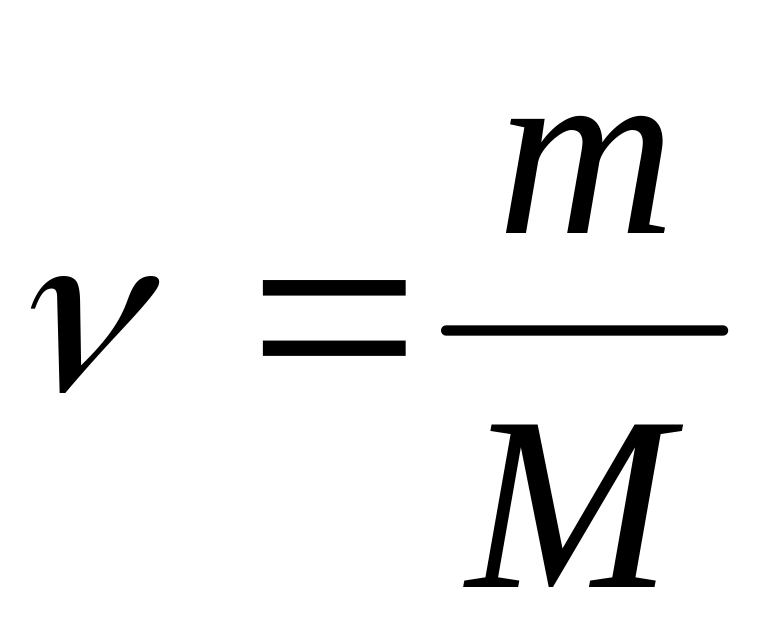 - число молей
вещества –
связывает массу вещества m
с его молярной массой M
- число молей
вещества –
связывает массу вещества m
с его молярной массой M
Мкт идеального газа
В МКТ пользуются идеализированной моделью газа. Идеальный газ – совокупность невзаимодействующих материальных точек, обладающих только кинетической энергией.
Идеальный газ – это газ, в котором:
собственный объем молекул пренебрежимо мал по сравнению с объемом сосуда;
между молекулами отсутствуют силы взаимодействия;
столкновения молекул между собой и со стенками абсолютно упругие (то есть, происходят без потерь кинетической энергии на пластическую деформацию).
Порядок диаметра молекул – 10-10
м (1
![]() - ангстрем)
- ангстрем)
Молекулы имеют массу порядка 10-26 кг.
Масса, например, молекулы кислорода
![]()
Реальные газы в условиях, близких к
нормальным (![]() ),
а также при низких давлениях и высоких
температурах близки по своим свойствам
к идеальному газу (кислород, гелий).
),
а также при низких давлениях и высоких
температурах близки по своим свойствам
к идеальному газу (кислород, гелий).
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях (температура 0˚C и давление 105 Па) этот объем V=22,4 • 10-3 м3/моль.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений p1, p2, …, рп входящих в нее газов:
![]()
Парциальное давление — давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
Уравнение состояния идеального газа (уравнение Менделеева –Клапейрона)
Состояние некоторой массы газа определяется тремя параметрами, между которыми существует определенная связь, называемая уравнением состояния идеального газа:
![]()
- уравнение Менделеева – Клапейрона.
Здесь
![]() - универсальная газовая постоянная;
- универсальная газовая постоянная;
![]() -количество
вещества (число молей вещества)
-количество
вещества (число молей вещества)
Если m=const и M=const (не меняется масса газа и его состав) можно записать:
![]()
- уравнение Клапейрона, где B – некоторая константа, разная для разных газов.
Основное уравнение мкт газов
Основное уравнение МКТ идеальных газов выводится, исходя из того, что давление газа на стенку является результатом ударов молекул, хаотично движущихся в трехмерном пространстве:
![]()
- уравнение Клаузиуса. Здесь
![]() - концентрация молекул: число молекул
в единице объема.
- концентрация молекул: число молекул
в единице объема.
![]() - средняя кинетическая энергия молекул,
масса которых
.
- средняя кинетическая энергия молекул,
масса которых
.
Из уравнения Менделеева – Клапейрона
для одного моля (то есть
![]() )
можно записать
)
можно записать
![]() .
Подставив полученное выражение для p
в уравнение Клаузиуса, для средней
кинетической энергии молекул газа
получим:
.
Подставив полученное выражение для p
в уравнение Клаузиуса, для средней
кинетической энергии молекул газа
получим:
![]() .
.
Учитывая, что
![]() , имеем
, имеем
![]() .
Здесь
.
Здесь
![]() -
постоянная Больцмана:
-
постоянная Больцмана:
![]()
В итоге можно записать уравнение Больцмана:
![]()
![]()
из которого следует, что абсолютная температура T есть мера средней кинетической энергии поступательного движения молекул.
Очевидно, что средняя скорость молекул связана с абсолютной температурой газа соотношением:
![]()
Подстановкой выражения для
![]() из уравнения Больцмана в уравнение
Клаузиуса (
из уравнения Больцмана в уравнение
Клаузиуса (![]() )
получим еще один вариант записи основного
уравнения МКТ идеального газа:
)
получим еще один вариант записи основного
уравнения МКТ идеального газа:
![]()
Из уравнения очевидно, что при заданных
P и T
концентрации любых газов одинаковы.
При нормальных условиях для любого газа
концентрация молекул равна числу
Лошмидта:
![]() .
.
