
- •Робоча програма розділу
- •Опорний конспект №41 Властивості колоїдних систем
- •Електрофорез
- •Електроосмос
- •Завдання для срс №32. Молекулярно-кінетичні властивості колоїдних систем. Електро- кінетичні властивості колоїдних розчинів. Оптичні властивості колоїдних систем.
- •Лабораторна робота №26
- •Хід роботи
- •Лабораторна робота №27
- •Хід роботи
- •Лабораторна робота №28
- •Хід роботи
- •Лабораторна робота №29
- •Хід роботи
- •Практична робота №22
- •Хід роботи
- •Розв’язання
- •Розв’язання
- •І. Дайте відповіді на тести
- •Іі. Розв’яжіть задачі
- •Опорний конспект Будова міцел золів. Коагуляція та пептизація
- •Практична робота №23
- •Хід роботи
- •Розв’язання
- •І. Дайте відповіді на тести
- •Іі. Розв’яжіть задачі
- •Лабораторна робота №26
- •Хід роботи
- •Лабораторна робота №29
- •Хід роботи
- •Лабораторна робота №28
- •Хід роботи
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ДОНЕЦЬКИЙ ДЕРЖАВНИЙ ТЕХНІКУМ ЕКОНОМІКИ І ХІМІЧНИХ ТЕХНОЛОГІЙ
Методична розробка
на тему «Колоїдна хімія. Ультрамікрогетерогенні системи низькомолекулярних речовин»
з дисципліни «Фізична та колоїдна хімія»
для студентів денного відділення спеціальності 5.04010101 «Аналітичний контроль якості хімічних сполук»
Розглянуто та схвалено на засіданні Укладено викладачем
циклової комісії Бойків Н.Ю.
спеціальних хімічних дисциплін
Протокол № _____ від «___»_____2015 р.
Голова циклової комісії
___________________ О.О. Пісцова
2015
Укладач – Бойків Н. Ю., викладач Донецького державного технікуму економіки і хімічних технологій, спеціаліст вищої кваліфікаційної категорії, кандидат біологічних наук
Рецензент - Полінкіна Л.М., викладач хімії ДВНЗ «Донецький державний коледж харчових технологій і торгівлі», спеціаліст вищої категорії
Надано матеріали для опрацювання студентами денного відділення розділу «Колоїдна хімія». Для студентів та викладачів ВНЗ І-ІІ рівнів акредитації.
Зміст
Стор.
Вступ……………………………………………………………………………………………...4
Робоча програма розділу………………………………………………………………………...5
Лекція №36. Колоїдна хімія – фізхімія дисперсних систем. Методи отримання та очищення колоїдних розчинів. Властивості колоїдних розчинів…………………………6-13
Завдання для СРС №32. Молекулярно-кінетичні властивості колоїдних систем. Електро- кінетичні властивості колоїдних розчинів. Оптичні властивості колоїдних систем…...14-16
Лабораторна робота №26. Діаліз розчину желатини………………………………………...17
Лабораторна робота №27. Визначення знаку заряду часток у барвників…………………..17
Лабораторна робота №28. Капілярний аналіз з позитивно зарядженого паперу……….17-18
Лабораторна робота №29. Визначення ізоелектричної точки казеїну ………………….18-19
Практична робота №22. Розрахунок параметрів дисперсних систем…………………..19-23
Лекція №37. Будова міцел золів. Коагуляція та пептизація……………………………..24-26
Практична робота №23. Визначення будови міцел золів………………………………..27-30
Лабораторна робота №30. Отримання мікрогетерогенних систем……………………...30-31
Лабораторна робота №31. Визначення порогу коагуляції золю гідроксиду заліза…….31-32
Лабораторна робота №32. Зворотна та незворотна коагуляція яєчного альбуміну……….32
Вступ
При вивченні дисципліни «Фізична та колоїдна хімія» розділ «Колоїдна хімія» займає важливе місце в системі підготовки молодших спеціалістів зі спеціальності 5.04010101 «Аналітичний контроль якості хімічних сполук».
При вивченні розділу перщ за все треба зрозуміти предмет та задачі вивчення колоїдної хімії. Колоїдна хімія – це наука про властивості гетерогенних високодисперсних систем та процесів, що протікають в них. Дисперсні системи класифікують за двома ознаками: за ступенем дисперсності та за агрегатним станом.
Уясніть, що основними властивостями колоїдних систем є гетерогенність, висока дисперсність (розмір часток складає 10-7 –10-9 м), а також наявність надмірної енергії, що свідчить про термодинамічну нестійкість.
Приступаючи до вивчення методів отримання колоїдних систем, засвойте, що за розміром часток золі займають проміжне положення між справжніми розчинами та грубодисперсними системами. Тому всі методи отримання колоїдних систем можна поділити на дві групи:
1 – методи диспергування (дроблення) грубодисперсних систем до колоїдного ступеню дисперсності;
2 – методи конденсації (з’єднання) молекул, атомів чи іонів у колоїдні частки.
Принципова різниця між ними є в тому, що в процесі диспергування збільшення питомої поверхні проходить за рахунок надання енергії ззовні, а в процесі конденсації – за рахунок зменшення потенціальної енергії самої системи. Тобто, конденсаційний метод енергетично більш вигідні.
Зверніть увагу на молекулярно-кінетичні, оптичні та електрокінетичні властивості колоїдних систем, так як знання цих властивостей дозволить засвоїти міцелярну теорію будови колоїдних часток, фактори стійкості колоїдних систем, теорію коагуляції.
Серед молекулярно-кінетичних властивостей особливу увагу зверніть на дифузію, осмотичний тиск, зсув. Майте на увазі, що якісної різниці між молекулярно-кінетичними властивостями колоїдних та справжніх розчинів немає, а є тільки кількісні. Вони пов’язані з тим, що частки дисперсної фази колоїдних розчинів значно перевищують розміри часток справжніх розчинів.
Оптичні властивості колоїдних розчинів суттєво відрізняються від властивостей справжніх розчинів і є їх характерною ознакою, оскільки ці властивості є функцією ступеню дисперсності часток, що утворюють систему. Слід зрозуміти, що при падіння променя світла на дисперсну систему спостерігаються наступні явища: 1 - проходження світла через систему; 2 – переломлення та відображення світла частками дисперсної фази; 3 – розсіяння та абсорбція світла.
Серед електрокінетичний властивостей найважливіші – виникнення - потенціалу, електрофорез та електроосмос.
Закріплюються теоретичні знання на практичних і лабораторних роботах.
Робоча програма розділу
№ |
Назва розділу (модуля), теми (змістові модулі) |
Кількість годин |
Навчально-методична література |
Засоби діагностіки |
|||||||||
всього |
у тому числі: |
||||||||||||
лек. |
практ. |
лаб. |
пр.інд. |
срс |
|
|
|||||||
1 |
Тема 2.1. Ультрамікрогетеро-генні системи низькомолекулярних речовин |
38 |
4 |
6 |
22 |
|
2 |
|
|
||||
2 |
1. Колоїдна хімія – фізхімія дисперсних систем. Методи отримання та очищення колоїдних розчинів. Властивості колоїдних розчинів. |
8 |
2 |
|
|
|
1 |
1.1. С.257-290, 1.5.С.307-320, 325-376 |
Тестування |
||||
3 |
2. Діаліз розчину желатини. |
2 |
|
|
2 |
|
|
1.4. С. 96 |
Залік за результатами виконання роботи |
||||
4 |
3. Визначення знаку заряду часток у барвників. |
4 |
|
|
4 |
|
|
1.4. С. 98 |
Залік за результатами виконання роботи |
||||
5 |
4. Капілярний аналіз з позитивно зарядженого паперу. |
4 |
|
|
4 |
|
|
1.4. С. 101 |
Залік за результатами виконання роботи |
||||
6 |
5. Визначення ізоелектричної точки казеїну |
2 |
|
|
2 |
|
|
1.4. С. 108 |
Залік за результатами виконання роботи |
||||
7 |
6. Розрахунок параметрів дисперсних систем. |
2 |
|
2 |
|
|
|
1.2.С.165-167, 170-171 |
Розв’язання задач за індивідуальними завданнями |
||||
8 |
7. Будова міцел золів. Коагуляція та пептизація. |
2 |
2 |
|
|
|
|
1.1. С.292-297, 1.5.С.381,387-394 |
Тестування |
||||
9 |
8. Визначення будови міцел золів. |
4 |
|
4 |
|
|
|
1.2. С.165-171 |
Розв’язання задач за індивідуальними завданнями |
||||
10 |
9. Отримання мікрогетерогенних систем. |
2 |
|
|
2 |
|
|
1.4. С. 111 |
Залік за результатами виконання роботи |
||||
11 |
10. Визначення порогу коагуляції золю гідроксиду заліза. |
4 |
|
|
4 |
|
|
1.4. С. 114 |
Залік за результатами виконання роботи |
||||
12 |
11. Зворотна та незворотна коагуляція яєчного альбуміну |
4 |
|
|
4 |
|
|
1.4. С. 116 |
Залік за результатами виконання роботи |
||||
Лекція №36
Тема: Колоїдна хімія – фізхімія дисперсних систем. Методи отримання та очищення колоїдних розчинів. Властивості колоїдних розчинів.
План
Становлення колоїдної хімії, як науки
Предмет колоїдної хімії
Поняття про дисперсні системи
Класифікація дисперсних систем
Методи отримання дисперсних систем
Очистка дисперсних систем
Властивості колоїдних систем:
Предмет, що ми вивчаємо, має назву «Фізична та колоїдна хімія». Але досі ми розглядали розділ, який має назву «Фізична хімія». Сьогодні ми приступаємо до вивчення другого розділу курсу – «Колоїдна хімія».
Деякі явища, пов’язані з колоїдним станом речовини, відомі вже давно. Ще у 1751 році М. В. Ломоносов в першій частині свого твору “Опыт в физической химии” писав: «Свертыванием называется перевод жидкости легкоподвижной в густую и густой жидкости в мягкое твердое тело, произведенный без заметного выпаривания. Пример мы видим в сваренных яйцах и свернувшемся молоке».
Далі, у 1789 році російським хіміком Товієм Єгоровичем (Іоганом Тобіасом) Ловіцем (1757 – 1804), академіком Петербурзької Академії Наук, який народився в Геттінгені, а потім прибув до Росії з батьком, астрономом Г. М. Ловіцем, було відкрито явище адсорбції з розчинів, їм же були вивчені поглинаючі властивості вугілля.
У 1797 році академік Аполос Аполосович Мусін – Пушкін (1760 – 1805), російський хімік та мінеаролог, почесний член Петербурзької Академії Наук, вперше отримав золь металевої ртуті та описав його.
Великий внесок у вивчення властивостей колоїдних систем зробив Федор Федорович (Фердинанд Фрідріх) Рейс (1778 – 1852) - член - кореспондент Петербурзької АН, який народився в Тюбінгені, до 1803 року працював у Геттінгенському університеті, а з 1804 року – у Московському університеті. У 1808 –1809 роках, вивчаючи дію електричного струму на частки, зважені в воді, відкрив явище, яке зараз має назву електрофорез.
В середині Х1Х сторіччя при вивченні явищ розчинності англійський хімік, член Лондонського королівського товариства Томас Грем (1805 – 1869) звернув увагу на те, що деякі речовини, нерозчинені у воді в звичайному змісті цього слова, можуть все ж в певних умовах утворювати досить однорідні за зовнішнім виглядом розчини. Такі розчини за багатьма якостями суттєво відрізняються від звичайних розчинів. Так, зокрема, розчинені речовини в цих розчинах не проходять крізь перетинки з напівпроникних матеріалів (пергамент, целофан, колодій), крізь які легко проходять розчинник та розчинені речовини у звичайних розчинах. Дослідження цих явищ первісно привело до висновку, що речовини, що проходять через подібні перетинки, володіють здібністю кристалізуватись з даного розчина, тоді як речовини, що затримуються ними, не здібні кристалізуватись. Перші речовини, за пропозицією Грема, було названо кристалоїдами, а останні – колоїдами (від грецького слова “колла” – клей). Перші утворюють при розчиненні звичайні, або справжні розчини, останні – колоїдні розчини. Саме Грем запропонував назву колоїдна хімія.
Подальший розвиток науки показав умовність цього поділення, тому що одні і ті самі речовини можуть існувати як у вигляді колоїду, так і в вигляді кристалоїду. Так, наприклад, хлорид натрію у воді утворює кристалоїд, а в бензолі – колоїд, а мило утворює у воді колоїд, а у спирті – кристалоїд. Вперше до такого висновку прийшов у 1904 – 1914 роках російський вчений Петро Петрович Веймарн (1879 – 1935) – російський фізико-хімік, який емігрував до Японії під час громадянської війни, де займався вивчення властивостей шовку. Тому, говорячи про колоїди, сьогодні мають на увазі не певний клас речовин, а стан речовини. Колоїдними властивостями володіють речовини в тому випадку, коли їх частки мають розмір 10-10 – 10-5 м. Вивченням цих систем займається така галузь хімії, як колоїдна хімія.
КОЛОЇДНА ХІМІЯ – це фізико-хімія дисперсних гетерогенних систем та поверхневих явищ, що спостерігаються на межі розділу фаз в таких системах. До недавнього часу вона була розділом фізичної хімії, однак зараз виділена в окрему галузь. Великий внесок в розвиток колоїдної хімії зробили такі вчені, як український вчений Антон Володимирович Думанський (1880-1967), який закінчив Київський політехнічний інститут, а у 1904 році організував у Києві першу в Росії лабораторію колоїдної хімії та почав випускати “Колоїдний журнал”; Микола Петрович Пєсков (1880 – 1940), який закінчив університет в Бреслау, навчався в Москві, Мюнхені, Лейпцигу, та встановив будову колоїдних часток; Лев Гаврилович Гурвич (1871 – 1926), який народився в Полтаві, закінчив Київський та Базельський університети, вивчав нафтохімію та встановив роль поверхневих явищ в дисперсних системах), Борис Володимирович Дерягін (1902- 1990), професор МГУ, який розвив теорію стійкості, стабілізації та коагуляції колоїдних часток, та інші вчені.
Велика цікавість до колоїдних систем пов’язана з їх широким розповсюдженням. При вивченні колоїдної хімії вірніше говорити про вивчення дисперсних систем, тому що колоїдні системи – приватний випадок дисперсних систем.
З дисперсними системами часто доводиться мати справу на практиці. Вони надзвичайно різноманітні і мають широке розповсюдження. До них належать, з одного боку, природні продукти: молоко, кров, білки, крохмаль, натуральний каучук, більша частина тканин живих організмів, а також такі утворення, як атмосферний туман, природні води; з іншої – багато із штучно утворених продуктів, наприклад, деякі лікарські препарати, харчові продукти (хліб, маргарин, молоко, масло, м’ясо, зефір, тощо), фарби, синтетичний каучук, світлочутливі матеріли, що використовуються у фото - та кінопромисловості. Велике значення мають такі матеріали, як піноскло, пінобетон, вата, та інші. В найрізноманітніших галузях промисловості використовуються дисперсні системи. Це має місце у нафтопереробній промисловості, у деяких основних виробництвах хімічної промисловості, та в ряді інших. Особливо велику роль відіграють вони в шкіряній, текстильній, миловарній промисловості, при виробництві штучних волокон, пластмас, продуктів харчування, тощо. Що ж таке дисперсна система?
Дисперсна система – це така дво -, або багатокомпонентна система, в якій одна речовина (або декілька) знаходиться в ступені більш, або менш високої подрібненості та рівномірно розповсюджено в навколишньому середовищі (від латинського слова dispersus– розсіяний). Сукупність дрібних роздрібнених часток складає дисперсну фазу, а оточуюча їх речовина – дисперсійне середовище. Дисперсні системи гетерогенні, тому що між частками дисперсної фази та дисперсійного середовища є поверхня розділу, що володіє великим запасом вільної поверхневої енергії.
Однією з важливих характеристик дисперсної системи є ступень подрібненості – це кількість часток, які можна було б укласти упритул на відстані 1 см.
Між розміром часток та ступенем подрібненості зворотний зв’язок.
Чим більше ступень дисперсності, тим менший розмір часток, і навпаки. Ступень дисперсності можна охарактеризувати величиною питомої поверхні So:
So = S/V
де S – загальна поверхня (м2), V - об’єм речовини, що піддано подрібненню (м3). Величина S, а, відповідно, і So, з підвищенням ступеня дисперсності безупинно зростає.
Дисперсні системи класифікують за двома ознаками: за ступенем дисперсності та за агрегатним станом.
КЛАСИФІКАЦІЯ ЗА СТУПЕНЕМ ДИСПЕРСНОСТІ
Мікрогетерогенні (грубодисперсні) – емульсії, суспензії, піни, аерозолі. Розмір часток 10-5 – 10-7 м. Гетерогенні, нестійкі.
Ультрамікрогетерогенні (колоїдні) – золі. Розмір часток 10-7 – 10-9м. Колоїдні частки, мікрогетерогенні, досить стійкі.
Молекулярно та іоннодисперсні :
розчини низькомолекулярних сполук - молекули, іони. Розмір часток 10-10. Гомогенні, досить стійки.
розчини високомолекулярних сполук – ланцюгові молекули та макроіони. Розмір часток 10-8 – 10-9 м. Гомогенні, досить стійки.
Питання: проаналізуйте цю класифікацію та зробить висновок, як пов’язано ступень дисперсності зі стійкістю систем? (чим вища ступінь дисперсності, тим вище стійкість систем).
КЛАСИФІКАЦІЯ ЗА АГРЕГАТНИМ СТАНОМ
Аерозолі (Г-Р) 5. Суспензії (Р-Т)
Аерозолі (Г-Т) 6. Тверді піни (Т-Г)
Піни (Р-Г) 7. Тверді емульсії (Т-Р)
Емульсії (Р1 – Р2) 8. Тверді суспензії (Г-Т)


Золь AgNO3 Піна
Рисунок 1. Приклади колоїдних систем
Найбільшу цікавість викликають колоїдні розчини. Їх отримують двома методами: дисперсійним та конденсаційним.
Дисперсійний метод – отримання колоїдних систем подрібненням більш грубих за розміром часток до колоїдного ступеня дисперсності. Існують наступні засоби подрібнення часток: механічне дроблення – у ступці, дроблення за допомогою колоїдних млинів; електродиспергування металів; дроблення ультразвуком, тощо.
При дисперсійному методі позначається так званий ефект Ребіндера. На подрібнення матеріалу завжди затрачається велика кількість енергії. Роботами професора МГУ Петра Олександровича Ребіндера (1898-1972) та співробітників встановлено, що в присутності малої кількості речовини, здатної адсорбуватися в мікрощілинах матеріалів, знижується їх пружність та міцність, в наслідок чого зменшуються зовнішні зусилля на подрібнення. Цей ефект використовується при бурінні, обробці металів, тощо.
Конденсаційний метод – укрупнення часток шляхом з’єднання (конденсації) атомів під дією залишкових ван-дер-ваальсовських сил притягання в агрегати з колоїдним ступенем дисперсності. Конденсацію розчинів можна викликати різними фізичними та хімічними факторами: зниженням температури (туман), заміною кращого розчинника на гірший, тощо.

Рисунок 2. Диспергаційні та конденсаційні методи одержання колоїдних розчинів:
1 – речовина; 2 – частинки грубої суспензії; 3 – міцели (колоїдний розчин); 4 – молекули та йони (істинний розчин)
Отримані будь-яким способом колоїдні розчини необхідно стабілізувати, тобто додати речовини, що створюють захисні адсорбційні шари навкруги часток. Роль стабілізаторів можуть виконувати молекули та іони, що є продуктами взаємодії речовини дисперсної фази з дисперсійним середовищем, або спеціальні добавки речовин: ВМС, мила, електроліти (найчастіше), тощо.
Після стабілізації колоїдні розчини необхідно очистити від домішок. Процес очистки золів називається діалізом. В теперішній час очистку золів проводять в спеціальних приладах – електродіалізаторах, основною частиною яких є напівпроникна перетинка, що не пропускає великі частки золів і пропускає розчини стабілізаторів-електролітів (рис.2).

Риунок 3. Схема електродіалізатора
Властивості колоїдних систем поділяють на три основних групи: молекулярно-кінетичні, оптичні та електрокінетичні.
Молекулярно-кінетичні властивості колоїдних розчинів якісно не відрізняються від аналогічних властивостей колоїдних розчинів, є тільки якісні відмінності. МКТ розглядає колоїдні розчини як приватний випадок справжніх розчинів, в яких дисперсна фаза відіграє роль розчиненої речовини, а дисперсійне середовище – роль розчинника. Колоїдним розчинам властиві наступні якості:
Броунівський рух – виражається в тому, що частки дисперсної фази, під впливом молекул дисперсійного середовища, що знаходяться в тепловому русі, приходять в стан безперервного хаотичного руху. Вперше воно було виявлено у 1827 році англійським ботаніком, монахом Т. Броуном, який спостерігав рух пилку рослин у воді. Броунівський рух властивий часткам будь-яких речовин, коли їх розміри достатньо малі. Чим менші частки, тим інтенсивніше спостерігається броунівський рух. Особливо помітний він у часток колоїдного ступеня дисперсності. В окремі моменти часу частина ударів молекул рідини о частки дисперсійної фази виявляється нескомпенсованою, внаслідок чого частки здійснюють пробіжи в самих різноманітних напрямках. Інтенсивність броунівського руху зростає із зростанням температури. Разом с тим, воно не залежить від часу – тривалості існування системи. Вивчення броунівського руху мало велике філософське значення, так як воно підтвердило реальність існування молекул.
Дифузія – мимовільний процес вирівняння концентрацій молекул, іонів або колоїдних часток під впливом їх безладного теплового руху (у колоїдних системах – броунівського руху). Дифузія - незворотний процес і супроводжується переносом речовини із місць з більшою концентрацією до місць з меншою. Дифузія можлива лише в системах з невирівняною концентрацією і закінчується з настанням рівноваги, тобто з досягненням рівномірного розподілу часток по всьому об’єму. Кількісно процес дифузії виражається рівнянням:
m
= D
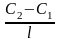 S
S
де m – кількість речовини, що дифундує, D – коефіцієнт дифузії, С2-С1 – змінення концентрації в двох шарах системи, l – відстань між двома шарами, тоді величина С2 – С1/l називається градієнтом концентрації; S – величина площі поперечного перетину, - час дифузії.
Фізичний смисл коефіцієнту дифузії можна усвідомити, коли прийняти всі величини рівними 1. Тоді m=D , тобто коефіцієнт дифузії D дорівнює кількості речовини, що дифундує крізь 1 м2 за 1 секунду при градієнті концентрації 1 кмоль/м3 при даній температурі. У 1906 році Ейнштейн встановив залежність між коефіцієнтом дифузії та іншими величинами:
D
=
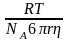
де R – універсальна газова постійна, T – абсолютна температура, NA – постійна Авогадро, - в'язкість розчинника, дисперсного середовища, або газу, - відношення довжини окружності до її діаметру (3,14), r – радіус часток, що дифундують, або молекул.
З рівняння видно, що коефіцієнт дифузії, який характеризує її швидкість, зворотно пропорційний розміру часток, що дифундують. З цієї причини при одній і тій самій температурі швидкість дифузії в колоїдних системах в сотні і тисячі разів менша за швидкість в справжніх розчинах. Знаючи коефіцієнт дифузії, модна визначити розміри часток.
Зсув – його відчувають частки внаслідок броунівського руху та дифузії. Відстань, на яку пересувається колоїдна частка по розчину в даному напрямку за час , називається середнім зсувом і позначається . Ц. Величину можна знайти дослідним шляхом. Німецьким фізиком Альбертом Ейнштейном та польським хіміком Маріаном Смолуховським у 1906 році було знайдено зв’язок середнім зсувом частки за час та коефіцієнтом дифузії:
2D
Осмотичний тиск - . В колоїдних системах він вираховується за формулою:
N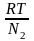
у зв’язку з тим, що у колоїдних часток концентрація – це кількість часток в одиниці об’єму.
Отже, при постійній температурі осмотичний тиск прямо пропорційний кількості часток в одиниці об’єму справжнього розчину, що беруть участь в тепловому русі, або кількості колоїдних часток в одиниці об’єму, що беруть участь в броунівському русі. Осмотичний тиск колоїдних розчинів малий і с трудом піддається вимірюванню.
У золів також відмічено невелике значення інших величин, що характеризують молекулярно-кінетичні властивості: пружність пари, зниження температури замерзання, підвищення температури кипіння.
Оптичні властивості колоїдних систем якісно відрізняються від оптичних властивостей справжніх розчинів. В основі їх лежить розсіювання та поглинання (абсорбція) світла колоїдними частками. Коли частки великі, їх розмір більший за довжину хвилі падаючого світла, розсіювання викликається відбиттям та переломленням падаючих на частки світлових хвиль. Такий вид розсіяння обумовлює, наприклад, мутність суспензій, емульсій, видиму неозброєним оком. Розсіяння світла колоїдними частками пов’язано з явищем дифракції – огинанням часток і розсіянням їх у різних напрямках. Поглинання світла залежить від природи речовини. Одні речовини поглинають всі промені падаючого світла, інші – тільки деякі (вибіркова абсорбція), треті – прозорі, або білі тіла – не поглинають промені взагалі.
До оптичних властивостей належать:
Опалесценція – поява деякої мутності та різниця в забарвленні золю в минаючому та відбитому світлі. Так, наприклад, золі сірки, каніфолі та хлориду срібла мають в минаючому світлі червонувато-жовтий відтінок, а у відбитому – голубуватий.

Рисунок 4. Опалесценція
Забарвлення – пов’язано з вибірковою абсорбцією дисперсною фазою світлових хвиль, а також з дифракцією. Більшість золів мають забарвлення, інтенсивність якого в багато разів вища за забарвлення справжніх розчинів. Так, золь Fe(OH)3 має в 20 разів більш інтенсивне забарвлення, ніж розчин фуксину тієї ж концентрації, а золь золота – в 400 разів. Яскраве забарвлення дорогоцінного каміння викликана вмістом в них золів дорогоцінних металів.
Ефект Фарадея – Тіндаля – вперше Майкл Фарадей на золі золота, а потім – англійський фізик Х1Х сторіччя Джон Тіндаль винайшли, що коли пропускати крізь золь збоку пучок світла, то можна спостерігати появлення характерного світлового конусу. Утворення такого конусу можна спостерігати від променя прожектору на темному небі, від променя сонця, що проникає в темну кімнату, коли в ній знаходиться багато пилу, тощо.

Рисунок 5. Ефект Фарадея – Тіндаля
Кількісну характеристику цих явищ надав англійський фізик, член Лондонського королівського товариства Джон Уїльям Релей (1842 – 1919) :
I
= IoK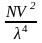
де Io- інтенсивність падаючого світла, К – постійна величина для даного золю, що залежить від різниці показників переломлення дисперсної фази no та дисперсійного середовища n, V- об’єм частки, N- кількість часток, що розсіюється о одиниці об’єму, - довжина хвилі падаючого світла.
Оптичні властивості колоїдних систем лежать в основі побудови ультрамікроскопу та нефелометричного методу аналізу. За їх наявністю можна зробити висновок, чи справжній, чи колоїдний розчин перед нами.
Крім того, на поява якісно нових оптичних властивостей колоїдних розчинів завдяки зміни розміру часток, може служити чудовою ілюстрацією до одного з законів філософії – закону переходу кількісних змін до якісних.
Наявність електрокінетичних властивостей колоїдних систем було доведено дослідом Рейса у 1808 - 1809 роках. В грудку сирої глини він помістив дві скляні трубки, на дно яких насипав сирого піску. Трубки заповнив водою і в них занурив електроди, підключені до джерела току. При пропусканні електричного струму Рейс помітив через деякий час, що в анодній трубці рівень води знизився і в ній з’явились частки глини (муть), а в катодній – рівень води підвисився і вода залишилась прозорою. Виявилось, що частки глини набувають негативний заряд завдяки адсорбції гідрат-іонів ОН-. Іони Н+ пересувались до катоду. О основі виникнення електрокінетичних властивостей лежить поява на колоїдних частках подвійного електричного шару. До них відносяться:
Електрофорез – явище пересування твердих часток в електричному полі відносно нерухомої рідини до електроду, знак якого протилежний заряду часток золю.
Електроосмос – спрямований рух рідини до електроду, знак якого однаков із зарядом часток твердої фази. Обидва явища – електрофорез та електроосмос – було доведено дослідом Рейса.
Виникнення - потенціалу (електрокінетичного потенціалу) – переміщаючись в електричному полі, частка захоплює за собою адсорбційний шар рідини і протиіони, що містяться в ньому, які нейтралізують частину заряду поверхні. Надлишок заряду і визначає - потенціал. Його розраховують за формулою:
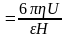 -
для часток сферичної форми
-
для часток сферичної форми
 =
=
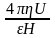 - для часток циліндричної форми
- для часток циліндричної форми
де - відношення довжини окружності до її діаметру (3,14), - в'язкість середовища, - діелектрична проникність середовища, U –0 електрофоретична швидкість часток, H – градієнт потенціалу (Е/1). Звідси розрахувати електрофоретичну швидкість можна за формулами:
U
=
 -
для часток сферичної форми
-
для часток сферичної форми
U
=
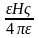 - для часток циліндричної форми
- для часток циліндричної форми
Явища електрофорезу та електроосмосу використовують в техніці: при виготовленні та сушінні цегли, при просоченні пористих матеріалів, тощо.
Питання для самоперевірки
1. Що називається дисперсною системою?
2. Чим відрізняються колоїдні розчини від справжніх?
3. Якими методами отримують колоїдні системи?
4. Дайте характеристику властивостей колоїдних систем.
Література
1.1. С.257-290,
1.5.С.307-320, 325-376.
