
- •Исходные данные
- •Введение
- •Задача № 1
- •Теоретическая часть
- •Задача № 2
- •Теоретическая часть
- •Задача 3
- •Теоретическая часть
- •Задача 4
- •Теоретическая часть
- •Задача 5
- •Теоретическая часть
- •Задача 6
- •Теоритическая часть
- •Практическая часть
- •Задача 7
- •Теоритическая часть
- •Практическая часть.
- •Задача №8
- •Теоритическая часть
- •Практическая часть
- •Задача № 9
- •Теоретическая часть
- •Практическая часть
- •Задача №10
- •Список используемой литературы
Задача 4
Определите окислитель и восстановитель в реакциях полного сгорания указанных в задании углеводородов. Определите стехиометрические коэффициенты в уравнениях методом электронного баланса.
Теоретическая часть
Окислительно-восстановительные реакции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Окислительно-восстановительные реакции (реакции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении - понижается.
Первоначально окислением называли только реакции веществ с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует.
В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого (окислителя). При этом окислитель восстанавливается, а восстановитель - окисляется. При протекании реакций в гальваническом элементе переход электронов осуществляется по проводнику, соединяющему электроды элемента, и изменение энергии Гиббса ΔG в данной реакции может быть превращено в полезную работу. В отличие от реакций ионного обмена окислительно-восстановительные реакции (ОВР) в водных растворах протекают, как правило, не мгновенно.
При окислительно-восстановительных реакциях атомы в высшей степени окисления являются только окислителями, в низшей - только восстановителями; атомы в промежуточной степени окисления в зависимости от типа реакции и условий ее протекания могут быть окислителями или восстановителями. Многие окислительно-восстановительные реакции (ОВР) – каталитические.
По
формальным признакам
окислительно-восстановительные реакции
(ОВР) разделяют на межмолекулярные
(например, 2 +
+
 →
→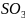 )
и внутримолекулярные (например,
(NH4)2Cr2O7
→ N2
+ Cr2O3
+ 4H2O
- реакция представляет собой
самоокисление-самовосстановление ).
)
и внутримолекулярные (например,
(NH4)2Cr2O7
→ N2
+ Cr2O3
+ 4H2O
- реакция представляет собой
самоокисление-самовосстановление ).
Окислительно-восстановительные
реакции (ОВР) часто сопровождаются
высоким энерговыделением, поэтому их
используют для получения теплоты или
электрической энергии. Наиболее
энергичные ОВР протекают при взаимодействии
восстановителей с окислителями в
отсутствие растворителя; в растворах
такие реакции могут быть невозможны
вследствие окислительно-восстановительного
взаимодействия одного или обоих реагентов
с растворителем. Так, в водном растворе
нельзя непосредственно провести реакцию
2Na +
 →
2NaF, поскольку натрий и фтор бурно
взаимодействуют с водой. На
окислительно-восстановительные свойства
ионов сильно влияет комплексообразование,
например: комплекс [Co2+(CN)6]4-,
в отличие от гидратированного иона
Со2+,
является сильным восстановителем.
→
2NaF, поскольку натрий и фтор бурно
взаимодействуют с водой. На
окислительно-восстановительные свойства
ионов сильно влияет комплексообразование,
например: комплекс [Co2+(CN)6]4-,
в отличие от гидратированного иона
Со2+,
является сильным восстановителем.
В случае окислительно-восстановительных реакций в органической химии использование обобщенной концепции окисления-восстановления и понятия о степени окисления часто малопродуктивно, особенно при незначительно полярности связей между атомами, участвующими в реакции. В органической химии окисление рассматривают обычно как процесс, при котором в результате перехода электронов от органического соединения к окислителю возрастает число (или кратность) кислородсодержащих связей (С — О, N — О, S — О и т.п.) либо уменьшается число водородсодержащих связей (С — Н, N —Н, S —Н и т.п.), например: RCHO → RCOOH; R2CHCHR2 → R2C=CR2. При восстановлении органических соединений в результате приобретения электронов происходят обратные процессы, например: R2CO → R2CH2; RSO2Cl → RSO2H.
Окисление углеводородов ( в частности горение ) так же является ОВР. Для этана и циклопропана она примет вид:
А) C2Н2 + 2,5O2 → 2CO2 + H2O
 /
1 – восстановитель (окисление)
/
1 – восстановитель (окисление)
 /
2,5 – окислитель (восстановление)
/
2,5 – окислитель (восстановление)
Б) C4Н8 + 6O2 → 4CO2 + 4H2O
 /
1 – восстановитель (окисление)
/
1 – восстановитель (окисление)
/ 2,5 – окислитель (восстановление)
 /
1 – восстановитель (окисление)
/
1 – восстановитель (окисление)
/ 3,5 – окислитель (восстановление)
