
- •Исходные данные
- •Введение
- •Задача № 1
- •Теоретическая часть
- •Задача № 2
- •Теоретическая часть
- •Задача 3
- •Теоретическая часть
- •Задача 4
- •Теоретическая часть
- •Задача 5
- •Теоретическая часть
- •Задача 6
- •Теоритическая часть
- •Практическая часть
- •Задача 7
- •Теоритическая часть
- •Практическая часть.
- •Задача №8
- •Теоритическая часть
- •Практическая часть
- •Задача № 9
- •Теоретическая часть
- •Практическая часть
- •Задача №10
- •Список используемой литературы
Министерство Российской Федерации
по делам гражданской обороны, чрезвычайным ситуациям и ликвидации последствий стихийных бедствий
Ивановский институт Государственной противопожарной службы
Кафедра химии, теории горения и взрыва
КУРСОВАЯ РАБОТА
по дисциплине «Химия»
по теме: «Расчет основных характеристик, параметров состояния и процессов газообразных углеводородов»
Вариант № 97
Выполнил:
12 курс,1 взвод
Научный руководитель:
(должность, ученая степень, ученое звание, спец. звание Ф.И.О.)
Дата защиты:
Оценка:
Иваново 2012
Содержание
Исходные данные
Введение
Задача №1 (Определение массы газа)
Задача №2 (Нахождение изменения плотности)
Задача №3 (Определение абсолютной плотности смеси)
Задача № 4 (определение окислительно-восстановительных реакций)
Задача №5 (Определение обьема воздуха)
Задача №6 (определение теплового эффекта)
Задача №7 (Определение изменения энтропии и энергии Гиббса)
Задача №8 (Определение температуры газовой смеси)
Задача №9 ( Зависимость между объемом V и давлением р )
Задача №10 (Пожароопасные свойства веществ)
Вывод
Исходные данные
ω,%( транс-2-бутен) = 50; ω,%(этин) = 50;
|
l = 80 м; h = 25 м; g =18 м. |
2,5 |
13 |
270 |
Где l,h,g –геометрические размеры прямоугольного резервуара

Состав газовой смеси
ω,%( транс-2-бутен) = 50ω,%(этин) =50
2,5 - Буферное давление pбуф, Мпа
13 - Давление хранения, pхр, Мпа
270 -Температура хранения К
Введение
Углеводороды – большой класс сложных соединений. Как видно из названия они состоят из углерода и водорода. Углеводороды образуются в процессе трансформации органических веществ животного и растительного происхождения. В основном этот процесс происходил доисторические времена, соответственно образовавшиеся углеводороды накапливались в осадочных породах.
Углеводороды обладают свойством быстрого окисления – горючестью – при этом выделяется значительное количество тепла. Данная особенность этих органических соединений нашла большое применение в жизни и работе человека: горюче-смазочная продукция, топливо для электростанций и отопления квартир и домов, синтез полимеров и других веществ.
Как и многие другие вещества, углеводороды могут находиться в различных состояниях: твёрдом (уголь, торф), жидком (нефть, газойль, бензин, октан), газообразном (природный газ, метан, бутан). Газы имеют преимущество в том плане, что их можно использовать как готовую продукцию сразу после добычи, поскольку они содержат крайне мало посторонних примесей (так например в состав природного газа входит примерно 80-90% метана, этан, пропан, бутан, простое вещество азот, углекислый газ). В промышленных масштабах органические газы добывают из морских и подземных скважин.
В реальных условиях сложившейся структуры промышленности и сельского хозяйства топливно-энергетический комплекс остается ключевым звеном всей экономической системы государства. Поэтому обеспечение устойчивого и надежного его функционирования является необходимым условием энергетической безопасности как отдельных регионов, так и государства в целом. Неоспоримую роль для устойчивого и надежного функционирования топливно-энергетического комплекса оказывают хранилища газообразных и жидких углеводородов.
Задача № 1
Определить массу газа, находящегося в подземном резервуаре при определенных температуре хранения и давлении хранения.
Теоретическая часть
В числе газообразных и жидких углеводородов по объему их хранения лидирующую позицию занимает природный газ. Помимо природного газа в большом количестве на хранилищах резервируются: сырая нефть, сжиженные газы, газовые конденсаты и различные нефтепродукты. В состав природных газов, кроме метана, входят углеводороды до гомологического ряда С5. Существует большой разброс величин физико-химических свойств углеводородов, входящих в состав природных газов.
Для составления материальных и тепловых балансов многочисленных процессов, параметров технологического режима хранения и переработки нефти, нефтепродуктов, газообразных углеводородов и их смесей используют понятие компонентного состава.
Газообразные углеводороды можно рассматривать как смесь, состоящую из х компонентов. Их число и свойства определяют физико-химическую характеристику смеси в целом. Для определения массы, находящихся в резервуаре газов берется среднее значение их молярных масс, выраженных в формуле:
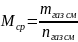 (1)
(1)
Где М ― среднее значение молярных масс смеси газов; mгаз см― масса смеси газов, а nгаз см. При этом средняя молярная масса всегда больше, чем наименьшая из молярных масс газов в смеси, и меньше, чем наибольшая молярная масса: Mmin <Mcp< Mmax.
Для нефти, нефтяных фракций, нефтепродуктов, газовых смесей углеводородов под понятием «молярная масса» подразумевается её среднее значение, которое находится экспериментально или по эмпирическим зависимостям. Таким образом, учитывая, что располагают газовой смесью, исходя из известного состава и молярных масс компонентов, по правилу аддитивности определяют среднюю молярную массу смеси газов:
 (2)
(2)
 ,
(3)
,
(3)
 ,
(4)
,
(4)
где mгаз.см., nгаз.см. – масса газовой смеси [г, кг] и количество вещества газовой смеси [моль] соответственно; ni – количество вещества i-го компонента газовой смеси [моль], указанного в вариантах задания; Мi – молярная масса i-го компонента смеси [г(кг)/моль(кмоль)], указанного в варианте задания; ωi – массовая доля газа, указанного в вариантах задания.
Учесть,
что

 .
.
В практике технологических расчётов хранения газовых смесей, а также, например, для определения давления газа при взрыве, широко используют законы газового состояния. По сравнению с молекулами жидкости молекулы газов удалены друг от друга на большие расстояния, чем их собственные размеры. С этим связаны некоторые особые свойства газов, например способность к сжатию со значительным изменением объёма, заметное повышение давления с ростом температуры, и т.д.
Большая часть газообразных углеводородов и нефтяных паров при определенных условиях становятся близки своими свойствами к идеальным газам. Поэтому их поведение достаточно полно объясняет кинетическая теория газов, основу которой составляют законы Бойля-Мариотта, Гей-Люссака и Шарля. Параметры состояния идеального газа связывает уравнение Менделеева-Клапейрона:
 (2)
(2)
Где pхр —давление хранения (Па), Тхр — температура хранения (К), Мсм — среднее значение молярной массы смеси газов (кг/моль), m — масса газа, хранящегося в резервуаре (кг), V — объём резервуара (м3), R — универсальная газовая постоянная(R=8,314Дж моль∗К).
Из формулы (2) выражаем массу m вещества:
 (3)
(3)
Для рассматриваемого примера можно рассчитать массу газовой смеси, хранящейся при температуре хранения Тхр=270К, давлении хранения рхр=13МПа в резервуаре шириной g=18м длинной l=80м и высотой h=25м.
Для нахождения массы смеси газов необходимо найти объем V резервуара:
V=l∗g∗h=80∗25∗18=36000(м3)
Осталось найти усредненную молярную массу смеси этан (С2Н6) и циклопропан (С3Н6) — Мсм. Но для начала необходимо найти молярные массы этих газов:
 =
М(
=
М( Н2)
= 2∗12∗10-3+2∗1∗10-3=26∗10-3
(кг/моль)
Н2)
= 2∗12∗10-3+2∗1∗10-3=26∗10-3
(кг/моль)
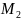 =М(
=М( Н8)
= 4∗12∗10-3+8∗1∗10-3=56∗10-3
(кг/моль)
Н8)
= 4∗12∗10-3+8∗1∗10-3=56∗10-3
(кг/моль)
Полученные данные подставляем в формулу (4):
Например, для указанной выше газовой смеси:
 .
.
Теперь имеются все данные, чтобы найти массу смеси, необходимо подставить их в формулу (3):

Таким образом получили, что в данном частном случае в резервуаре определенного объема хранится смесь циклопропана и этана массой7,4∗106 кг. Полученное значение массы газовой смеси в дальнейшем поможет с определением плотности ρ.
