
- •Кинетика Выберите один правильный ответ
- •Выберите несколько правильных ответов
- •Кинетика Выберите один правильный ответ
- •Выберите несколько правильных ответов
- •Установите соответствие
- •Кинетика Выберите один правильный ответ
- •Выберите несколько правильных ответов
- •Кинетика Выберите один правильный ответ
- •Выберите несколько правильных ответов
- •Кинетика Выберите один правильный ответ
- •Выберите несколько правильных ответов
- •Установите соответствие
- •Кинетика Выберите один правильный ответ
- •Выберите несколько правильных ответов
- •Установите соответствие
КИНЕТИКА
Выберите один правильный ответ
При температуре 25С химическая реакция протекает за 144 с. За какое время эта реакция завершится при 55 С, если ее температурный коэффициент равен 2.
А. 18
Б. 30
В. 72
Г. 90
Д. 96
Выберите несколько правильных ответов
Экспериментально установлено, что кинетическое уравнение для реакции: 2 NO (г) + O2 (г) 2 NO2 (г) имеет вид = к c 2(NO) c(O2), следовательно
А. Реакция является простой;
Б. Молекулярность равна 3;
В. Реакция имеет второй порядок по кислороду;
Г. Суммарный порядок равен 3
Д. Частный порядок по оксиду азота (II) равен 2.
Установите соответствие
-
Название
Формула
1. Уравнение Аррениуса
А. k2 = k1
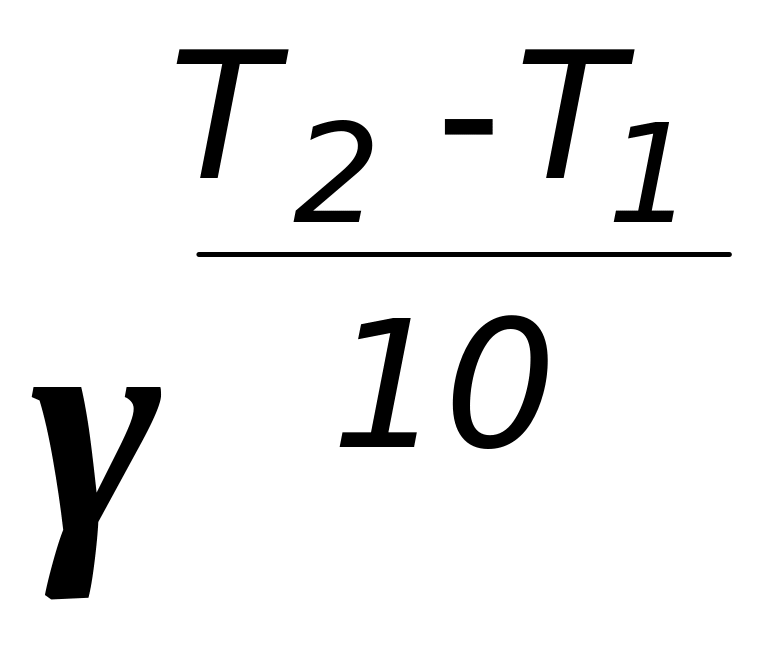
Б. = k c (A) c(B)
В. ЕА =
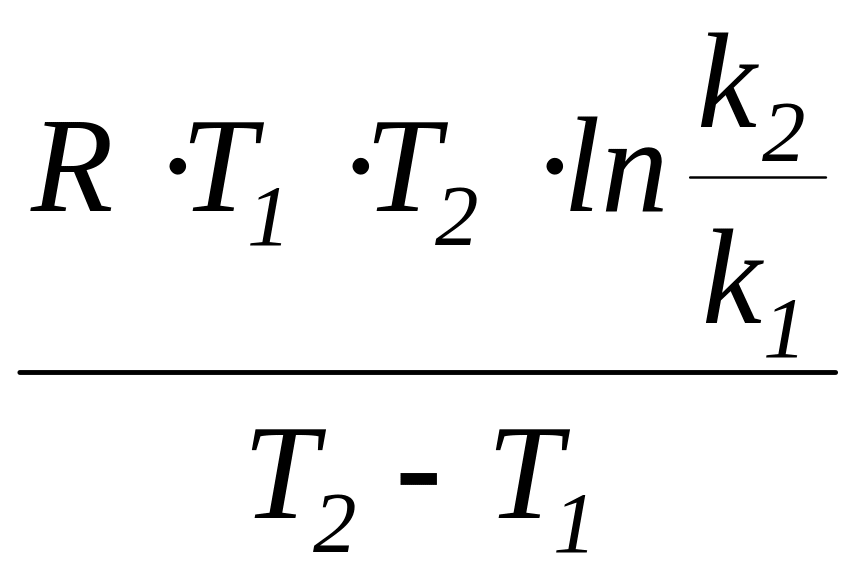
Г. Кр =
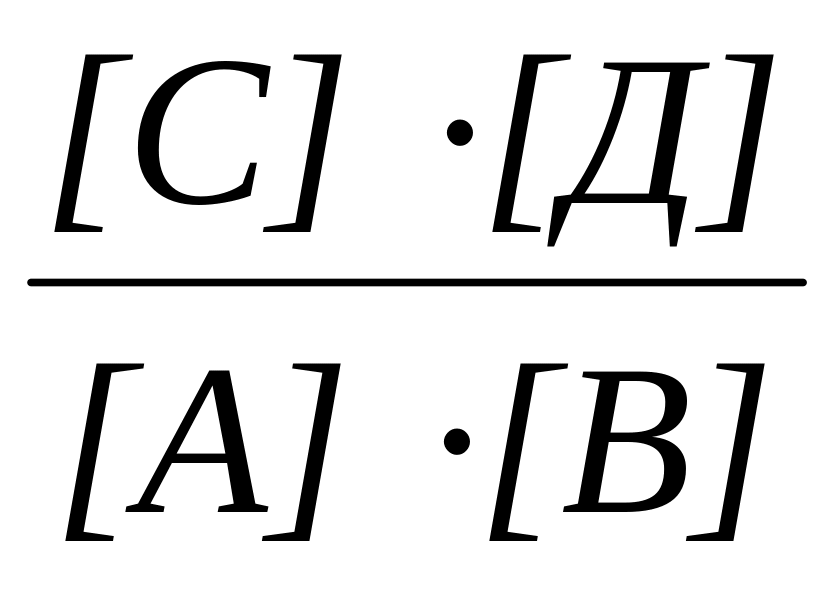
Д. G = – RT ln Kр
2. Константа химического равновесия для реакции А + В
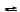 С + Д
С + Д3. Кинетическое уравнение реакции А + В С
Кинетика Выберите один правильный ответ
Указать уравнение, выражающее связь изменения энергии Гиббса с константой равновесия
А. Kр = – RT ln G
Б. G = – 2,303 RT Kрlg c
В. G = – RT ln Kр
Г. Kр = – RT ln G К
Д.
G
= – RT lg ![]()
Выберите несколько правильных ответов
Явление «катализ» верно характеризуют утверждения:
А. Это явление увеличения скорости реакции под воздействием небольших добавок ингибиторов;
Б. Отрицательный катализ протекает в присутствии ингибиторов;
В. В гетерогенном катализе катализатор и реагирующие вещества образуют систему из различных фаз;
Г. Это явление изменения скорости реакции под воздействием небольших добавок катализаторов;
Д. Катализатор участвует в химической реакции и в результате значительно изменяется по составу.
Установите соответствие
Тип реакции |
Химическая реакция |
1. Мономолекулярная |
А. Ag+ + Cl– → AgCl
Б.
2NO
+ O2 В. 3NaOH + H3PO4 Na3PO4 + 3H2O Г. H2 + Cl2 2HCl Д. H2SO3 SO2 + H2O
|
2. Бимолекулярная |
|
3. Тримолекулярная |
Кинетика Выберите один правильный ответ
Равновесие реакции 2 H2S(г) + SО2 (г) 3 S(т) + 2 H2О(ж) , H < 0
сместится вправо при:
А. Повышении давления;
Б. Повышении температуры;
В. Увеличении концентрации серы;
Г. Увеличении концентрации сероводорода;
Д. Уменьшении концентрации SО2 (г)
Выберите несколько правильных ответов
Понятие «порядок реакции» верно характеризуют утверждения:
А. Он определяет зависимость скорости реакции от концентрации;
Б. Он равен min числу молекул (других частиц), необходимому для осуществления элементарного акта реакции;
В. Он равен max числу частиц, необходимому для осуществления элементарного акта реакции;
Г. Он равен сумме показателей степеней при концентрациях в уравнении для скорости простой реакции;
Д. Его можно определить опытным путем.
Установите соответствие
-
Формула
Название
1.г 2 =1
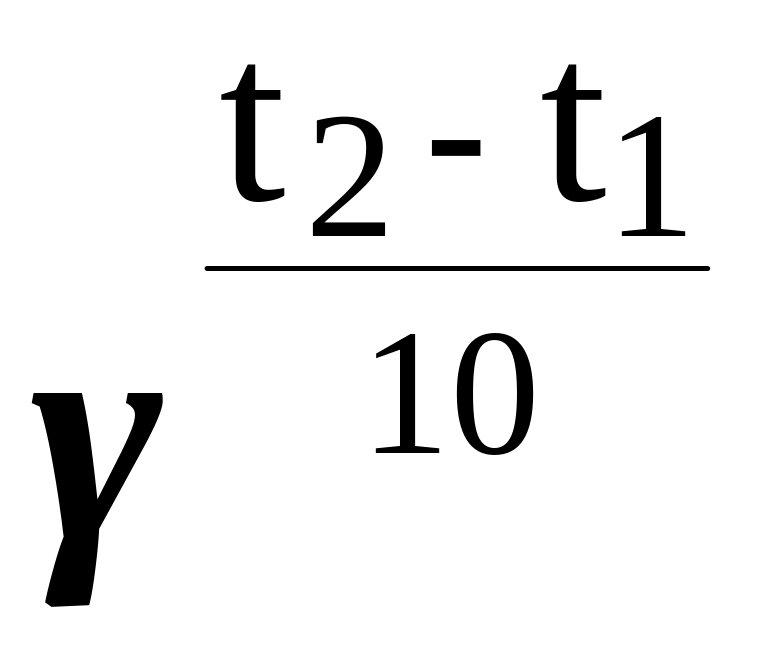
А. Скорость гомогенной реакции
Б. Кинетическое уравнение
В. Скорость гетерогенной
реакции
Г. Уравнение Вант-Гоффа
Д. Уравнение Аррениуса
2.б = k cn (A) cm(B)
3. = ±

КИНЕТИКА
Выберите один правильный ответ
Скорость прямой реакции синтеза аммиака из азота и водорода при увеличении концентрации исходных веществ в 2 раза:
А. увеличится в 2 раза;
Б. уменьшится в 2 раза
В. увеличится в 4 раза
Г. не изменится
Д. увеличится в 16 раз
Выберите несколько правильных ответов
Системы, в которых повышение давления и повышение температуры приведут к смещению равновесия в противоположных направлениях:
А. С(т) + СО2 (г) 2 СО(г), H < 0;
Б. J2 (г) + 5 CО2 (г) J2O5 (т) + 5 СО(г), H > 0;
В. N2 (г) + О2 (г) 2 NO (г), H < 0;
Г. HСCH (г) + 2 Н2 (г) СН3–СН3 (г), H < 0
Д. 2 SO2 (г) + O2 (г) 2 SO3 (г) , H > 0.
Установите соответствие
-
Физическая величина
Формула
1. Константа скорости нулево-го порядка
А. k =
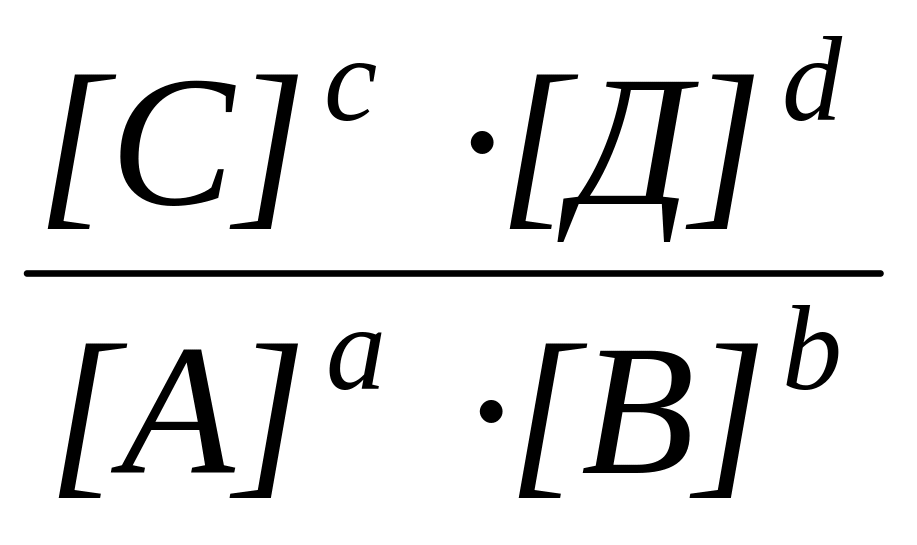
Б. k =
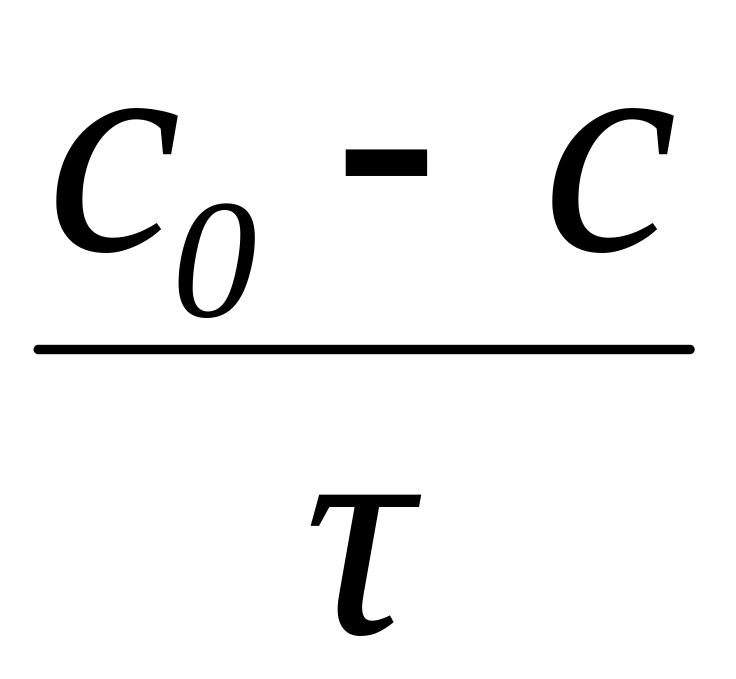
В. k = А
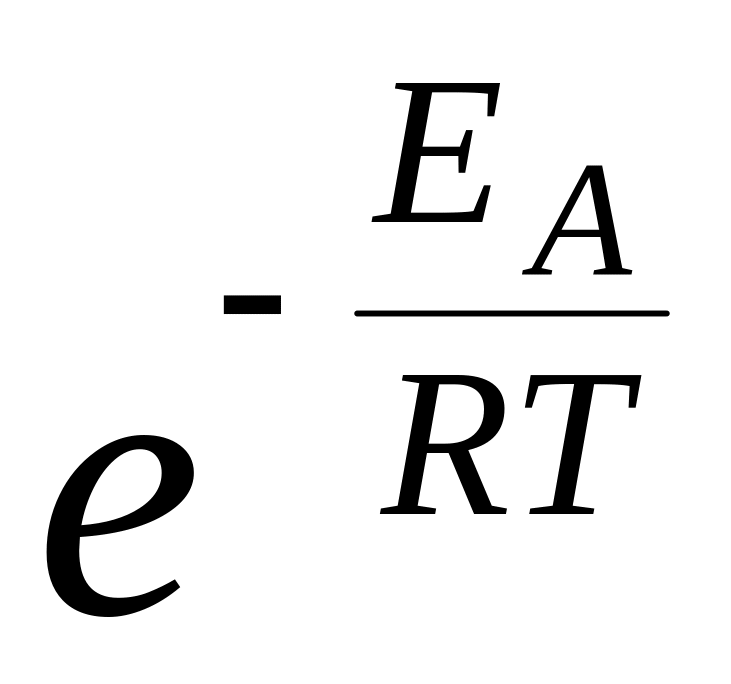
Г. k = , при с = 1 моль/л
Д. k =
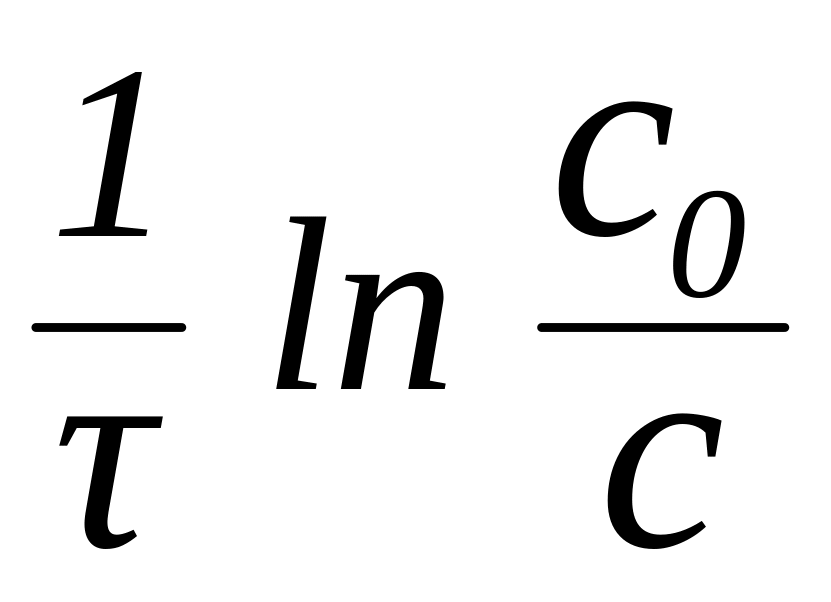
2. Константа скорости первого порядка
3. Константа скорости по уравнению Аррениуса
