
- •Устойчивость дисперсных систем.
- •Агрегативная устойчивость коллоидных растворов. Коагуляция.
- •Кинетика коагуляции электролитами.
- •Быстрая коагуляция.
- •Медленная коагуляция.
- •Факторы устойчивости лиофобных золей.
- •Виды коагуляции электролитами.
- •Защита коллоидных частиц.
- •Защитное действие некоторых вмс.
- •Теория устойчивости и коагуляции лиофобных дисперсных систем.
Защита коллоидных частиц.
Коллоидной защитой называется повышение агрегативной устойчивости золя путем введения в него высокомолекулярного соединения (ВМС).
Для гидрофобных золей в качестве ВМС обычно используются белки, углеводы, пектины.
Для неводных золей – каучуки.
Защитное действие ВМС связано с образованием на поверхности коллоидных частиц определенного адсорбционного слоя.
Для характеристики защитного действия различных ВМС Зигмонди предложил использовать золотое число.
Золотое число – это количество миллиграммов ВМС, которое надо добавить к 10 см3 0,0006%-го красного золя золота, чтобы предотвратить его посинение при добавлении к нему 1 см3 10%-го раствора NaCl.
Иногда для характеристики защитного действия ВМС вместо золя золота используются коллоидные растворы серебра (серебряное число), гидроксид железа (железное число) и др.
Защитное действие некоторых вмс.
-
Защитное вещество
Число
золотое
серебряное
железное
Желатин
0,01
0,035
5
Гемоглобин
0,03-0,07
-
-
Декстрин
20
100
20
Казеннат натрия
0,01
-
-
Крахмал картофельный
20
-
-
В некоторых случаях введение в коллоидную систему очень малых количеств ВМС приводит не к защите, а к снижению устойчивости.
Сенсибилизацией называется снижение порога коагуляции золя при добавлении в него ВМС.
Теория устойчивости и коагуляции лиофобных дисперсных систем.
По мере накопления экспериментальных данных, по-разному объяснялась коагуляция дисперсных систем электролитами.
Создавались различные теории коагуляции, но все они были односторонними и связывали процесс коагуляции с действием какого-то одного факта.
Так, в электростатической теории, предложенной Мюллером, коагуляция объяснялась сжатием ДЭС и достижением критического значения дзета-потенциала.
По адсорбционной теории Фрейдлиха процесс коагуляции объяснялся только адсорбцией ионов на поверхности частиц и снижением при этом полного и электрокинетического потенциала.
Эти подходы объединила теория Б.В.Дерягина или теория ДЛФО (Дерягин, Ландау, Фервей, Овербек), которая получила широкое распространение для объяснения устойчивости и коагуляции дисперсных систем электронами.
Когда коллоидные частицы подходят очень близко друг к другу, их диффузионные слои перекрываются и взаимодействуют. Это взаимодействие совершается в тонкой прослойке дисперсионной среды, разделяющей частицы.
Устойчивость лиофобных золей определяется, главным образом, особыми свойствами этих тонких жидких слоев.
После образования тонкого жидкого слоя утончение его может продолжаться. И это еще больше сближает частицы.
Утончение жидкого слоя заканчивается либо разрывом его при некоторой малой толщине, либо достижением некоторой равновесной толщины, которая далее не уменьшается.
В первом случае частицы слипаются, а во втором – нет. Очевидно, что свойство тонкого жидкого слоя определяют, произойдет ли коагуляция, т.е. определяют устойчивость коллоидов.
Исследование показали, что утончение тонкого слоя при сближении частиц происходит путем вытекания из него жидкости.
Когда жидкий слой становится тонким (100-200нм), свойства жидкости в нем начинают сильно отличаться от свойств жидкости в окружающем объеме. В слое появляется дополнительное давление, которое Дерягин назвал «расклинивающим давлением».
По определению Дерягина, оно положительно, когда давление в слое понижено, это противодействует вытеканию из него жидкости, т.е. препятствует сближению частиц.
Отсюда происходит название «расклинивающее», т.е. давление, которое раздвигает, «расклинивает» частицы.
Расклинивающее давление может быть и отрицательным, т.е. повышать давление в слое, ускорять вытекание из него жидкости и способствовать сближению частиц.
Возникновение расклинивающего давления в тонких жидких слоях обусловлено двумя факторами:
Электростатическое взаимодействие в слое – это силы отталкивания с энергией Uот
ван-дер-ваальсовы силы притяжения с энергией Uпр
Результирующая энергия механического взаимодействия U определяется как сумма двух составляющих:
U=Uот +(-Uпр) = Uот - Uпр
Если | Uот | |Uпр |, то преобладают силы отталкивания, коагуляция не происходит, золь является агрегативно устойчивым.
В противоположном случае преобладают силы притяжения между частицами, происходит коагуляция.
Рассмотрим количественную интерпретацию этого слоя.
Электростатические силы отталкивания.
Электростатические силы отталкивания между мицеллами возникают при перекрывании диффузных слоев противоионов. Энергия этого взаимодействия:
Uот
= А
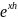
Где h – расстояние между частицами;
x
=
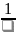 , величина, обратная толщине диффузного
слоя ;
, величина, обратная толщине диффузного
слоя ;
A – величина, независящая от h и определяемая параметрами ДЭС.
Эти величины могут быть рассчитаны на основе теории ДЭС.
Расчеты показали, что энергия отталкивания уменьшается:
- при увеличении зарядов противоионов и их концентраций;
- при уменьшении по абсолютной величине 0 и дзета-потенциала.
Ван-дер-Вальсовы силы притяжения.
Энергия притяжения связана с дисперсионным взаимодействием между молекулами. Она может быть рассчитана по уравнению:
Uпр=
-
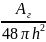 ;
;
Где
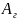 константа Гамакера
константа Гамакера
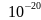 Дж.
Дж.
Результирующая энергия взаимодействия между частицами, находящимися на расстоянии h, определяется уравнением:
U
(h) = A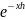 -
-
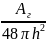
Т.к. характер зависимости от h для энергии притяжения и отталкивания различный, то зависимости суммарной потенциальной энергии межчастичного взаимодействия от расстояния между частицами имеет сложный характер.
Общий вид этой зависимости U= f(k) имеет график.
На графике есть три части:
0
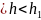 ,
U(h)
,
между частицами преобладают силы
притяжения, наблюдается ближний минимум.
Uот
,
U(h)
,
между частицами преобладают силы
притяжения, наблюдается ближний минимум.
Uот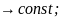 Uпр
Uпр
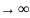 происходит
коагуляция.
происходит
коагуляция.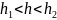 ,
U(h)
,между
частицами преобладает силы отталкивания,
Uот
,
U(h)
,между
частицами преобладает силы отталкивания,
Uот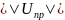
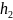
 обнаруживается
дальний минимум, но глубина его не
велика.
обнаруживается
дальний минимум, но глубина его не
велика.
При
h=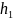 ,
,

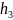 ,
,
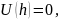 т.е. при этих расстояниях между частицами
силы притяжения уравновешиваются силами
отталкивания.
т.е. при этих расстояниях между частицами
силы притяжения уравновешиваются силами
отталкивания.
