
- •Устойчивость дисперсных систем.
- •Агрегативная устойчивость коллоидных растворов. Коагуляция.
- •Кинетика коагуляции электролитами.
- •Быстрая коагуляция.
- •Медленная коагуляция.
- •Факторы устойчивости лиофобных золей.
- •Виды коагуляции электролитами.
- •Защита коллоидных частиц.
- •Защитное действие некоторых вмс.
- •Теория устойчивости и коагуляции лиофобных дисперсных систем.
Медленная коагуляция.
Медленная коагуляция связана с неполной эффективностью столкновений, из-за существования энергетического барьера.
Совершенную теорию медленной коагуляции разработал Фукс. Он ввел в кинетическое уравнение коагуляции множитель, учитывающий энергетический барьер коагуляции ∆Uк:
KKM
= KKБ·P·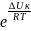 ,
,
где KKM ,KKБ - константы медленной и быстрой коагуляции,
P – стерический фактор.
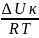 –потенциальный
барьер коагуляции (зависит от
дзета-потенциала)
–потенциальный
барьер коагуляции (зависит от
дзета-потенциала)
R
- постоянная Больцмана, R
=
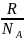 ,
,
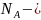 постоянная
Авогадро
постоянная
Авогадро
Факторы устойчивости лиофобных золей.
Факторы устойчивости, или коэффициент замедления W, показывает, во сколько раз константа скорости медленной коагуляции меньше константы скорости быстрой коагуляции.
W
=
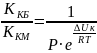 ,
,
Факторы агрегативной устойчивости дисперсной системы подразделяют на: - термодинамические
- кинетические.
Следует отметить пять факторов устойчивости:
Термодинамические
Электростатический фактор устойчивости.
Он обусловлен наличием ДЭС и дзета-потенциала на поверхности частиц дисперсной фазы.
Адсорбционно-сальватный фактор устойчивости.
Он обусловлен снижением поверхностного натяжения в результате взаимодействия дисперсионной среды с частицей дисперсной фазы. Этот фактор играет заметную роль, когда в качестве стабилизаторов используются коллоидные ПАВ.
Энтропийный фактор устойчивости.
Коагуляция
приводит к уменьшению числа частиц ,
следовательно ∆S 0,
из термодинамики приводит к увеличению
свободной энергии системы ∆G
0,
из термодинамики приводит к увеличению
свободной энергии системы ∆G .
Поэтому система самопроизвольно
стремиться оттолкнуть частицы друг от
друга и равномерно разделить по объему
системы. Этим обусловлен энтропийный
фактор устойчивости.
.
Поэтому система самопроизвольно
стремиться оттолкнуть частицы друг от
друга и равномерно разделить по объему
системы. Этим обусловлен энтропийный
фактор устойчивости.
Кинетические
Структурно-механический фактор устойчивости.
Он обусловлен тем, что на поверхности частиц дисперсной фазы образуются пленки, обладающие упругостью и механической прочностью, разрушение которых требует времени и затраты энергии. Этот фактор устойчивости реализуется в тех случаях, когда в качестве стабилизаторов используется ВМС.
Гидродинамический фактор устойчивости.
Гидродинамический фактор устойчивости, снижающий скорость агрегации, вследствие изменения плотности и динамической вязкости дисперсной среды и дисперсной фазы.
В реальных системах действуют несколько факторов устойчивости.
Виды коагуляции электролитами.
При коагуляции золя электролитами различают:
а) концентрационную коагуляцию;
б) нейтрализационную коагуляцию;
в) коагуляция смесью электролитов;
г) явление неправильных рядов.
а) концентрационная коагуляция имеет место, когда она происходит под действием индифферентного электролита, вследствие сжатия диффузного слоя противоионов и уменьшения абсолютного значения ε – дзета потенциала. (Индифферентный электролит – электролит не имеющий ионов, способных достраивать кристаллическую решетку коллоидных частиц.)
Рассмотрим концентрационную коагуляцию золя хлорида серебра, стабилизированного нитратом серебра, при введении в золь нитрата калия.
Формула мицеллы имеет вид:
{[mAgCl]
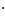 nAg+
· (n-x)
nAg+
· (n-x) }x+
· x
}x+
· x
Далее зарисуем следующий график, показывающий изменение потенциала в ДЭС мицеллы хлорида серебра.

Кривая 1 относится к исходной мицелле.
Кривая 2 после добавления KNO3 в количестве, вызывающем коагуляцию. При добавлении KNO3 диффузный слой противоинов сжимается, формула мицеллы имеет вид: {[mAgCl] nAg+ · n }
На рисунке б представлены потенциальные кривые характеризующие взаимодействие частиц в этом золе.
 Дзета-потенциал
исходной коллоидной частицы положительный,
это создает потенциальный барьер
коагуляции ∆Uк
(кривая
1). Поэтому при столкновении коллоидные
частицы отталкиваются друг от друга,
коагуляция не происходит.
Дзета-потенциал
исходной коллоидной частицы положительный,
это создает потенциальный барьер
коагуляции ∆Uк
(кривая
1). Поэтому при столкновении коллоидные
частицы отталкиваются друг от друга,
коагуляция не происходит.
После добавления нитрата калия дзета-потенциал становится равным нулю и ∆Uк=0 (кривая 2). Поэтому ничто не мешает коллоидным частицам сблизитьсяна на такое расстояние, где преобладают силы притяжения – происходит коагуляция. Т.к. в данном случае причиной коагуляции является увеличение концентрации противоионов, она называется концентрационной коагуляцией.
б) нейтрализационная коагуляция - происходит при добавлении к золю неиндифферентного электролита.
Неиндифферентный электролит – электролит, один из ионов которого способен достраивать кристаллическую решетку дисперсной фазы.
Если рассмотреть золь хлорида серебра, то для нейтрализации потенциалопределяющих ионов Ag+ в золь необходимо ввести хлорид калия. После добавления определенного количества этого неиндифферентного электролита мицелла будет иметь вид: {(m+n) AgCl}. В системе не будет ионов способных адсорбироваться на поверхности частицы AgCl, и поверхность станет электронейтральной.
При столкновении таких частиц происходит коагуляция. Т.к. причиной коагуляции в данном случае является нейтрализация потенциалопределяющих ионов, такую коагуляцию называют нейтрализационной коагуляцией.
в) коагуляция смесью электролитов.
Коагуляция смесью электролитов имеет большое практическое значение.
В технике для коагуляции часто применяют смесь двух электролитов.

При коагуляции золя смесью двух электролитов возможны три случая. На рисунке по оси абсцисс отложена концентрация первого электролита C1, а CK1 его порог коагуляции. Аналогично по оси ординат отложена концентрация второго электролита C2, а CK2 его порог коагуляции.
Аддитивное действие электролитов (1 линия) – электролиты действуют как бы независимо друг от друга;
Синергизм действия (2 линия) – электролиты как бы способствуют друг другу, и для коагуляции их требуется меньше;
Антагонизм действия (3 линия) – электролиты как бы противодействуют друг другу, и для коагуляции их следует добавить больше.
г) явление неправильных рядов – наблюдается при введении в коллоидную систему электролитов содержащих многовалентные ионы (Al+3). Заключается в том, что при добавлении к золю различных возрастающих количеств электролита, золь сначала устойчив, затем неустойчив, далее снова становится устойчив и затем наступает окончание коагуляции.
