
- •Устойчивость дисперсных систем.
- •Агрегативная устойчивость коллоидных растворов. Коагуляция.
- •Кинетика коагуляции электролитами.
- •Быстрая коагуляция.
- •Медленная коагуляция.
- •Факторы устойчивости лиофобных золей.
- •Виды коагуляции электролитами.
- •Защита коллоидных частиц.
- •Защитное действие некоторых вмс.
- •Теория устойчивости и коагуляции лиофобных дисперсных систем.
Устойчивость дисперсных систем.
Проблема устойчивости дисперсных систем является одной из важнейших в науке о дисперсных системах. Требования к устойчивости дисперсных систем могут быть различными.
Часто задачей технологов в самых различных отраслях промышленности является обеспечение предельно высокой устойчивости дисперсных систем (при получении покрышек, аэрозольных препаратов и др.)
В других случаях она нежелательна и требуется ликвидация их устойчивости (получение осадков, очистка сточных вод, разрушение кислотных туманов.)
Иногда нужно обеспечить оптимальный уровень устойчивости.
Для выяснения причин устойчивости необходимо ввести понятие о двух видах устойчивости, характерных для дисперсных систем.
Два вида устойчивости дисперсных систем.
Под устойчивостью вообще понимается постоянство во времени свойств системы, которые обеспечиваются степенью дисперсности системы и распределением в ней частиц по размерам.
Для дисперсных систем характерно проявление 2-х видов устойчивости - седиментационной и агрегативной.
Седиментационная (кинетическая) устойчивость - это способность системы противостоять осаждению частиц дисперсной фазы под действием силы тяжести (седиментация).
Агрегативная устойчивость - это способность системы противодействовать укрупнению частиц дисперсной фазы. Она обусловлена термодинамическими и кинетическими факторами.
Оба вида устойчивости (с и а) определяют срок хранения и качества многих веществ и материалов, в том числе и пищевых продуктов (соки, молочные продукты, майонез и т.д.)
Агрегативная устойчивость коллоидных растворов. Коагуляция.
Агрегативная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
При нарушении агрегативной устойчивости происходит коагуляция.
Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, т. к. частицы становятся слишком крупными и не могут участвовать в броуновском движении
Коагуляция является самопроизвольным процессом, т. к. она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Различают 2 стадии коагуляции:
1 стадия - скрытая коагуляция, на этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости;
2 стадия - явная коагуляция; на этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, то образуется осадок.
Причины коагуляции многообразны:
-внешнее воздействие;
- изменение температуры
- действие электрического и электромагнитного полей
- действие видимого света
- облучение элементарными частицами
- механическое воздействие
- добавление электролитов и др.
Особенно чувствительны золи к действию на них электролитов.
В зависимости от концентрации электролита коагуляция осуществляется в две стадии:
-медленную;
-быструю.
При медленной коагуляции изменение концентрации сопровождается резким изменением скорости коагуляции.
В области быстрой коагуляции увеличение концентрации электролита в коллоидной системе не вызывает изменения скорости коагуляции, достигшей своего максимального значения.
Заканчивается процесс коагуляции выпадением осадка – коагулят.
Наибольший практический интерес вызывает коагуляция электролитами.
Правила коагуляции.
Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию.
Минимальная концентрация электролита, при которой начинается коагуляция явная или быстрая, называется порогом коагуляции Ск (ϒ)
Иногда вместо порога коагуляции используют величину Vк , называемую коагулирующей способностью. Это объем золя, который коагулирует под действием 1 моля электролита:
Vк
=

Значит чем меньше порог коагуляции, тем больше коагулирующая способность электролита.
Коагулирующим действием обладают не все ионы электролита, а только те ионы, которые несут заряд, противоположный по знаку заряду коллоидной частицы. Таким образом, для дисперсных систем с отрицательно заряженными частицами коагулирующими ионами являются – катионы, а с положительными частицами – анионы.
Коагулирующая способность иона – коагулянта тем больше, чем больше заряд иона. Количественно эта закономерность описывается эмпирическим правилам Шульце-Гарди:
ϒ
=
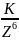
где Z заряд коагулирующего иона.
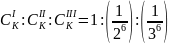 или
или
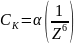
где
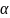 - постоянная для данной системы величина;
- постоянная для данной системы величина;
Z - заряд иона-коагулянта;
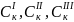 – порог
коагуляции одно зарядного, двух зарядного,
– порог
коагуляции одно зарядного, двух зарядного,
трех зарядного иона-коагулянта.
Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус. Поэтому коагулирующая способность органических ионов больше по сравнению с неорганическими ионами. Для однозарядных неорганических катионов коагулирующая способность убывает в следующем порядке:
Ag+ > Cs+ > Rb+>NH+>K+>Na+>Li+ (этот ряд называется лиотропным)
