
- •Федеральное агентство по образованию
- •Введение 4 Основные формулы 5 Примеры решения задач 9
- •Введение
- •Основные формулы
- •Примеры решения задач
- •1. Молекулярно-кинетическая теория идеальных газов
- •2. Основы термодинамики
- •Подставив данные, приведенные в условии задачи получим:
- •Решение:
- •Список литературы
- •Основы молекулярной физики и термодинамики методические указания
Примеры решения задач
1. Молекулярно-кинетическая теория идеальных газов
Задача 1. Определить, сколько киломолей и молекул водорода содержится в объеме 50 м3 под давлением 767 мм рт. ст. при температуре 18°С. Какова плотность и удельный объем газа?
|
Дано: V = 50 м3 Ρ = 767 мм. рт. ст. 767·133 Па Т = 291 К М = 2 кг/моль |
Решение: На основании уравнения Менделеева – Клайперона:
|
|
ν – ? N – ? ρ – ? d – ? |
можно определить ν:
![]()
Число молекул N, содержащихся в данном объеме, находим, используя число Авогадро NА (которое определяет какое количество молекул содержится в одном киломоле). Общее количество молекул, находящихся в массе m данного газа, может быть установлено, так как известно число молей ν.
![]()
Подставляя
в формулу число киломолей, устанавливаем
число молекул, содержащихся в объеме
V:
![]() .
.
Плотность газа ρ = m/V определяем из уравнения Менделеева - Клайперона:
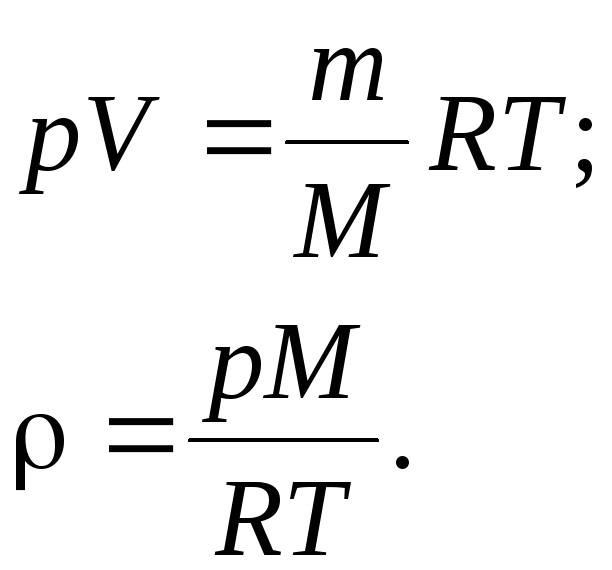
Подставляя числовые значения в единицах СИ в формулу, определим плотность газа:
![]()
Удельный объем газа d определяем из уравнения Менделеева - Клайперона:
(м3/кг).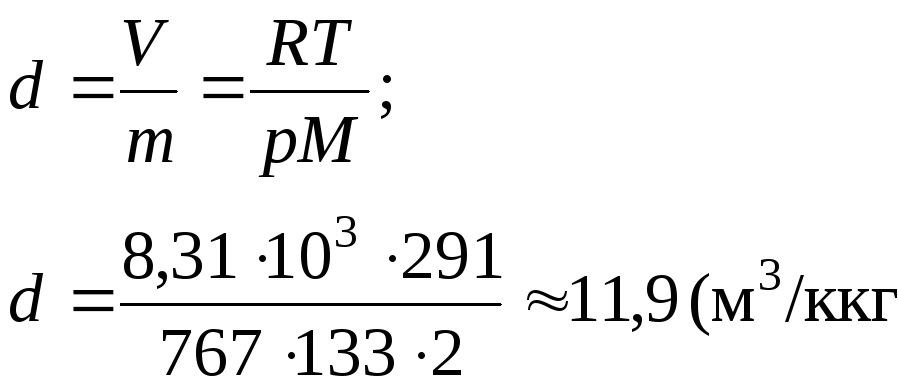
Ответ: 11,9 м3/кг.
Задача 2. В сосуде объемом 2 м3 находится смесь 4 кг гелия и 2 кг водорода при температуре 27°С. Определить давление и молярную массу смеси газов.
|
Дано: V = 2 м3 m1= 4 кг М1= 4·10-3 кг/кмоль m2= 2 кг М2= 2·10-3 кг/кмоль Т1= 300 К |
Решение: Воспользуемся уравнением Менделеева - Клайперона, применив его к гелию и водороду:
где р1 – парциальное давление гелия; m1 – масса гелия; |
|
р - ? М - ? |
М1 – его молярная масса; V – объем сосуда; Т – температура газа; R = 8,31 Дж/(моль·К) –молярная газовая постоянная; р2 – парциальное давление водорода; m2 – масса водорода; М2 – его молярная масса.
По
закону Дальтона:
![]() (3)
(3)
Из уравнений (1) и (2) выразим р1 и р2 и подставим в уравнение (3):
![]() (4)
(4)
С другой стороны, уравнение Менделеева - Клайперона для смеси газов имеет вид:
![]() (5)
(5)
Сравнивая (4) и (5) найдем молярную массу смеси газов по формуле:
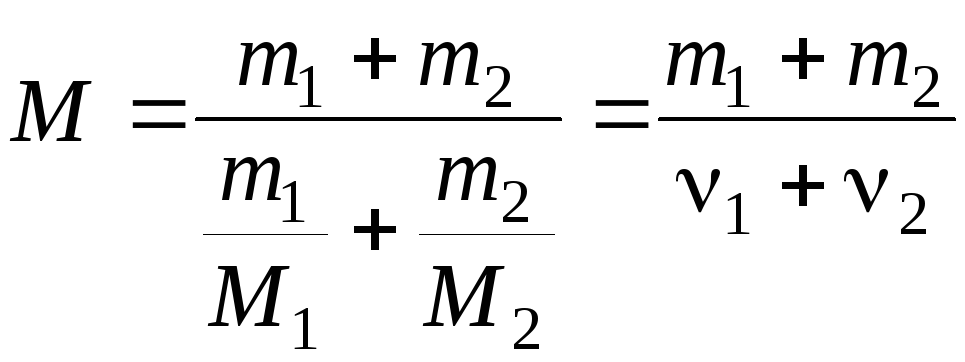 ,
(6)
,
(6)
где ν1 и ν2 – число молей гелия и водорода соответственно.
(кг/моль).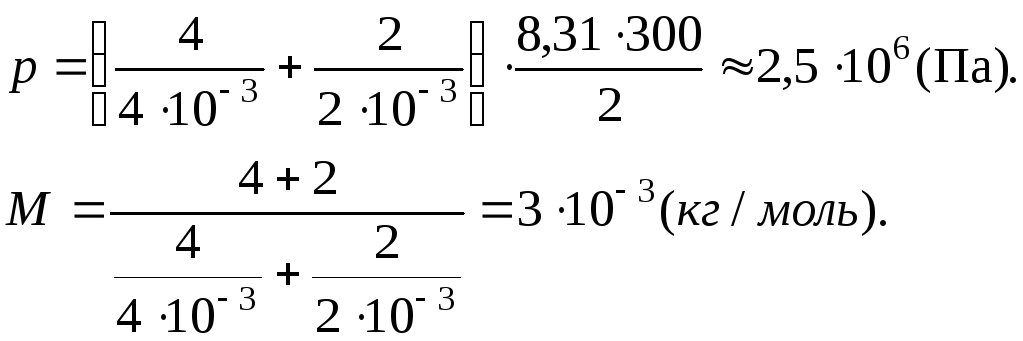
Ответ: 3·10-3 кг/моль.
Задача 3. При каком давлении средняя длина свободного пробега молекул водорода <λ> = 2,5 см при температуре 68°С? Диаметр молекул водорода принять равным d = 2,3·10 –10 м.
|
Дано: <λ>= 2,5·10-2 м Т= 341 К d= 2,3·10-10 м NA = 6,02·1026 кмоль-1 |
Решение: Давление водорода при температуре Т можно найти по уравнению Менделеева- Клайперона, в котором удобно ввести число молекул n0 в 1 м3. |
|
р – ? |
Это проводится следующим образом:
![]() ;
;
![]() ;
;
![]() ;
;
где NA – число Авогадро и k – постоянная Больцмана.
Следовательно,
![]() Так как
Так как![]() ,
имеем
,
имеем![]() .
.
Число
молекул в 1 м3
выразим через среднюю длину свободного
пробега. Из формулы
![]() ,
находим
,
находим
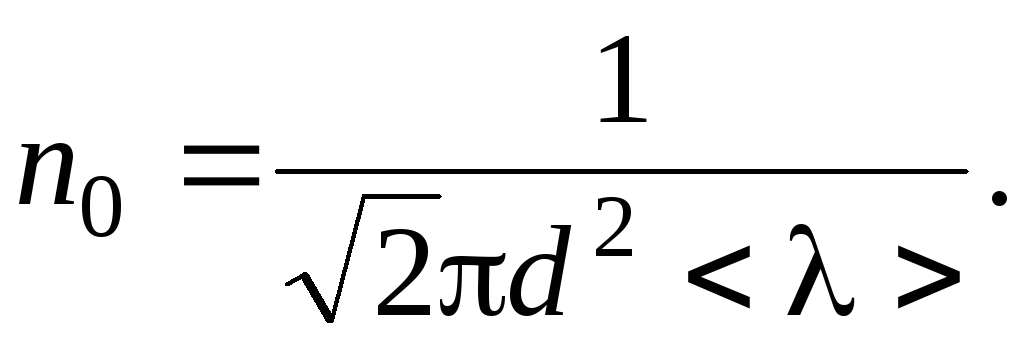 Таким
образом:
Таким
образом:
(Па).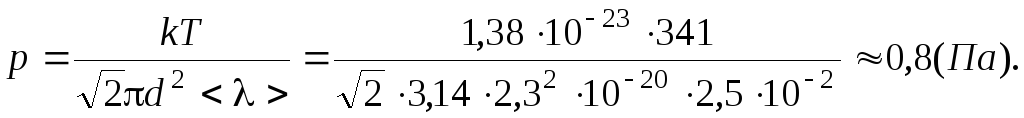
Ответ: 0,8 Па.
Задача 4. Определить плотность разреженного азота, если средняя длина свободного пробега молекул 10 см. Какова концентрация молекул?
|
Дано: < λ > = 10 см = 0,1 м |
Решение: Средняя длина пробега молекулы определяется формулой: |
|
р - ? n0 - ? |
![]() ,
(1)
,
(1)
где d – эффективный диаметр молекул (для азота d = 0,31·10 –9 м).
Концентрацию молекул найдем из равенства:
![]() , (2)
, (2)
где NA – число Авогадро; М = 28·10 –3 кг/моль – молярная масса азота.
Решая
совместно уравнения (1) и (2), находим: 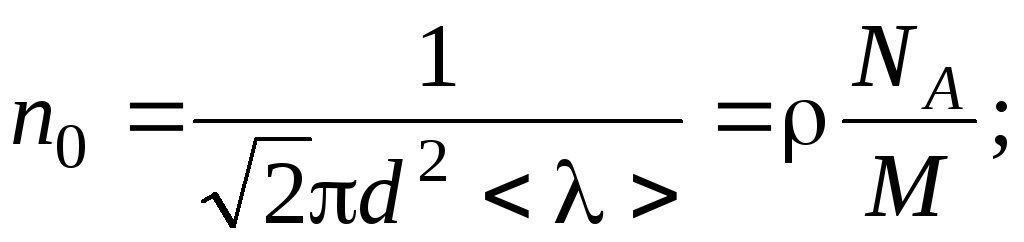
![]()
![]()
(кг/м3).![]()
Ответ: 1,09·10-6 кг/м3.
Задача 5. Вычислить коэффициент внутреннего трения и коэффициент диффузии кислорода, находящегося при давлении 0,2 МПа и температуре 280 К.
|
Дано: p = 2·105 Па d = 2,9·10-10 м М = 32·10-3 кг/моль Т = 280 К |
Решение: На основании представлений молекулярно – кинетической теории газов коэффициент внутреннего трения идеального газа (динамическая вязкость) и коэффициент диффузии определяются по формулам: |
|
η - ? D - ? |
![]() (1);
(1);
![]() (2),
(2),
где ρ – плотность газа; < λ > – средняя длина свободного пробега молекул; <υар> – средняя арифметическая скорость молекул.
Из
(1) и (2) следует ![]() (3)
(3)
Среднюю арифметическую скорость и среднюю длину свободного пробега молекул находим по формулам:
![]() (4)
(4)
![]() ,
(5)
,
(5)
где R = 8,31 Дж/(моль·К) – молярная газовая постоянная; Т – термодинамическая температура; d = 2,9·10 –10 м – эффективный диаметр молекулы кислорода; n0 – число молекул в 1 м3 (концентрация).
Из уравнения Менделеева - Клайперона определяем n0
(см. задачу
3):
![]() (6)
(6)
где р – давление; k = 1,38·10 –23 Дж/К – постоянная Больцмана.
Подставляя
(6) в уравнение (5), получаем:![]() . (7)
. (7)
Окончательный вид расчетной формулы для коэффициента диффузии найдем, подставляя выражения (4) и (7) в уравнение (2):
![]() .
(8)
.
(8)
Плотность
кислорода определяется по формуле:![]() .
С учетом (6) имеем:
.
С учетом (6) имеем:![]() . (9)
. (9)
Подставляя
(9) и (8) в (3), получаем расчетную формулу
для коэффициента внутреннего трения:
![]() .
.
Вычисляем:
![]()
![]()
Ответ:
![]() .
.
Задача 6. Наружная поверхность кирпичной стены площадью 25 м2 и толщиной 37 см имеет температуру 259 К, а внутренняя поверхность–293 К. Помещение отапливается электроплитой. Определить ее мощность, если температура в помещении поддерживается постоянной. Теплопроводность кирпича 0,4 Вт/(м·К).
|
Дано: S = 25 м2 D = 37 см = 0,37 м T1 = 259 K T2 = 293R χ = 0,4 Вт/(м·К) |
Решение: Количество теплоты, прошедшее через наружную стену, определим по закону Фурье:
где t – время протекания теплоты.
|
|
N - ? |
За
время t
– электроплита
должна выделить такое же количество
теплоты: ![]() (2)
(2)
Приравнивая правые части уравнений (1) и (2), получаем:
![]() ,
,
откуда
![]() ,
,
![]()
Ответ: 0,92 кВт.
