
- •Физика и химия высокомолекулярных соединений
- •Модуль 1. Основные понятия химии полимера их классификация и синтез методами радикальной и катионной полимеризации.
- •1.1. Основные понятия химии высокомолекулярных соединений
- •Основные понятия и определения.
- •Основные отличия высокомолекулярных соединений от низкомолекулярных соединений.
- •Основные понятия и определения.
- •1.1.2. Основные отличия высокомолекулярных соединений от низкомолекулярных соединений.
- •1.2. Классификация полимеров. Понятие конфигурации, конформации и гибкости полимеров.
- •1.2.3.Классификация полимеров в зависимости от формы макромолекулы.
- •1.2.4.Классификация полимеров в зависимости от природы расположения звеньев макромолекулы.
- •1.2.5. Классификация полимеров в зависимости от поведения при повышенных температурах.
- •1.2.6. Стереорегулярные полимеры.
- •1.2.7. Конфигурация полимеров.
- •1.2.8. Конформация полимеров.
- •1.2.9. Гибкость полимеров.
- •Понятие средней молекулярной массы полимеров.
- •Кривые молекулярно – массового распределения.
- •1.3.3. Среднечисловая молекулярная масса.
- •1.3.4. Среднемассовая молекулярная масса.
- •1.3.5. Средневязкостная молекулярная масса.
- •1.3.6. Понятие функциональности.
- •1.4. Методы синтеза полимеров. Радикальная полимеризация.
- •1.4.2. Мономеры, вступающие в радикальную полимеризацию.
- •1.4.3. Стадии радикальной полимеризации. Инициирование (термическое, окислительно-восстановительное, фотохимическое).
- •1.4.4. Рост цепи.
- •1.4.5. Обрыв цепи.
- •1.4.6. Передача цепи.
- •1.4.7. Регуляторы молекулярной массы полимера.
- •1.4.8. Ингибиторы реакции полимеризации.
- •1.5. Кинетика радикальной полимеризации. Влияние различных факторов на процесс радикальной полимеризации.
- •1.5.1. Кинетика радикальной полимеризации.
- •1.5.1. Кинетика радикальной полимеризации.
- •1.5.2. Влияние температуры на процесс радикальной полимеризации.
- •1.6. Радикальная сополимеризация. Способы проведения радикальной сополимеризации.
- •1.6.2. Кинетика радикальной сополимеризации.
- •1.6.3. Диаграмма состава сополимера от исходной смеси мономеров.
- •1.6.4. Определение констант сополимеризации методом Майо – Льюиса.
- •1.6.5. Определение констант сополимеризации методом Файмана - Росса.
- •1.6.6. Способы проведения полимеризации в блоке.
- •1.6.7. Способы проведения полимеризации в растворе.
- •1.6.8. Способы проведения полимеризации в эмульсии.
- •1.6.9. Способы проведения полимеризации в суспензии.
- •1.7. Катионная полимеризация.
- •1.7.2. Стадии катионной полимеризации (инициирование, рост цепи, передача цепи на мономер).
- •1.7.3. Кинетика катионной полимеризации.
- •Модуль 2. Синтез полимеров методом анионной полимеризации. Химическое превращение полимеров. Кристаллические и аморфные полимеры. Растворы полимеров. Отдельные представители.
- •2.1. Анионная полимеризация.
- •2.1.2. Стадии анионной полимеризации (инициирование, рост цепи, передача цепи на растворитель и на мономер).
- •2.1.3. Особенности анионной полимеризации. Скорость анионной полимеризации.
- •2.1.4. Анионная полимеризация в присутствии щелочных металлов, а также алкилов щелочных металлов.
- •2.1.5. Анионно-координационная полимеризация.
- •2.1.6. Ионно-координационная полимеризация.
- •2.2. Поликонденсация.
- •2.2.1. Мономеры, вступающие в реакцию поликонденсации.
- •2.2.2. Классификация поликонденсации (гомополиконденсация, гетерополиконденсация, линейная, трехмерная, циклополиконденсация, равновесная и неравновесная поликонденсации).
- •2.2.3. Основные отличия поликонденсации от полимеризации.
- •2.2.1. Мономеры, вступающие в реакцию поликонденсации.
- •2.2.2. Классификация поликонденсации (гомополиконденсация, гетерополиконденсация, линейная, трехмерная, циклополиконденсация, равновесная и неравновесная поликонденсации).
- •Основные отличия поликонденсации от полимеризации.
- •2.3. Влияние различных факторов на процесс поликонденсации.
- •2.3.2. Побочные реакции.
- •2.3.3. Кинетика линейной поликонденсации.
- •2.3.4. Способы проведения линейной поликонденсации.
- •2.5. Деструкция полимеров.
- •2.5.1. Химическая деструкция.
- •2.5.2. Окислительная деструкция.
- •2.5.3. Термическая деструкция.
- •2.5.4. Фотохимическая деструкция.
- •2.5.5. Действие ионизирующих излучений.
- •2.5.6. Механохимические процессы.
- •2.6. Структура макромолекул и физическое состояние аморфных полимеров.
- •2.6.2. Надмолекулярные структуры.
- •2.6.3. Три физических состояния аморфных полимеров.
- •2.6.4. Стеклообразное состояние.
- •2.6.5. Высокоэластическое состояние.
- •2.6.5. Вязкотекучее состояние.
- •2.6.6.Релаксация напряжения.
- •2.7. Растворы полимеров.
- •2.7.2. Признаки растворов.
- •2.7.3. Особенности процесса растворения полимеров.
- •2.7.4. Термодинамика растворения полимеров.
- •2.7.5. Факторы, влияющие на растворение и набухание полимеров.
- •2.7.6. Уравнение состояния полимера в растворе.
- •2.7.7. Гидродинамические свойства макромолекул в разбавленных растворах.
- •2.7.8. Фракционирование полимеров.
- •2.8. Основные представители полимеров.
- •2.8.2. Галогенпроизводные представители углеводородов.
- •2.8.3. Ароматические углеводороды.
- •2.8.4. Сложные полиэфиры. Полиэтилентерефталат (лавсан).
- •2.8.5. Синтетические полиамиды.
- •2.8.6. Полиуретаны.
2.2. Поликонденсация.
2.2.1. Мономеры, вступающие в реакцию поликонденсации.
2.2.2. Классификация поликонденсации (гомополиконденсация, гетерополиконденсация, линейная, трехмерная, циклополиконденсация, равновесная и неравновесная поликонденсации).
2.2.3. Основные отличия поликонденсации от полимеризации.
Поликонденсация – это процесс образования макромолекул из би- и полифункциональных соединений, сопровождающихся отщеплением низкомолекулярных соединений (воды, NH , C2H5OH (R-OH), HCl). В качестве мономеров используются соединения, содержащие в молекуле не менее двух функциональных групп.
n a–A–a + n b–B–b → a [-A-B-] b + (2n - 1) ab, где
а, в – функциональные группы (-OH, -NH , -COOH, -COCl ).
аb - низкомолекулярные соединения, которые выделяются (H2O, NH3, HCl).
2.2.1. Мономеры, вступающие в реакцию поликонденсации.
В качестве мономеров для поликонденсации используются соединения, содержащие в молекуле не менее двух функциональных групп.
1. Гликоли, содержащие гидроксильные группы (-ОН):
HO-CH2-CH2-OH HO- CH2-CH(OH)-CH2-OH
этиленгликоль глицерин
1,2-этандиол 1,2,3-пропантриол
2. Диамины, содержащие аминогруппы (-NH2 ):
NH2-(CH2)6-NH2
гексаметилендиамин
3. Дикарбоновые кислоты, содержащие группы (–СООН):

терефталевая кислота
4. Дихлорангидриды карбоновых кислот, содержащие хлорангидридные группы (–СОСl):
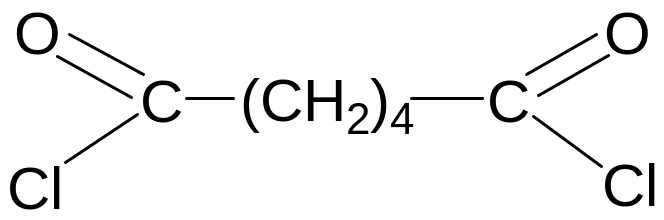
дихлорангидрид адипиновой кислоты
5. Диизоцианаты, содержащие изоцианатные группы (–N=C=O):
O=C=N – (CH2)6 – N=C=O
гексаметилендиизоцианат
2.2.2. Классификация поликонденсации (гомополиконденсация, гетерополиконденсация, линейная, трехмерная, циклополиконденсация, равновесная и неравновесная поликонденсации).
Процесс поликонденсации, в котором участвуют однородные мономеры, называется гомополиконденсацией. Например, реакция полиамидирования:
n H N - R - COOH →H[-HN - R - CO-] OH + n H O.
аминокислота полиамид
Процесс поликонденсации, в котором участвуют разнородные мономеры, называется гетерополиконденсацией. Например, реакция полиамидирования:
n H2N-R-NH + n HOOC-R`-COOH → H[-HN- R-NH-CO-R`-CO-] OH + (2n- 1) H2O
диамин дикарбоновая кислота полиамид
Реакция поликонденсации бифункциональных соединений, то есть бифункциональных мономеров, приводящая к образованию линейных полимеров, называется линейной поликонденсацией.
Поликонденсация мономеров, содержащих более двух функциональных групп, приводящих к образованию разветвленных или сетчатых полимеров, называется трехмерной поликонденсацией. Например, образование фенолформальдегидных, глифталевых смол. Двухступенчатая реакция, в которой образовавшийся на первой стадии продукт линейной поликонденсации, на второй стадии подвергается внутримолекулярной циклизации, называется циклополиконденсацией.
Поликонденсация в зависимости от значения константы равновесия (Кравн) подразделяется на равновесную (обратимую) и неравновесную (необратимую).
Константа равновесия равна отношению концентрации продуктов реакции к концентрации исходных реагентов.
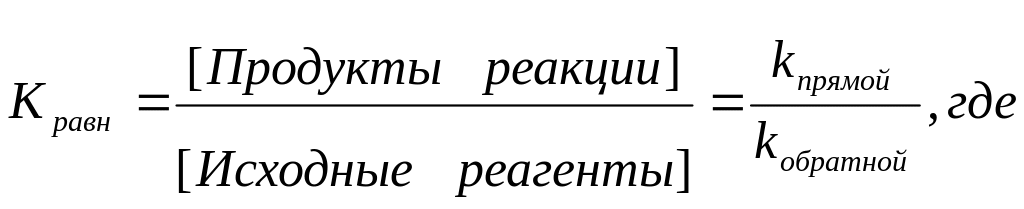 k-
константа скорости реакции.
k-
константа скорости реакции.
Если Кравн = 1 , то система находится в состоянии равновесия.
К необратимой поликонденсации относится поликонденсация с константой равновесия
Кравн
>10![]() (например, синтез фенолформальдегидных
смол сетчатого строения), а к обратимой
относится поликонденсация с константой
равновесия Кравн
<10
(обычно 0,1 или 10). Например, синтез
полиамидов и полиэфиров.
(например, синтез фенолформальдегидных
смол сетчатого строения), а к обратимой
относится поликонденсация с константой
равновесия Кравн
<10
(обычно 0,1 или 10). Например, синтез
полиамидов и полиэфиров.
При неравновесной поликонденсации обычно образуются значительно более высокомолекулярные полимеры (с молекулярной массой ≥100000), чем при равновесной поликонденсации (молекулярная масса от 20000 до 70000). Обратимый характер реакции поликонденсации объясняется тем, что может протекать не только прямая реакция образования полимера, но и обратная реакция за счет взаимодействия полимера с выделяющимся низкомолекулярным соединением. Этим объясняется тот факт, что молекулярная масса полимера при поликонденсации растет не до бесконечности, а получается полимер с ограниченной молекулярной массой. Удаляя из сферы реакции выделяющиеся низкомолекулярные соединения, можно сместить равновесие в сторону образования продуктов реакции, и получить полимер с более высокой молекулярной массой.
По характеру функциональных групп, взаимодействующих между собой при поликонденсации, мономеры подразделяются на:
Мономеры с однородными функциональными группами.
Например, образование простых эфиров:
n НО- СН2-СН2-ОН → Н-[-О-СН2-СН2-]n-ОН + n Н2О
этиленгликоль полиэфир
1,2- этандиол
2) Мономеры, содержащие в молекуле разнородные функциональные группы.
Например, образование полиамидов:
n НООС- R – NН2 → НО- [-ОС- R- NН-]n-Н + n Н2О
аминокарбоновая кислота полиамид
Получение полигексаметиленадипамида (анида,найлона-6,6):
1. n Н2N-(CH2)6-NH2 + n HOOC-(CH2)4-COOH →
гексаметилендиамин адипиновая кислота
→ H-[-HN-(CH2)6-NH-OC-(CH2)4-CO-]n-OH + (2n-1) H2O
полигексаметиленадипамид (анид, найлон-6,6).
2. n Н2N-(CH2)6-NH2 + n ClOC-(CH2)4-COCl →
гексаметилендиамин дихлорангидрид адипиновой кислоты
→ H-[-HN-(CH2)6-NH-OC-(CH2)4-CO-]n-Cl + (2n-1) HCl
полигексаметиленадипамид (анид, найлон-6,6).
Получение поли--капроамида (капрона):
n H N –(СН2)5 - COOH →H[-HN – (СН2)5 - COO-] OH + n H O
аминокапроновая кислота поли--капрамид (капрон)
Получение полиэфиров.
Получение полиэтилентерефталата (лавсана):
n НО- СН2-СН2-ОН + n HOOC-(C6H4)-COOH →
этиленгликоль,1,2- этандиол терефталевая кислота
→ H-[-О-(CH2-СН2-О-OC-(C6H4)-CO-]n-OH + (2n-1) H2O
полиэтилентерефталат (лавсан)
Лавсан расшифровывается, как «Лаборатория высокомолекулярных соединений Академии Наук».
Получение полиуретанов:
n O=C=N- R- N=C=O + n НО- R1-ОН → [-CO-NH-R-NH-CO-O-R1-O-]n-
диизоцианат гликоль полиуретан
