
- •Антикоррозионная защита. Виды и классификация защитных покрытий, способы их нанесения и применение.
- •Минеральные вяжущие[править | править вики-текст]
- •Содержание
- •Гидролиз солей[править | править вики-текст]
- •Степень гидролиза[править | править вики-текст]
- •Константа гидролиза[править | править вики-текст]
Влияние температуры на количество столкновений молекул может быть показано с помощью модели. В первом приближении влияние температуры на скорость реакций определяется правилом Вант-Гоффа (сформулировано Я. Х. Вант-Гоффом на основании экспериментального изучения множества реакций):
В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
|
где - tтемпературный коэффициент, принимающий значения от 2 до 4.
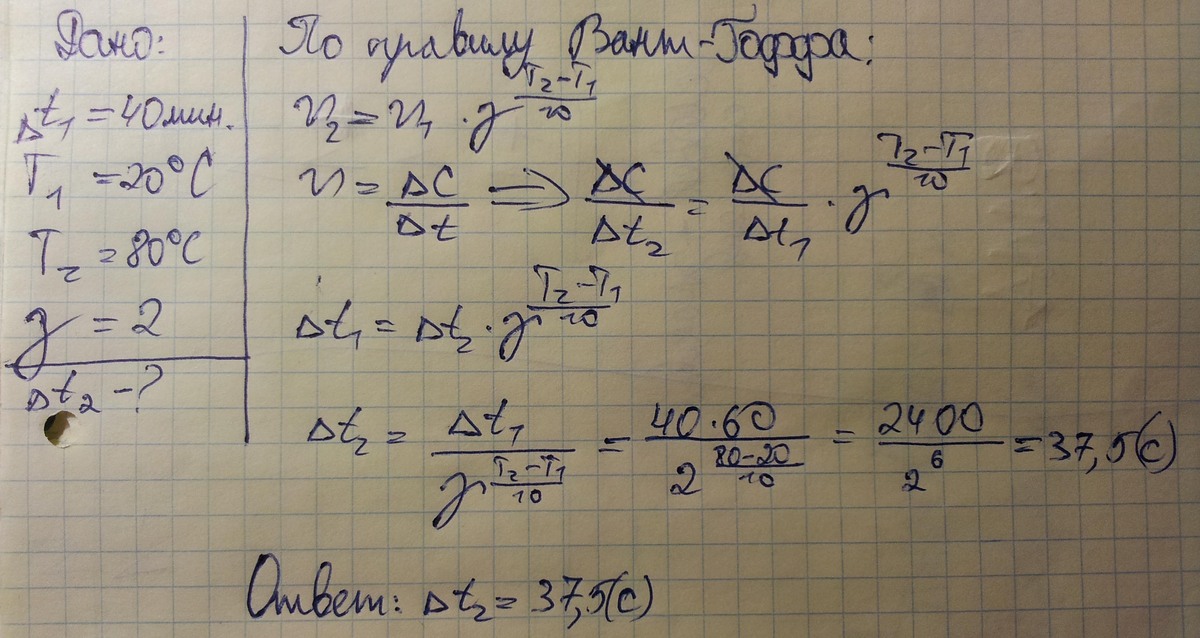
Степень
диссоциации равна отношению числа
продиссоциированных молекул вещества ![]() к
общему числу его молекул
к
общему числу его молекул ![]() .
Выражается в долях или процентах.
.
Выражается в долях или процентах.
![]()
Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Пример. Для уксусной
кислоты CH3COOH
величина ![]() равна
4% (в 0.1 М растворе).
Это значит, что в водном растворе кислоты
лишь 4 из каждых 100 молекул диссоциированы,
то есть находятся в виде ионов Н+ и
СН3СОО−,
остальные же 96 молекул не диссоциированы.
равна
4% (в 0.1 М растворе).
Это значит, что в водном растворе кислоты
лишь 4 из каждых 100 молекул диссоциированы,
то есть находятся в виде ионов Н+ и
СН3СОО−,
остальные же 96 молекул не диссоциированы.
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как например когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы. Константа диссоциации обычно обозначается Kd иобратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
В общей реакции
![]()
где
комплекс ![]() разбивается
на x единиц
A и y единиц
B, константа диссоциации определяется
так:
разбивается
на x единиц
A и y единиц
B, константа диссоциации определяется
так:
![]()
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
![]()
Здесь ![]() — константа
диссоциации электролита,
— константа
диссоциации электролита, ![]() —
концентрация,
—
концентрация, ![]() и
и ![]() —
значения эквивалентной электропроводности
при концентрации
и
при бесконечном разбавлении соответственно.
Соотношение является следствием закона
действующих масс и
равенства
—
значения эквивалентной электропроводности
при концентрации
и
при бесконечном разбавлении соответственно.
Соотношение является следствием закона
действующих масс и
равенства
![]()
где — степень диссоциации.
Антикоррозионная защита. Виды и классификация защитных покрытий, способы их нанесения и применение.
Один из путей увеличения срока службы строительных металлоконструкций и коммуникаций – повышение эффективности антикоррозионной защиты. Ежегодно в мире вследствие коррозионных разрушений несут большие потери технологическое оборудование, строительные металлоконструкции и коммуникации. В связи с увеличением объемов применения металлоконструкций возрастает значение антикоррозионной защиты. Защитные покрытия – это слои, искусственно создаваемые на поверхности металлических изделий с целью предохранения их от коррозии. В зависимости от материала они разделяются на несколько групп. Металлические покрытия- Материалами для металлических защитных покрытий могут быть как чистые металлы – (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так же и их сплавы – (латунь, бронза и др.). Широко применяются гальванические способы, нанесенные горячим и диффузионным способами, а также металлизацией. Гальванические защитные покрытия – тонкие прочно сцепленные с основным материалом металлические покрытия, получаемые электролитическим осаждением металлов на защищаемой поверхности. Защитное действие гальванических покрытий при их плотной мелкокристаллической структуре определяется их толщиной. Минимальная толщина цинковых покрытий для защиты стальных изделий в зависимости от условий работы изделий устанавливается 5, 15 и 30 мк. Для защиты изделий от потускнения дополнительно наносится слой хрома толщиной до 1 мк. При защитно-декоративном покрытии стальных изделий суммарная толщина меди - никеля должна быть 10,30 и 50 мк. Изделия из цинкового сплава рекомендуется покрывать слоями той же толщины. Толщина свинцовых покрытий, применяемых для защиты от серной кислоты, сернистых газов и различных сернокислых соединений измеряется сотыми, а иногда десятыми долями мм. Хромовые покрытия применяемые наряду с защитой механического износа также для защиты стали от коррозии, имеют толщину 50,100 и 200 мк. Защитные покрытия получаемые горячим способом :
Цинкование — проводится путем погружения предварительно обезжиренных, травленых и промытых железных изделий (листов, труб) сначала в слой флюса и глицерин, а затем в расплавленный цинк и другие составляющие. Вес цинкового покрытия 300—700 г/м2 , толщина образующегося слоя 20—30 мк. Лужение—по технологии сходно с цинкованием; вес покрытия 27—45 г/м2, толщина 3—5 мк. Применяется для покрытия консервных банок, молочной посуды, пищеварных котлов, медных кабелей и др. Покрытие свинцом — по технологии сходно с цинкованием. В ванну, кроме свинца, обычно добавляют 10—25% олова (реже сурьму или кадмий). Применяется для обработки стальной проволоки, в качестве оболочек на кабелях, для покрытия сосудов в химической промышленности. Для тары и емкостей, предназначенных для пищевых продуктов, освинцевание не применяется, т. к. соли свинца ядовиты.
Алитирование — проводится при 700- 800° в сплаве алюминия с железом (8—9% железа) в продолжении 1-30 мин; поверх сплава — слой флюса. Технология алитирования аналогична цинкованию. Толщина образующегося на железе диффузионного слоя (сплав железа и алюминия) 20—150 мк. Алитирование применяется для обработки труб, листов, инструмента для литья цветных металлов, головок клапанов и др.; повышает окалиностойкость и коррозионную устойчивость стали и чугуна. Горячие способы получения защитных покрытий применяются также для нанесения эмалевых слоев на поверхность железных и чугунных изделий (химическая аппаратура, посуда, трубы) путем расплавления смесей некоторых окислов и неорганических солей. Защитные покрытия, получаемые диффузионным способом:
Азотирование— проводится в среде аммиака при 600—650° в продолжении 40—60 мин (реже при 800—820° в течение 5—10 мин). На поверхности стали образуется тонкий (0,01—0,02 мм) нитридный слой, обладающий повышенной хрупкостью на углах деталей. Азотирование применяется для обработки болтов, тяг, вентилей, деталей приборов и др. Азотированный слой устойчив во влажной воздушной атмосфере, воде, бензине, неочищенном масле, перегретом паре и др.; неустойчив — в кислотах и морской воде.
Цинкование — проводится при 380—390° в печах с вращающимися ретортами или в ящиках, куда вводится порошок цинковой пыли. В ретортных печах слой толщиной 15—20 мк достигается за 1 час (в ящиках за 2 часа). Коррозионная устойчивость обработанных таким образом деталей не уступает коррозионной устойчивости гальванически обработанных деталей, причем стоимость диффузионной обработки ниже гальванической. При пассивировании деталей, подвергнутых диффузионному цинкованию, их коррозионная устойчивость повышается. При диффузионном цинковании стали при 750—900° в атмосфере паров цинка обработанные, детали устойчивы при 590 — 550" в газовой среде.
Хромирование — проводится при температуре 950—1050°: в порошкообразной смеси, состоящей из 60% феррохрома или в порошке хрома, или феррохрома и в вакууме. Слой глубиной 0,1 ммна стали образуется в течение 5—10 часов. Хромированные детали обладают окалиностонкостью (до 800"), повышенной устойчивостью в азотной и уксусной кислотах. Диффузионное хромирование применяется для труб теплообменников, электродов автомобильных свечей, различных промышленных деталей и др.
Металлизация — способ получения металлических защитных покрытий на различных сооружениях (мосты, детали судов, большие баки и др.); при этом способе расплавленный металл распыляется (пульверизуется) с помощью особого прибора — металлизатора. Частички металла, вылетающие с большой скоростью из сопла аппарата, осаждаются на поверхности изделия и создают защитное покрытие. Металлизацию широко применяют для получения цинковых, свинцовых и алюминиевых покрытий.
У хрома потенциал -0,74, а у железа -0,44, т. о. хром более активен, п. э. в случае электрохимической коррозии хром будет отдавать электроны железу (т. е. будет растворимым анодом) , а железо, получая электроны, зарядится отрицательно, т. е. будет катодом.. . ЭДС = -0,44-(-0,74)=0,3 На аноде: Cr-2e --> Cr(2+) На катоде: 1/2О2 + Н2О + 2e ---> 2OH(-)
Вяжущие вещества — вещества, способные затвердевать в результате физико-химических процессов. Переходя из тестообразного в камневидное состояние, вяжущее вещество скрепляет между собой камни либо зёрна заполнителя. Это свойство вяжущих используется для изготовления строительных растворов — кладочных, штукатурных и специальных, а также бетонов, силикатного кирпича, асбоцементных и других необожжённых искусственных материалов.
Вяжущие вещества по составу делятся на органические и неорганические (минеральные). К органическим относятся битумы, дёгти, животный клей, полимеры. Они переходят в рабочее состояние нагреванием, расплавлением или растворением в органических жидкостях. К неорганическим относятся известь, цемент, строительный гипс,магнезиальный цемент, жидкое стекло и др. Они обычно затворяются водой, реже водными растворами солей. В свою очередь делятся на воздушные, гидравлические, кислостойкие вяжущие вещества и вяжущие автоклавного твердения.
