
- •4. Уравнение Гей-Люсака.
- •6. Уравнение состояния газа Ван-дер-Ваальса.
- •10. Применение первого закона термодинамики к различным процессам. Энтальпия и ее физический смысл.
- •11. Закон Гесса – следствие первого начала термодинамики. Стандартные энтальпии образования. Стандартные энтальпии сгорания.
- •12. Обратимые и необратимые в термодинамическом смысле процессы; самопроизвольные процессы, максимальная и максимально полезная работа.
- •14. Изменение энтропии изолированной системы; критерии достижения термодинамического равновесия в изолированной системе.
- •15. Основной смысл и значение второго закона термодинамики.
- •16. Статистическая природа второго начала термодинамики.
- •1) Расчеты изменения энтропии при изотермических процессах
- •2) Расчет изменения энтропии в неизотермических процессах
- •3) Расчет изменения энтропии сложного процесса
- •19. Особенности термодинамического описания процессов в закрытых и открытых системах. Клетка как пример открытой системы.
- •21. Взаимосвязи между внутренней энергией, работой и "связанной энергией" в изобарно-изотермическом процессе.
- •22. Химический потенциал как мера изменения энергии системы за счет изменения массы исходных и конечных продуктов реакции.
- •23. Уравнение изотермы химической реакции (Закон действующих масс).
- •24. Зависимость константы химического равновесия от температуры. Интегральная и дифференциальная форма уравнения изобары.
- •25. Взаимосвязь между константой химического равновесия и изобарно-изотермическим потенциалом.
- •28. Уравнение Клаузиса-Клапейрона, 1-ое и 2-ое уравнения Рауля.
- •29. Коллигативные свойства растворов (температура кипения, температура замерзания, осмотическое давление, давление насыщенного пара).
- •33. Основы теории сильных электролитов. Активность, коэффициенты активности.
- •35. Особенности описания свойств сильных электролитов при физиологических значениях ионной силы.
- •34. Уравнение Дебая-Хюккеля и пределы его применения.
- •36. Буферные растворы и механизм их действия. Буферные системы организма.
- •37. Механизм химической реакции как совокупность отдельных элементарных стадий.
- •38. Скорость химической реакции и понятие лимитирующей стадии процесса.
- •39. Порядок и молекулярность реакции. Применение порядка химической реакции для описания ее механизма.
- •40. Количественные соотношения между скоростью химической реакции и концентрацией реагентов в зависимости от порядка химической реакции.
- •41. Теория активных соударений (Аррениуса). Понятие об энергии активации и ориентационном (вероятностном) факторе. Ограничения теории активных соударений.
- •43. Термодинамическая форма основного уравнения теории переходного комплекса
- •44. Сравнительный анализ теории активных соударений и теории переходного комплекса
- •45.Кислотно-основной катализ как пример гомогенных каталитических процессов.
- •47. Сравнительный анализ мультиплетной теории гетерогенного катализа и теории активных ансамблей (Кобозев).
- •48. Ферменты – биологические катализаторы. Основные факторы, определяющие сложный характер зависимости скорости реакции ферментативного процесса от концентрации субстрата.
- •49. Уравнение Михаэлиса-Ментен, условия его применения
- •51. Основные способы линерилизации уравнения Михаэлиса-Ментен для графического определения величин Km и Vmax. Сравнительный анализ их преимуществ и недостатков.
- •52. Окислительно-восстановительные реакции и электрохимия. Классификация и характеристика электрохимических процессов.
- •53. Механизм возникновения потенциала Нернста (электродный потенциал).
- •54.Диффузный потенциал, механизм возникновения и биологическая значимость.
- •55. Межжидкостный фазовый потенциал, механизм возникновения и биологическая значимость.
- •56.Электрохимические элементы и их использование в биологических исследованиях
- •57. Типы электродов(электроды 1,2 типа и редокс-электроды).
- •58. Электродные реакции, правила записи и потенциалообразующие ионы в случае электродов разных типов
- •59. Уравнение Нернста для электродов разных типов: стандарт электроды, стандартный водородный электрод.
- •60. Примеры использования электрохимических элементов в биологических исследованиях.
- •61.Поверхностные явления и адсорбция. Обзор сорбционных явлений.
- •62. Природа адсорбционного взаимодействия. Поверхностное натяжение и природа вещества.
- •63. Равновесие фаз при искривлённой поверхности раздела. Уравнение Лапласса.
- •64. Уравнение Томпсона и его следствия.
- •65. Роль сорбционных явлений в биологии.
- •66. Связь между уравнением Ленгмюра и уравнением адсорбции по Гиббсу.
- •67.Основные направления исследований и задачи коллоидной химии.
- •68. Классификация коллоидных систем по кинетическим свойствам дисперсной фазы, по размеру частиц дисперсной фазы, по агрегатному состоянию дисперсной фазы и дисперсной среды.
- •69. Коллоидные растворы и их основные свойства. Явление электрофореза.
- •70. Диализ и электродиализ как способы очистки коллоидных растворов от примесей.
- •71. Оптические свойства коллоидных растворов. Уравнение Рэллея и условия его применения.
- •72. Голубизна неба, красный закат как отражение оптических свойств коллоидных систем.
- •73. Молекулярно-кинетические свойства коллоидных растворов.
- •74. Описание механизма броуновского движения как основы молекулярно-кинетической теории строения вещества.
- •75. Уравнения Эйнштейна, Смолуховского и их использование для доказательства молекулярно-кинетической теории строения вещества.
- •76.Кинетическая устойчивость дисперсионных систем и седиментационное равновесие.
- •77. Седиментационное равновесие. Скорость оседания (всплытия) частиц дисперсной фазы. Методы достижения седиментационного равновесия.
- •78. Строение коллоидных частиц.
- •79.Электроосмос и электрофорез. Электрокинетический потенциал и механизм его возникновения
- •80.Равновесие Гиббса-Доннана и его значение для поддержания постоянного солевого состава клетки
- •81. Лиофобные и лиофильные коллоидные системы. Основные причины высокой термодинамической устойчивости лиофильных коллоидых систем.
- •82. Агрегативная устойчивость коллоидных систем
- •84. Свойства растворов высокомолекулярных соединений.
37. Механизм химической реакции как совокупность отдельных элементарных стадий.
Химические реакции, как правило, не происходят путем непосредственного взаимодействия исходных молекул с прямым переходом их в молекулы продуктов реакции. В большинстве случаев реакции протекают в несколько стадий. Например, окисление ионов двухвалентного железа в кислом растворе молекулярным кислородом состоит из ряда стадий:
Fe2+ + O2 Fe3+ + O2-
O2- + H+ HO2·
Fe2+ + HO2· Fe3+ + HO2-
HO2- + H+ H2O2
H2O2 + Fe2+ Fe3+ + OH- + OH·
Fe2+ + OH· Fe3+ + OH-
OH- + H+ H2O.
Общее стехиометрическое уравнение реакции:
4Fe2+ + 4H+ + O2 4Fe3+ + 2H2O.
Этот сложный путь оказывается, тем не менее, неизмеримо более выгодным, так как ни на одном из семи этапов не требуется встречи более чем двух частиц и ни на одном из этапов не требуется соударения одноименно заряженных частиц.
Совокупность стадий, из которых складывается химическая реакция, носит название механизма химической реакции.
Вещества, вступающие в процесс химического превращения, называются исходными. Вещества, образующиеся в процессе химического превращения и не претерпевающие в ходе этого процесса дальнейших химических изменений, называются продуктами реакции. Вещества, образующиеся в одних стадиях процесса химического превращения и расходующиеся в других стадиях этого же процесса, называют промежуточными веществами.
38. Скорость химической реакции и понятие лимитирующей стадии процесса.
Важнейшей
количественной характеристикой процесса
химического превращения является
скорость процесса. Понятие скорости
характеризует количество вещества,
вступающего в реакцию в единицу
времени. Это определение, однако, не
совсем однозначно, так как в реакции
принимают участие несколько веществ
в качестве исходных, промежуточных
и в качестве продуктов реакции.
Поэтому строго можно говорить не о
скорости химического процесса вообще,
а о скорости по некоторому компоненту.
Изменение количества этого компонента
принято выражать в числе молей n.
Таким образом, для гомофазного химического
процесса, идущего при постоянном объеме,
скоростью процесса по некоторому
веществу называется изменение
концентрации этого вещества в единицу
времени. Пусть концентрация одного из
реагирующих веществ в момент времени
t1 равна С1,
а в момент времени t2
равна С2. Тогда средняя
скорость реакции (V
) за промежуток времени t2
– t1 равна
 . (8.1)Поскольку
концентрация вещества (исходного) в
процессе реакции убывает, то C2
C1 и
разность C2 – C1
имеет отрицательный знак, т.е. C2
– C1 = -С.
Отсюда средняя скорость
. (8.1)Поскольку
концентрация вещества (исходного) в
процессе реакции убывает, то C2
C1 и
разность C2 – C1
имеет отрицательный знак, т.е. C2
– C1 = -С.
Отсюда средняя скорость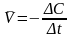 . (8.2)
Переходя к бесконечно малым изменениям,
можно отношение -
. (8.2)
Переходя к бесконечно малым изменениям,
можно отношение -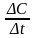 заменить на -
заменить на - .
В результате производная от
концентрации по времени характеризует
мгновенную (истинную) скорость химической
реакции:
.
В результате производная от
концентрации по времени характеризует
мгновенную (истинную) скорость химической
реакции: . (8.3)
Скорость химической реакции всегда
является величиной положительной,
отношение же dC/dt может иметь и
положительное, и отрицательное значение
в зависимости от того, представляет
С концентрацию одного из исходных
веществ или одного из продуктов реакции.
В первом случае dC/dt
0, но так как скорость должна быть
положительной, перед производной ставят
минус; во втором случае dС/dt
0, и чтобы скорость реакции имела
положительное значение, берут производную
со знаком плюс. В общем случае кинетическое
уравнение имеет вид
. (8.3)
Скорость химической реакции всегда
является величиной положительной,
отношение же dC/dt может иметь и
положительное, и отрицательное значение
в зависимости от того, представляет
С концентрацию одного из исходных
веществ или одного из продуктов реакции.
В первом случае dC/dt
0, но так как скорость должна быть
положительной, перед производной ставят
минус; во втором случае dС/dt
0, и чтобы скорость реакции имела
положительное значение, берут производную
со знаком плюс. В общем случае кинетическое
уравнение имеет вид . (8.4)
Однако необходимо учитывать, что
измеренные по разным веществам скорости
не равны, а пропорциональны одна
другой. Например, в реакции синтеза
аммиака N2
+ 3H2
2HN3 на
каждый исчезающий моль N2 расходуется
3 моля H2 и образуется 2 моля аммиака.
Соответствующие скорости реакции
соотносятся как 1: 3: 2.Скорость реакции
имеет размерность [концентр]
[время]-1. В химической кинетике
концентрацию чаще всего выражают
в моль/л, а время – в секундах.
Отсюда скорость химической реакции
выражается в моль
л-1 с-1.
Если р-ция осуществляется путем
последовательно протекающих стадий и
одна из них требует значительно большего
времени, чем остальные, то есть идет
намного медленне, то такая стадия
называется лимитирующей.
. (8.4)
Однако необходимо учитывать, что
измеренные по разным веществам скорости
не равны, а пропорциональны одна
другой. Например, в реакции синтеза
аммиака N2
+ 3H2
2HN3 на
каждый исчезающий моль N2 расходуется
3 моля H2 и образуется 2 моля аммиака.
Соответствующие скорости реакции
соотносятся как 1: 3: 2.Скорость реакции
имеет размерность [концентр]
[время]-1. В химической кинетике
концентрацию чаще всего выражают
в моль/л, а время – в секундах.
Отсюда скорость химической реакции
выражается в моль
л-1 с-1.
Если р-ция осуществляется путем
последовательно протекающих стадий и
одна из них требует значительно большего
времени, чем остальные, то есть идет
намного медленне, то такая стадия
называется лимитирующей.
