
- •Ситуационная задача №
- •В отк фармацевтического предприятия для изготовления таблеток поступило для оценки качества лекарственное вещество нескольких серий со следующей структурой:
- •Ситуационная задача №
- •В кал химико-фармацевтического предприятия поступило на анализ лекарственное вещество нескольких серий от различных заводов – изготовителей со следующей химической структурой:
- •Атропина сульфат
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Euphyllinum Эуфиллин
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Адонизид
- •Ситуационная задача №
- •Ситуационная задача №
- •Глюкоза
- •Ситуационная задача №
- •Ситуационная задача №
- •Для проведения лекарственных веществ в составе суспензии предложите достоверные реакции идентификации и количественного определения при совместном присутствии:
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Для проведения аналитического контроля субстанции кофеина-бензоата натрия:
- •Ситуационная задача №
- •В отк фармацевтического предприятия поступило несколько серий лекарственного вещества следующей структуры:
- •Ситуационная задача №
- •1.В кал проступило несколько серий лекарственного вещества следующей структуры:
- •Ситуационная задача №
- •1. На фармацевтическое предприятие, производящее таблетки «Пенталгин» следующего состава
- •Ситуационная задача №
- •1. Для проведения аналитического контроля и заключения о качестве в отк фармацевтического предприятия поступил готовый раствор Сульфокамфокаина 10% в ампулах.
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Ситуационная задача №
- •Для проведения аналитического контроля и заключения о качестве субстанций:
- •Ситуационная задача №
- •1. В аналитическую лабораторию отк химико-фармацевтического предприятия поступили на анализ плоды облепихи и лекарственное средство нескольких серий следующей химической структуры:
- •Для проведения аналитического контроля и заключения о качестве субстанции:
- •Ситуационная задача №
- •Для выбора методов анализа препарата и заключения о его качестве необходимо провести оценку качества в соответствии с гф.
- •Ситуационная задача №
- •1, В отк фармацевтического предприятия для оценки качества поступило от различных заводов-изготовителей несколько серий лекарственного вещества, структурная формула которого приведена ниже.
- •Ситуационная задача №
- •Ситуационная задача №
Ситуационная задача №
Для проведения лекарственных веществ в составе суспензии предложите достоверные реакции идентификации и количественного определения при совместном присутствии:
Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость, спектральные и оптические характеристики) и их использование для оценки качества.
В соответствии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций.
Bismuthi subnitratis
Magnesii oxydi ana 2,0
Aguae purificatae 100 ml
M.D.S. по 1 ч.л. 2 раза в день
 висмут
нитрат основной
висмут
нитрат основной
Mg=O магния оксид
Применяется внутрь как вяжущее, антисептическое, при повышенной кислотности, при желудочно-кишечных заболеваниях.
Висмут субнитрат – белый аморфный порошок, практически нерастворим в воде, легко – в соляной и азотной кислотах.
 +
5 Н2О
2Bi(NO3)3
+ 3 H2O
+
5 Н2О
2Bi(NO3)3
+ 3 H2O
Водные смеси окрашивают синюю лакмусовую бумагу в красный цвет.
+
Н2О
HNO3
+ 3 H2O
+

Магния окись – белый мелкий порошок без запаха, практически нерастворим в воде и спирте, растворим в HCl, H2SO4, CH3COOH.
Подлинность
Висмута нитрат основной:
При прибавлении HNO3 и Na2S образуется коричнево-чёрный осадок
 +
5HNO3
→ 2Bi(NO3)3
+ 3H2O
+
5HNO3
→ 2Bi(NO3)3
+ 3H2O
2Bi(NO3)3 + 3Na2S → BiS3↓ + 6NaNO3
При прибавлении H2SO4 после фильтрации, при добавлении к фильтрату раствора KI образуется чёрный осадок йодида висмута, растворимый в избытке реактива с образованием жёлто-оранжевого раствора комплексной соли.
+ 3 H2SO4 → Bi(SO4)3 + HNO3 + 3H2O
Bi(SO4)3 + 6KI → 2BiI3↓ + 3K2SO4
BiI3 + KI → KBiI4
Определение магния оксида. После прибавления раствора HCl и фильтрации в фильтрате определяют Mg2+
MgO + 2HCl → MgCl2 + H2O
MgCl2
+ NaHPO4
+ NH3·H2O
![]() MgNH4PO4↓
+ 2NaCl
+ H2O
MgNH4PO4↓
+ 2NaCl
+ H2O
растворение в CH3COOH
MgNH4PO4 + 2CH3COOH → Mg(CH3COO)2 + NH4H2PO4
Общим реактивом обнаружения является минеральная кислота (HCl и HNO3), которая растворяет оба ингредиента. После действия кислоты проводят частные реакции на каждый катион (Mg2+ и Bi3+)
Количественное определение
Метод трилонометрии
Точную навеску лекарственной формы растворяют в азотной кислоте, затем прибавляют аммиачно-буферный раствор и титруют 0,05 М раствором Трилона Б в присутствии индикатора терокатехинового фиолетового от синего до жёлтого окрашивания (висмута субнитрата)

Определение висмута нитрата основного: расчёт ведут по оксиду висмута Bi2O3, который должен быть 79-82%
 =0,01456
г/мл
=0,01456
г/мл
н.о. висмута субнитрата в л.ф. ±5%
-
2 — 100
х — 5
Х= ±0,1
1,9-2,1
 ;
;
Определение магния оксида проводят методом трилонометрии с индикатором кислотным хром чёрным предварительно растворив в HCl до синего окрашивания
MgO + 2HCl → MgCl2 + H2O

Ситуационная задача №
Для проведения оценки качества в ОТК фармацевтического предприятия для получения таблеток поступило несколько серий лекарственного вещества от различных заводов-изготовителей со следующей структурой:

Предложите показатели, характеризующие качество лекарственного вещества, и приведите методы для их определения.
Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость, спектральные и оптические характеристики) и их использование для оценки качества.
В соответствии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций.
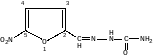
Furacillinum
Фурацилин
Nitrofuralum
Nitrofural
5-нитрофурфурола семикарбазон
Относится к производным гетероциклических соединений – нитрофурана.
Представляет собой жёлтый или зеленовато-жёлтый мелкокристаллический порошок без запаха, горького вкуса, очень малорастворим в воде, мало в спирте, растворим в щелочах.
Содержит кольцо фурана, нитрогруппу, имидную группу, за счёт которых соединение обладает кислотными свойствами, поэтому растворяется в щелочах.
Является продуктом взаимодействия 5-нитрофурфурола и семикарбазида. Относится к средствам для лечения и профилактики инфекционных заболеваний – антибактериальное средство для лечения стафилококковых, стрептококковых инфекций. Эффективен против дизентерийной палочки, возбудителя газовой гангрены и других микроорганизмов, при гнойных ранах, пролежнях, язвах, ожогах II и III степени, при остеомиелите, отитах, фурункулёзах, гайморитах, конъюктивитах и других заболеваниях.
К препаратам производным нитрофурана относятся также:
Фурадонин (нитрофурантоин), фуразолидон, фуразидин (фурагин).
Подлиность производных 5-нитрофуранов устанавливают по реакции с водным раствором NaOH: образуется ацисоль, окрашенная в оранжево-жёлтый цвет:

При нагревании в растворах щелочей происходит разрыв фуранового цикла и образуется Na2CO3, гидразид, NH3 (обнаруживается по запаху и посинению лакмусовой бумаги):

Для испытания подлинности используют ИК-спектры в области 1900-700 см–1. ИК-спектры должны полностью совпадать с ИК-спектрами ГСО. ИК-спектр фурацилина имеет полосы при 971, 1020, 1205, 1250, 1581, 1724 см–1. В основе подлинности лежат реакции, основанные на их расщеплении (гидролитическом), окислительно-восстановительных свойствах, образовании ацисолей (нитрогруппа).
Раствор фурацилина в диметилформамиде после прибавления 1% раствора нитропруссида натрия и 1М раствора NaOH даёт красное окрашивание. С солями серебра, кобальта, меди и других тяжёлых металлов в слабощелочной среде образует окрашенные комплексные соединения.
Количественное определение основано на восстановительных свойствах нитрофурала – метод йодометрии (ГФ), основанный на окислении препарата йодом в щелочной среде (для улучшения растворимости прибавляют NaCl и смесь нагревают).
I2 + 2NaOH → NaIO2 + NaI + H2O

После этого добавляют раствор H2SO4, и избыток титруют точным раствором натрия тиосульфата.
NaI + NaIO + H2SO4 = I2 + Na2SO4 + H2O
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Для количественного определения используют УФ-спектры растворов в области 240-450 нм, а также спектрофотометрический метод (растворителем служит 50% раствор серной кислоты, в котором нитрофурал имеет максимум поглощения при 227 нм).
Возможен фотоколориметрический метод, основанный на использовании цветных реакций с NaOH в различных растворителях (для субстанции и лекарственной формы).
