
- •1) Основные термодинамические функции δg, δh, δs
- •2) Закон Гесса, следствия
- •Следствия из закона Гесса
- •3) Направленность химических процессов
- •4) Влияние концентрации на скорость химической реакции (з. Действующих масс)
- •5) Влияние давления на скорость химической реакции
- •6) Влияние температуры на скорость химической реакции
- •7) Энергия активации химической реакции. Расчет энергии.
- •Методы расчёта
- •8) Влияние каталитической обстановки на скорость химической реакции.
- •9) Влияние дисперсности вещества на скорость химической реакции.
- •10) Механо-химические реакции.
- •11) Химическое равновесие. Константа химического равновесия.
- •12) Применение основных положений химической кинетики к гетерогенным системам.
- •13) Факторы, влияющие на смещение химического равновесия:
- •14) Электронное моделирование строения атома.
- •15) Периодический закон и электронное строение атома.
- •16) Типы химических связей
- •17) Ковалентная связь
- •18) Расчет числа возможных ковалентных связей
- •19) Ионная связь. Переход полярной связи в ионную
- •20) Донорно-акцепторная связь
- •21) Химическая связь и прочность твердого тела
- •22) Химическая коррозия металлов.
- •23) Гальвани́ческий элеме́нт. Аккумулятор.
- •24) Электро́дный потенциа́л. Уравнение Нернста
- •25) Окислительно-восстановительные реакции
- •26) Ионное произведение воды. Водоро́дный показа́тель.
- •27) Электролитическая диссоциация. Изотонический коэффициент, его связь со степенью электролитической диссоциации.
- •28) Закон Рауля
- •29) Следствия з. Рауля
- •30) Гидролиз солей
- •31) Осмос. Осмотическое давление. Обратный осмос.
- •32) Классификация дисперсных систем и растворов.
- •33) Гомо- и гетерогенные системы. Диспе́рсные систе́мы и растворы.
- •34) Химическая коррозия металлов.
- •35) Электрохимическая коррозия металлов
- •36) Методы борьбы с химической коррозией металлов.
- •37) Пассивное состояние поверхности металла
- •38) Методы борьбы с электрохимической коррозией металлов.
- •39) Электролиз.
- •40) Диспе́рсные систе́мы, межфазная граница, свойства.
9) Влияние дисперсности вещества на скорость химической реакции.
Дисперсные системы, представляющие собой коллоидные растворы, обладают многими необычными для других систем свойствами. Эта особенность вызвана тонкостью дробления или степенью дисперсности вещества.
На скорость твердофазовых реакций существенно влияет дисперсность вещества. Равномерность и степень измельчения увеличивают площадь поверхности зерен и величину поверхностной энергии, вследствие чего возрастает скорость химического взаимодействия.
10) Механо-химические реакции.
Механохимические реакции подчиняются собственным закономерностям, и их нельзя рассматривать как термически активированные реакции. Несмотря на то что с механически активированными реакциями приходится сталкиваться почти во всех отраслях науки и техники, природа этого явления объяснена не полностью. Поэтому следует назвать только некоторые наиболее существенные точки зрения.
Механохимические реакции имеют место в химической технологии при измельчении веществ и их смесей при обычных температурах. На эти реакции до сих пор обращалось мало внимания. Следует полагать, что, например, при изготовлении сырьевой муки для производства цемента, керамических материалов или стекла во время помола образуются химические соединения, как, например, силикаты, которые впоследствии значительно облегчают или как-то влияют на технологический или термический процесс.
Механохимические реакции возникают в твердом теле при его механическом разрушении, включают распад молекул на свободные радикалы и ионизацию молекул.
Механохимические реакции - это реакции превращения механической энергии в химическую, они играют очень большую роль при переработке и эксплуатации изделий.
11) Химическое равновесие. Константа химического равновесия.
— состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Константа химического равновесия — характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
Константа химического равновесия определяется по закону действующих масс. Ее значения находят расчетно или на основании экспериментальных данных. Константа химического равновесия зависит от природы реагентов и от температуры.
12) Применение основных положений химической кинетики к гетерогенным системам.
Химическая кинетика – наука, изучающая протекание химических реакций во времени. Ее основным понятием является скорость химической реакции. Химическая кинетика изучает механизм протекания процесса, т.е. те промежуточные стадии, состоящие из элементарных актов, через которые система переходит из начального состояния в конечное.
Для гетерогенных процессов скорость реакции – это изменение количества компонента в единицу времени отнесенное к единице поверхности, где протекает химическая реакция
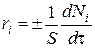 ,
,
где S– «активная» поверхность, м2;
ri – скорость реакции, моль/(м2·с);
t - время.
