
- •Самостійна робота Застосування знань
- •«Най -най» Актуалізація опорних знань
- •«Ланцюжок» Перевірка домашнього завдання
- •Взаємодія з неметалами
- •Взаємодія металів з водою
- •Робота в групах «Металічний годинник» Застосування нових знань Написати рівняння реакцій за поданою схемою:
- •Робота з таблицями Перевірка домашнього завдання
- •1) З водою:
- •2) З кислотами:
- •3) З кислотними оксидами:
- •Лабораторний дослід №11. Ознайомлення зі зразками сполук кальцію і магнію закріплення знань
- •Хід роботи
- •Робота зі схемою Застосування набутих знань Наl
- •Інформаційна сторінка Вивчення нового матеріалу Твердість води
- •Значення твердості води
- •Способи усунення твердості води
- •Опорний конспект Закріплення нового матеріалу
- •Усунення накипу з поверхні побутових приладів
- •Хід роботи.
- •«Готуємось до зно» Перевірка домашнього завдання
- •Виберіть підгрупу хімічних елементів, до якої не входять елементи-метали:
- •Виберіть солі, якими обумовлена постійна твердість води:
- •Історична довідка Мотивація навчальної діяльності
- •Інформаційна сторінка Вивчення нового оширення алюмінію.
- •2.Електронна будова атома і йона.
- •3.Хімічні властивості алюмінію.
- •4.Добування.
- •5.Властивості алюміній оксиду і алюміній гідроксиду.
- •Опорний конспект Закріплення знань
- •«Мозковий штурм» Перевірка домашнього завдання
- •Цікаві факти Мотивація навчальної діяльності
- •Інформаційна сторінка Вивчення нового матеріалу Фізичні властивості
Робота з таблицями Перевірка домашнього завдання
Положення в періодичній системі, будова атома.
|
Період |
Група |
Ar |
N |
Z |
é |
p |
n |
Схема будови атома |
Натрій |
|
|
|
|
|
|
|
|
|
Калій |
|
|
|
|
|
|
|
|
|
Фізичні властивості.
|
Na |
К |
Агрегатний стан |
|
|
Колір |
|
|
Лабораторний дослід N10. Ознайомлення із зразками сполук Натрію і Калію
Мотивація навчальної діяльності
Кам’яна сіль |
|
Глауберова сіль |
|
Сильвініт |
|
Карналіт |
|
Інформаційна сторінка
Вивчення нового
Способи добування Натрію і Калію
Електроліз розплавів


Хімічні властивості
а) З простими речовинами (лише Літій при взаємодії з киснем утворює оксид, Калій і Натрій - пероксиди)
 2K+O2
+
K2O2
2K+O2
+
K2O2
2Na + Cl2 = 2NaCl 2Na + S = Na2S
2Na + H2 = 2NaH 2K + Br2 = 2KBr
б) Взаємодія з водою


Демонстрація. Взаємодія натрію з водою
Через надзвичайну активність лужні метали зберігають у герметично закритій посудині під шаром гасу.
Під час демонстрації учні спостерігають, як срібляста кулька натрію «бігає» по поверхні води і з-під неї виділяється водень, якщо воду забарвити фенолфталеїном, то з утворенням лугу розчин з безбарвного стає малиновий
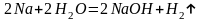
Оксиди натрію і калію, їх властивості.
Формула |
Na2О |
К2О |
Агрегатний стан |
Твердий |
Твердий |
Колір |
Білий |
Білий |
У воді розчиняються, реагуючи з нею.
За хімічними властивостями – основні оксиди.
Основи NaOH, KOH, їх властивості
Дуже гігроскопічні.
За хімічними властивостями – типові основи.
Формула |
NaOH |
KOH |
Агрегатний стан |
твердий |
твердий |
Колір |
білий |
білий |
«Робота в парах»
Закріплення нових знань
Учні записують рівняння реакцій у молекулярній формі.
1) З водою:
Na2O + H2O = K2O + H2O=
2) З кислотами:
Na2O + HCl= K2O + H2SO4 =
3) З кислотними оксидами:
Na2O + CO2 = K2O + SiO2 =
Самостійна робота
Контролю і корекції знань
Варіант І
Скласти рівняння реакцій за схемою:

Запропонуйте спосіб, за допомогою якого можна розпізнати натрій хлорид і калій хлорид
Варіант ІІ
Складіть рівняння реакцій за схемою:

Запропонуйте спосіб, за допомогою якого можна розпізнати калій хлорид і натрій хлорид
Підведення підсумків
Д/з
1.§ 19
2.завд ст.. 157
3№2 ст. 162
4.№5 ст.163
Урок №5 Лужноземельні елементи Магній та Кальцій. Фізичні та хімічні властивості їх простих речовин, основний характер їх оксидів та гідроксидів, біологічна роль елементів. Лабораторний дослід №11. Ознайомлення зі зразками сполук Кальцію і Магнію
«Торт рішень»
Перевірка домашнього завдання
Допишіть рівняння реакцій:
K + H2 =
Cs + S =

Li + O2 =
NaOH + CO2 =
«Міцний горішок»
Актуалізація опорних знань
Яку кількість речовини натрій гідроксиду можна добути дією води 4,875г натрій оксиду?
Біологічне значення
Мотивація навчальної діяльності
В організмі дорослої людини міститься приблизно 20 г Магнію. Цей елемент сприяє формуванню кісток, нормальному функціонуванню нервової системи і м'язів. Добова потреба організму в Магнії становить 0,3— 0,4 г. Він надходить до організму переважно із зеленими овочами.
Кальцій карбонат є неорганічною основою яєчної шкаралупи, черепашок, коралів, а фосфати Кальцію — основою кісток і зубів. Иони Са2+ входять до сироватки крові; за їх нестачі кров погано зсідається. Маса Кальцію в організмі дорослої людини дорівнює майже 1 кг, а добова потреба в цьому елементі становить 1—1,2 г. Вона задовольняється переважно за рахунок молока і молочних продуктів. За нестачі Кальцію лікарі рекомендують вживати солі цього елемента й органічних кислот — глюконат, гліцерофосфат, глутамінат.
Інформаційна сторінка
Вивчення нового
Положення Магнію і Кальцію у періодичній системі.
Розгляньте положення Магнію і Кальцію у періодичній системі, зобразіть електронну будову їх атомів. Зробіть висновок про їх властивості. Чим вони відрізняються від властивостей лужних металів?
Поширеність у природі.
Магній і Кальцій належать до найпоширеніших елементів. Вони трапляються лише у сполуках.
Найважливіші мінерали:
магнезит MgCO3; карноліт KCl·MgCl2 ·6H2O;
доломіт MgCO3·СаCO3; вапняк СаCO3;
гіпс СаSO4 ·2 H2O.
Прості речовини елементів.
Магній і кальцій – сріблясто-білі метали. Вони важчі і твердіші за лужні метали, мають значно вищі температури плавлення 6500 С (Mg) і 8420С (Са).
Способи добування.
Кальцій і Магній добувають шляхом електролізу їх розплавлених хлоридів. Напишіть схеми електролізу розплавів кальцій хлориду та магній хлориду.
Хімічні властивості простих речовин магнію і кальцію.
Демонстрація: взаємодія кальцію з водою
Шматочок кальцію, попередньо очищений з одного боку напилком, опустити в кристалізатор з водою. Закрити кальцій лійкою, на лійку надягти циліндр з водою. Реакція в перший момент проходить повільно, але незабаром стає бурхливою, вода розігрівається й каламутніє від малорозчинного кальцій гідроксиду, що утворився.
Са + Н2О = Са(ОН)2 + Н2↑
При пропущенні через розчин вуглекислого газу утворюється осад. При подальшому пропущенні СО2 осад поступово розчиняється.
Са(ОН)2 + СО2 = СаСО3 + Н2О
СаСО3 + СО2 + Н2О = Са(НСО3)2
Оксиди та гідроксиди кальцію та магнію.
Демонстрація : Взаємодія кальцій оксиду з водою.
Шматочки кальцій оксиду (негашеного вапна) покласти в склянку і з піпетки зросити невеликою кількістю води, даючи їй щоразу всмоктатись. Через якийсьчас шматочки сильно розігріваються і перетворюються на пухку масу гашеного вапна, при цьому рясно виділяються водяні пари: СаО + Н2О = Са(ОН)




