
- •Глава 1. Атомно-молекулярное учение.
- •Глава 3. Окислительно-восстановительные реакции.
- •1) Тип: межмолекулярное ов
- •1) Тип: межмолекулярное ов
- •Глава 5. Химическая связь и строение молекул.
- •Глава 2. Комплексные соединения.
- •Глава 8. Химическое равновесие.
- •Глава 9. Электрохимические процессы.
- •Глава 10. Скорость химических реакций.
- •Глава 11. Концентрация растворов.
- •Глава 12. Свойства растворов неэлектролитов.
- •Глава 13. Растворы электролитов.
- •Глава 14. Ионные реакции и гидролиз солей.
- •Часть II. Неорганическая химия.
- •Глава 1. Введение в неорганическую химию.
- •Глава 2. Водороды и галогены.
- •Глава 3. Халькогены.
- •Глава 4. P-Элементы пятой группы.
- •Глава 5. P-Элементы четвертой группы.
- •Глава 6. P-Элементы третьей группы.
- •Глава 5. Химия s-элементов.
- •Глава 8. Химия d- и f-элементов.
- •8.5 Подгруппа хрома.
- •8.7 Семейство железа.
- •8.9 Подгруппа меди
Глава 5. Химия s-элементов.
Задача № 457.
К раствору содержащему ионы Ca2+, Sr2+, Ba2+ добавляется по каплям сульфат натрия. Какие вещества выпадают в осадок и в какой последовательности?
Решение:
Из таблицы возьмем значения произведений растворимости для CaSO4 , BaSO4, SrSO4.
ПРCaSO4 = 1.3*10-10
ПР BaSO4 = 1,1*10-10
ПР SrSO4 =3,2*10-7
Произведение растворимости - это произведение концентраций ионов данной соли. Оно показывает, при какой концентрации данных ионов выпадает в осадок, то есть при какой концентрации раствор становится насыщенным. таким образом чем меньше значение произведения растворимости, тем меньше концентрация данной соли в насыщенном растворе, соответственно тем раньше выпадет осадок.
В нашей задаче если по каплям добавлять Na2SO4, то в первую очередь выпадет осадок BaSO4 , затем SrSO4, а в последнюю очередь CaSO4.
Глава 8. Химия d- и f-элементов.
Задача № 485.
Описать метод транспортных реакций и метод электролитического рафинирования, которые применяются для получения высокочистых металлов.
Решение:
Производство металлов высокой частоты.
Современным науке и технике, многим отраслям промышленности необходимы металлы с малым содержанием примесей, так как примеси сильно изменяют свойства металла. Что бы получить вещество высокой чистоты, технический металл подвергают дополнительной переработке.
Металлы достаточно высокой чистоты образуют при окислении технического металла с последующим восстановлением полученных соединений до исходного металла путем электролиза в расплавах или в растворах. Такой метод называется методом электрорафинирования.
Для очистки некоторых металлов используется другой способ: из технического металла получают соединение, очищают его и подвергают разложению. Например при очистке никеля из технического металла получают тетракарбонил никеля [Ni(CO)4]:
Ni+4CO=[Ni(CO)4]
Это соединение перегоняют для очистки от примесей, а затем при температуре свыше 180 разлагают, образуется чистый никель, газообразный оксид углерода (II) удаляется:
[Ni(CO)4]=Ni+4CO.
Высокой степени очистки металла можно достичь, проводя его дистилляцию. Этот метод состоит в испарении металла с последующей конденсацией паров. Так очищают металлы с достаточно низкими температурами кипения, например алюминий. Что бы освободить металл от газообразных веществ (азота, водорода, кислорода) и других легколетучих примесей, при этом все летучие примеси удаляются.
Для глубокой очистки металлов широко используется зонная плавка. Метод основан на том, что растворимость многих веществ (примесей) в жидком металле лучше, чем в твердом.
8.5 Подгруппа хрома.
Задача № 563.
Как и почему изменяется сила кислот H2CrO4-H2MoO4-H2WO4? Написать схемы электролитической диссоциации этих кислот, предсказать значения констант их диссоциаций.
Решение:
В ряду H2CrO4-H2MoO4-H2WO4 хром, молибден, вольфрам имеют одинаковую конфигурацию внешнего энергетического уровня, в данном ряду атомный радиус элементов увеличивается, следовательно валентные электроны отдаляются от ряда и их отдача облегчается. Поэтому кислотные свойства, а следовательно и сила кислот в этом ряду уменьшается
H2CrO4
 H+
+ HCr
H+
+ HCr
HCr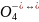 H+
+ Cr
H+
+ Cr
H2Mo H+ + HMo
HMo H+ + Mo
H2WO4 H+ +HW
HWO4 H+ W
8.6 Подгруппа марганца.
Задача № 582.
Рениевую кислоту модно получить окислением рения азотной кислотой. Написать уравнение реакции, вычислить молярную массу эквивалентов окислителя и восстановителя.
Решение:
Re+7HNO3
 HReO4+7NO2+3H2O
HReO4+7NO2+3H2O
Re+4H2O Re + 8H+ +7
N + 2H+ +1 NO2 + H2O
Re+7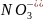 + 14H+
+ 4H2O
Re
+ 8H+
+ 7NO2
+ 7H2O
+ 14H+
+ 4H2O
Re
+ 8H+
+ 7NO2
+ 7H2O
Re - восстановитель
Re0 - 7 = Re+7
 =
=
 =
=
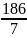 = 26,6 г/моль
= 26,6 г/моль
HNO3 - окислитель
N+5 + 1 = N+4
 =
=
 = 14 г/моль.
= 14 г/моль.
