
- •Глава 1. Атомно-молекулярное учение.
- •Глава 3. Окислительно-восстановительные реакции.
- •1) Тип: межмолекулярное ов
- •1) Тип: межмолекулярное ов
- •Глава 5. Химическая связь и строение молекул.
- •Глава 2. Комплексные соединения.
- •Глава 8. Химическое равновесие.
- •Глава 9. Электрохимические процессы.
- •Глава 10. Скорость химических реакций.
- •Глава 11. Концентрация растворов.
- •Глава 12. Свойства растворов неэлектролитов.
- •Глава 13. Растворы электролитов.
- •Глава 14. Ионные реакции и гидролиз солей.
- •Часть II. Неорганическая химия.
- •Глава 1. Введение в неорганическую химию.
- •Глава 2. Водороды и галогены.
- •Глава 3. Халькогены.
- •Глава 4. P-Элементы пятой группы.
- •Глава 5. P-Элементы четвертой группы.
- •Глава 6. P-Элементы третьей группы.
- •Глава 5. Химия s-элементов.
- •Глава 8. Химия d- и f-элементов.
- •8.5 Подгруппа хрома.
- •8.7 Семейство железа.
- •8.9 Подгруппа меди
Часть II. Неорганическая химия.
Глава 1. Введение в неорганическую химию.
Задача № 317.
Решение:
Металлы, взаимодействуя с водой, вытесняют водород по реакции: \
2H2O+2 = H2 +2OH-
Стандартный
потенциал этой полуреакции имеет
значение
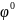 = -0,41В.
= -0,41В.
Таким образом с водой будут взаимодействовать металлы, имеющие значение стандартного электронного потенциала ниже (- 0,41В), так как вода как окислитель, должна иметь значение потенциала больше, чем восстановитель. По ряду напряжений металла, взаимодействующие с H2O это металлы, стоящие до кадмия Cd.
Глава 2. Водороды и галогены.
Задача № 332.
Объяснить, почему фтор, в отличии от других галогенов , во всех соединениях одновалентен и не имеет положительных степеней окисления.
Решение:
Фтор не имеет зародившейся d-орбитали, так как у него идет заполнение только второго уровня, где d-орбиталь не существует. Поэтому для завершения внешнего энергетического уровня фтору требуется всего 1 электрон. Этим обуславливается его возможность проявлять валентность только 1. Фтор не имеет положительных степеней окисления, потому что фтор только принимает один электрон, а не отдает, а остальные галогены могут распаривать свои электроны на d-орбитали, что обуславливает их возможность проявлять положительные степени окисления.
Глава 3. Халькогены.
Задача № 360.
Закончить уравнения окислительно-восстановительных реакция, методом полуреакций.
1) H2SO3+ H2SeO4=
2) H2S+KMnO4+H2SO4=
3)SO2+Cl2+H2O =
4)S+HNO3(конц) =
Решение:
1) H2SO3+ H2SeO4=H2SO4+SeO2+H2O
2) H2S+KMnO4+H2SO4= 5H2S+2KMnO4+3H2SO4 5S+2MnSO4+K2SO4+8H2O
 H2S-восстановитель,
KMnO4-окислитель
H2S-восстановитель,
KMnO4-окислитель
S-2 - 2 S0 5
Mn+7 + 5 Mn+2 10
2
3) SO2+Cl2+H2O =2HCl+SO3
4) S+HNO3(конц) = H2SO4+6NO2+2H20
Глава 4. P-Элементы пятой группы.
Задача № 394.
Сколько
граммов Sb2S3
можно растворить в 200 мл раствора HNO3
с
массовой долей 60% (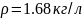 )?
Какой объем (н.у) оксида азота (II)
выделится при этом?
)?
Какой объем (н.у) оксида азота (II)
выделится при этом?
Решение:
m 201.6г V
Sb2S3+8HNO3 2NO+3S+2Sb(NO3)3+4H2O
340г 8*63 г 2*22.4л
Дано:
Vр-раHNO3 =200мл
HNO3 =60%
 =
1.68г/мл
=
1.68г/мл
Найти: VNO-? mSb2S3-?
1)Масса чистого HNO3 : m р-ра = V=200*1.68=336г.
m HNO3 = 336*0.6=201.6г.
2) По уравнению определим массу Sb2S3 и объем NO:
m
Sb2S3
=
 = 136 г
–масса
Sb2S3.
= 136 г
–масса
Sb2S3.
VNO
=
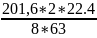 =
17,92 л.-
объем
NO.
=
17,92 л.-
объем
NO.
Ответ: VNO = 17.92; mSb2S3 = 136 г.
Глава 5. P-Элементы четвертой группы.
Задача № 407.
Как отделить SnS от SnS2 и Ges от Ges2 ? Какие из сульфидов олова и германия имеют свойства тиоангидридов? Написать уравнение реакций.
Решение:
SnS можно отделить от SnS2 путем добавления к данной смеси сульфидов щелочных металлов или сульфида аммония, при этом SnS2 перейдет в раствор в виде соли тиооловянной кислоты.
SnS2 + (NH4)2 S= (NH4)2 SnS3
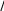 SnS
+ (NH4)2S=
SnS
+ (NH4)2S=
Аналогично со смесью GeS и GeS2
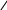 GeS+(NH4)2S=
GeS+(NH4)2S=
GeS2+(NH4)2S=(NH4)2GeS3
Свойства тиоангидридов проявляют GeS2 и SnS2.
Глава 6. P-Элементы третьей группы.
Задача № 432.
Объяснить, почему не взаимодействующий с водой алюминий взаимодействует с водными растворами NH4Cl и Na2CO3; написать уравнения соответствующих реакций.
Решение:
Для того, что бы объяснить почемуAl взаимодействуют с водными растворами Na2CO3 и NH4Cl, запишем гидролиз для этих солей:
Na2CO3 + H2O NaOH + NaHCO3
NaHCO3 + H2O NaOH+H2CO3
H2O CO2
Взаимодействие с алюминием:
2Al + 2NaOH + 6H2O=2Na[Al(OH)4]+3H2
Суммарное: 2Al + Na2CO3 +8H2O 2Na[Al(OH)4]+CO2 +4H2
Аналогично:
NH4Cl + H2O NH4OH +HCl
Взаимодействие с Al:
Al+6Cl 2AlCl3 +3H2
Суммарное:
Al+3NH4Cl+3H2O AlCl3+3NH4OH+3H2
