
- •Глава 1. Атомно-молекулярное учение.
- •Глава 3. Окислительно-восстановительные реакции.
- •1) Тип: межмолекулярное ов
- •1) Тип: межмолекулярное ов
- •Глава 5. Химическая связь и строение молекул.
- •Глава 2. Комплексные соединения.
- •Глава 8. Химическое равновесие.
- •Глава 9. Электрохимические процессы.
- •Глава 10. Скорость химических реакций.
- •Глава 11. Концентрация растворов.
- •Глава 12. Свойства растворов неэлектролитов.
- •Глава 13. Растворы электролитов.
- •Глава 14. Ионные реакции и гидролиз солей.
- •Часть II. Неорганическая химия.
- •Глава 1. Введение в неорганическую химию.
- •Глава 2. Водороды и галогены.
- •Глава 3. Халькогены.
- •Глава 4. P-Элементы пятой группы.
- •Глава 5. P-Элементы четвертой группы.
- •Глава 6. P-Элементы третьей группы.
- •Глава 5. Химия s-элементов.
- •Глава 8. Химия d- и f-элементов.
- •8.5 Подгруппа хрома.
- •8.7 Семейство железа.
- •8.9 Подгруппа меди
Глава 9. Электрохимические процессы.
Задача№ 207.
Электролиз сульфата меди (II) проводился 12 ч при силе тока 20А. Выход по току составил 90%. Написать уравнение электродных процессов и общей реакции, вычислить массу выделившейся меди.
Решение:
Дано:
t=12часов,
J=20А,
 =90%
=90%
Найти
 - ?
- ?
На аноде возможно:
2S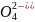 =S2
=S2 +2
+2
 =2.01В;
2H2O=O2+4H+
+
4
=2.01В;
2H2O=O2+4H+
+
4
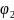 =1.23В,
так как
=1.23В,
так как
 ,
то на аноде выделяется кислород.
,
то на аноде выделяется кислород.
На катоде возможно:
Cu2+
+
2
=Cu
 =0.34В;
2H2O+2
=H2
+
2OH-
=0.34В;
2H2O+2
=H2
+
2OH-
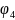 =
-0.41В
=
-0.41В
так
как
 ,
то на катоде выделится медь
,
то на катоде выделится медь
CuSO4+H2O Cu+O2+2H+ + SO42-
=
 * 0.9=
* 0.9=
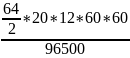 = 257.8г.
= 257.8г.
Ответ: = 257.8г.
Глава 10. Скорость химических реакций.
Задача № 217.
Как
влияет температура на скорость реакций?
Температурный коэффициент некоторой
реакции равен 3. Как изменится скорость
этой реакции при повышении температуры
от 80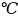 до 130
?
до 130
?
Решение:
При увеличении температуры, увеличивается скорость молекул, следовательно, увеличивается число эффективных соударений молекул, то есть соударений, которые приведут к взаимодействию между молекулами.
Таким образом, температура влияет на скорость протекания реакции.
 =3,
=3,
t1 = 80 ,
t2 =130
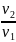 =
?
=
?
=
 =
=
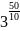 = 35
=
243 раза.
= 35
=
243 раза.
Ответ: Скорость реакции увеличивается в 243 раза.
Глава 11. Концентрация растворов.
Задача № 232.
Из 400 г раствора некоторой соли с массовой долей 20% при охлаждении выделилось 50 г растворенного вещества. Чему равна массовая доля этого вещества в оставшемся растворе?
решение:
Дано:
mр-ра = 400г;
 1
=
20%;
1
=
20%;
mв-ва = 50г.
Найти 2 - ?
1) Найдем массу вещества находящегося в растворе:
400 г соответствуют 100%,
x г. соответствуют 20%
x
=
 = 80 г.
= 80 г.
2) Найдем массу оставшегося вещества: 80-50=30 г.
3) Найдем массовую долю в получившемся растворе:
400-50=350 г.(раствора)
350г. соответствуют 100%
30 г. соответствуют x%,
x= 8.57%.
Глава 12. Свойства растворов неэлектролитов.
Задача № 242.
Известно, что при температуре 42 давление водяного пара равно 8199,3 Па. Как изменится давление, если при этой температуре в 540 мл воды растворить 36 г глюкозы C6H12O6?
Решение:
Дано:
t0 = 42 ,
P0 = 8199,3 Па,
VH2O = 540 мл,
mC6H12O6 = 36 г.
Найти: p - ?
p
=
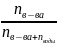 =
=
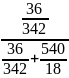 * 8199,325 = 28,68Па
* 8199,325 = 28,68Па
p=8199,325-28,68=8170,66 Па.
Глава 13. Растворы электролитов.
Задача № 279.
Как рассчитывается и какой физико-химически смысл имеет произведение растворимости вещества? при 20 растворимость идиода свинца (II) равна 6,5*10-4 моль/л. Вычислить произведение растворимости этого вещества.
Решение:
Произведение растворимости вещества легко найти, зная его растворимость, если растворимость
(S)PbJ2 = 6,5 * 10-4 моль/л(при t=20 ), это значит что в 1 литре насыщенного раствора содержится 6,5*10-4 моль Pb2+ и (6,5 * 10-4)*2моль J-, следовательно:
ПPPbJ2=[Pb2+][J-]=S*(2S)2 =4S3=4*(6,5 * 10-4)3=10-9.
Глава 14. Ионные реакции и гидролиз солей.
Задача №292.
Объяснить механизм гидролиза, учитывая, что в водном растворе содержатся гидратированные ионы. За счет образования и разрыва каких связей идет процесс гидролиза? Написать молекулярное и ионное уравнения гидролиза данных солей, указать в каждом случае тип и характер среды раствора: KNO2, Na2CO3, Fe(NO3)3.
Решение:
 KNO2+H2O
KOH+NHO2
KNO2+H2O
KOH+NHO2
и.н (ионное полное) K+ + NO2 -+ H2O K+ + OH- +HNO2
и.с
(сокращенное) NO2-+H2O
OH-
+ HNO2
pH
данный гидролиз идет по аниону соли, так как HNO2 - соль образованная слабой кислотой и сильным основанием.
Na2CO3 + 2H2O 2NaOH+H2CO3
и.п (ионное полное) 2Na+ +CO32- + 2H2O 2Na+ + 2OH- + H2CO3
и.с (сокращенное) CO32- + 2H2O 2OH- + HCO3 pH 7
данный гидролиз идет по аниону, так как соль Na2CO3 образована сильным основание и слабой кислотой.
Fe(NO3)3 +3H2O Fe(OH)3 + 3HNO3
и.п
(полное)
Fe3+
+ 3N +3H2O
Fe(OH)3
+ 3H+
+ 3N
+3H2O
Fe(OH)3
+ 3H+
+ 3N
и.с (сокращенное) Fe3+ + 3H2O Fe(OH)3+ 3H+ pH
гидролиз идет по катиону, так как данная соль Fe(NO3)3 образована сильной кислотой и слабым основанием.
Индивидуальное домашнее задание по теме «Общая химия»№ 2.
