
- •Глава 1. Атомно-молекулярное учение.
- •Глава 3. Окислительно-восстановительные реакции.
- •1) Тип: межмолекулярное ов
- •1) Тип: межмолекулярное ов
- •Глава 5. Химическая связь и строение молекул.
- •Глава 2. Комплексные соединения.
- •Глава 8. Химическое равновесие.
- •Глава 9. Электрохимические процессы.
- •Глава 10. Скорость химических реакций.
- •Глава 11. Концентрация растворов.
- •Глава 12. Свойства растворов неэлектролитов.
- •Глава 13. Растворы электролитов.
- •Глава 14. Ионные реакции и гидролиз солей.
- •Часть II. Неорганическая химия.
- •Глава 1. Введение в неорганическую химию.
- •Глава 2. Водороды и галогены.
- •Глава 3. Халькогены.
- •Глава 4. P-Элементы пятой группы.
- •Глава 5. P-Элементы четвертой группы.
- •Глава 6. P-Элементы третьей группы.
- •Глава 5. Химия s-элементов.
- •Глава 8. Химия d- и f-элементов.
- •8.5 Подгруппа хрома.
- •8.7 Семейство железа.
- •8.9 Подгруппа меди
|
|
|
|
|
|
Индивидуальное домашнее задание по теме «Общая химия» №1.
Вариант 7
Глава 1. Атомно-молекулярное учение.
Задача №12.
Чему равна масса азота, содержащаяся в нитрате натрия и в нитрате аммония, взятых по 5 моль?
Решение:
Дано:
νNaNO3=5 моль;
νNH4NO3=5 моль.
Найти mN -?
1)MNaNo3=85г/моль, MN=14г/моль.
 1
моль NaNO3
содержит 14 г. Азота, а 5 моль 14*5=70г.
1
моль NaNO3
содержит 14 г. Азота, а 5 моль 14*5=70г.
2) MNH4NO3=80г/моль.
1 моль NH4NO3 содержит 14*2=28г.азота, так как в 1 молекуле NH4NO3 содержится 2 атома азота) следовательно в 5 молях NH4NO3 содержится: 5*28=140г.азота.
Ответ: 70 и 140 г.
Задача №26. Определить эквивалентные массы металла и серы, если в 1,2 г металла образует2,0 оксида и 2,8 сульфида.
Решение:
Дано: mMe=1,2 г; mоскида=2 ; mсульфида=2,8г.
Найти MЭMe -?, MЭS-?
Оксид это вещество состоящее из двух элементов, один из которых кислород следовательно MO=mокс-mMe=2-1,2=0,8. mO=0,8г.
Аналогично: mS=2,8-1,2=1,6. mS=1,6г.
По закону эквивалентов найдем:
 =
=
 =
=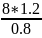 =
12 г/моль.
=
12 г/моль.
 =
=
 =
=
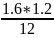 = 16 г/моль.
= 16 г/моль.
Ответ: =12г/моль; =16г/моль.
Глава 3. Окислительно-восстановительные реакции.
Задача № 67.
Для каждой окислительно-восстановительной реакции определить ее тип; указать восстановитель и окислитель; подобрать коэффициенты методом электронного баланса и методом полуреакций.
Решение:
а) 6FeSO4+K2Cr2O7+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O
1) тип: межмолекулярное ОВ
2)восстановитель-FeSO4, окислитель- K2Cr2O7

 3)
баланс:
3)
баланс:
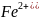 -1
-1 =
=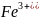 3
3
3
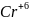 +3
=
+3
=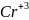 1
1
 4)
полуреакции:
=
-
4)
полуреакции:
=
-
Cr2O72-
+14 +6
=2
+6
=2 +7H2O
6
+7H2O
6
6
6
+ +14
=6
+2
+7H2O
1
+14
=6
+2
+7H2O
1
5)
MЭFeSO4
= =
152
г/моль;
=
152
г/моль;
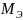 FeSO4
=
=
152г/моль;
FeSO4
=
=
152г/моль;
K2Cr2O7
=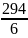 =
49 г/моль.
=
49 г/моль.
б) 2BiCl3+3SnCl2+12KOH=2Bi+3K2SnO3+6KCl+6H2O
2BiCl3+3SnCl2+12KOH=2Bi+3K2SnO3+6KCl+6H2O
1) Тип: межмолекулярное ов
2) окислитель-BiCl3, восстановитель- SnCl2

 3)
баланс: Bi3+
+
3
=Bi0 2
3)
баланс: Bi3+
+
3
=Bi0 2
6
3
Sn2+-2 = Sn+4
4)полуреакции: Bi3++3 =Bi0

 Sn2++6O
Sn2++6O =Sn
=Sn +3H2O+2
+3H2O+2
6 2
3
2Bi3++3Sn2++18O =2Bi0-6 +3SnO32-+9H2O+6
5)
MэBiCl3
= =105.167г/моль;
=105.167г/моль;
MэSnCl2
+ =
95г/моль
=
95г/моль
в) 4H2O2+3H2S=H2SO4+4H2O
1) Тип: межмолекулярное ов
2) окислитель-H2O2, восстановитель-H2S

 3)баланс:
O-
+1
O2-
3)баланс:
O-
+1
O2-
8
8
1
 S2-
-
8
S+6
S2-
-
8
S+6
 4)
полуреакции:
H2O2+2H++2
=2H2O
4)
полуреакции:
H2O2+2H++2
=2H2O
4
S2-+4H2O=SO42-+8H++8
8 1
4H2O2+8H++8 +S2-+4H2O=8H2O+SO42-+8H++8
5)
MЭH2O2
=
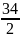 = 17г/моль;
= 17г/моль;
MЭH2S = = 4.25г/моль.
Глава 5. Химическая связь и строение молекул.
Задача № 100.
Чем объясняется способность многих элементов к образованию числа связей, превышающего число неспаренных электронов в их атомах? Какое состояние атома называют основным и возбужденным? В основном или возбужденном состоянии находятся атомы фосфора и серы при образовании молекул PCl3 и PCl5, H2S и SO3?
Решение:
Способность многих элементов к образованию числа связей, превышающих количество неспаренных электронов объясняется тем, что неспаренные электроны способны распариваться на другие орбитали.
Основное состояние атома соответствует наиболее устойчивому состоянию электрона в этом атоме при котором значение его энергии минимально. Любое другое состояние называется возбужденным.
|
|
|
В невозбужденном состоянии сера будет проявлять валентность II.
H2S содержит серу в валентности II, поэтому, сера в основном состоянии, SO3 содержит серу в валентности VI, значит, сера в возбужденном состоянии:
|
|
|
В=III
PCl3 содержит фосфор в валентности III, следовательно, PCl3 содержит фосфор в невозбужденном состоянии, PCl5 , содержит P в валентности (5) –это возбужденное состояние фосфора.

