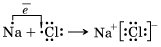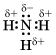- •I. По числу и составу исходных и образовавшихся веществ
- •II. По изменению степеней окисления химических элементов, образующих вещества
- •III. По тепловому эффекту
- •IV. По направлению
- •Гидролиз солей
- •Соли, образованные сильным основанием и слабой кислотой.
- •Соли, образованные сильной кислотой и слабым основанием.
- •Соли, образованные слабым основанием и слабой кислотой.
- •Общая характеристика неметаллов.
Первоначальные понятия
Химия – наука о веществах, их свойствах, превращениях и явлениях, сопровождающих эти превращения.
Вещества – это то, из чего состоят предметы (физические тела) окружающего мира.
Вещества, существующие в природе, постоянно претерпевают различные изменения.
Явления – различные изменения, которые происходят с веществами.
Физические явления – явления, не сопровождающиеся превращениями одних веществ, в другие (обычно изменяется агрегатное состояние веществ или их форма).
Химические явления – явления, в результате которых из данных веществ образуются другие.
Свойства веществ – признаки, позволяющие отличить одни вещества от других, или установить сходство между ними.

- агрегатное состояние; - характеризуют химические явления,
- цвет; происходящие с веществами. Те реакции,
- плотность (ρ); которые характеризуют данное вещество.
- электропроводность;
- теплопроводность;
- температура кипения;
- температура плавления и т. д.
Строение атома
Атом – мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Электронная оболочка – совокупность движущихся вокруг ядра электронов.
Электрон – одна из элементарных частиц материи, обладающая массой покоя и элементарным отрицательным зарядом.
Атомное ядро – центральная, положительно заряженная, сложно организованная часть атома, состоящая из нуклонов, связанных между собой ядерными силами.
Нуклоны – общее название двух типов частиц, протонов и нейтронов.
С точки зрения атомной физики протон и нейтрон являются двумя состояниями одной и той же частицы – нуклона.
Нуклон – структурная единица ядра атома, которая может находиться в двух состояниях, протона и нейтрона.
Планетарная модель атома по Розерфорду количество протонов равно количеству электронов
ПЗ и ПС хим. элементов Менделеева
Периодический закон:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от строения внешних электронных слоев атомов.
Современное определение Периодического закона: Свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от зарядов их атомных ядер
Периодическая система химических элементов и строение атома
Таблица Периодической системы химических элементов графически отображает Периодический закон. Каждое число в ней характеризует какую-либо особенность в строении атомов:
порядковый (атомный) номер химического элемента указывает на заряд его атомного ядра.
номер периода соответствует числу энергетических уровней (электронных слоев) в атомах элементов данного периода;
номер группы соответствует числу электронов на внешнем уровне для элементов главных подгрупп и максимальному числу валентных электронов для элементов побочных подгрупп.
Периодичность изменения свойств слева на право по периодам – повторяемость числа электронов на внешнем энергетическом уровне.
В периоде с увеличением зарядов атомных ядер элементов (слева направо) металлические свойства ослабевают, а неметаллические усиливаются в силу того, что: возрастает число электронов на внешнем уровне атома; число энергетических уровней в атомах в пределах периода остается постоянным; уменьшается радиус атомов.
В группах (главная подгруппа) с увеличением зарядов атомных ядер элементов (сверху вниз) металлические свойства усиливаются, неметаллические ослабевают. Это объясняется тем, что: число электронов на внешнем уровне атомов остается одинаковым; увеличивается число энергетических уровней в атоме; увеличивается радиус атомов.
Химическая связь
Химическая связь – ионная и ковалентная.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Х.с. – совокупность сил, действующих между атомами или группой атомов и приводящих к образованию устойчивой многоатомной системы.
Ионная химическая связь
Ионная химическая связь – это связь, образовавшаяся за счет электростатического притяжения катионов к анионам.
Атомы, присоединившие «чужие» электроны, превращаются в отрицательные ионы, или анионы. Атомы, отдавшие свои электроны, превращаются в положительные ионы, или катионы. Понятно, что между анионами и катионами возникают силы электростатического притяжения, которые и будут удерживать их друг около друга, осуществляя тем самым ионную химическую связь.
Так как катионы образуют в основном атомы металлов, а анионы – атомы неметаллов, логично сделать вывод, что этот тип связи характерен для соединений типичных металлов (элементы главных подгрупп I и II групп, кроме магния Mg и бериллия Be) с типичными неметаллами (элементы главной подгруппы VII группы).
|
Ковалентная химическая связь
Ковалентная химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар.
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной.
Например:
![]()
|
![]()
|
то есть посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов.
Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной.
Например: аммиак NH3
Азот – более электроотрицательный элемент, чем водород, поэтому общие электронные пары смещаются к его атому.
|
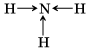
Металлическая связь
Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке, называют металлической.
Такая связь характеризуется небольшим числом валентных электронов и большим числом свободных орбиталей, что характерно для атомов металлов.
Схема образования металлической связи (М – металл):
|
![]()
Наличием металлической связи обусловлены физические свойства металлов и сплавов: твердость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический блеск. Вещества с металлической связью имеют металлическую кристаллическую решетку. В ее узлах находятся ионы или атомы металла, между которыми свободно (в пределах кристалла) перемещаются электроны («электронный газ»).
Химическая реакция
Химические реакции, или химические явления, – это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
I. По числу и составу исходных и образовавшихся веществ
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
Реакции соединения – это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
S + O2 = SO2 – из двух простых веществ образуется одно сложное.
|
Реакции разложения – это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
2HgO |
|
2Hg + O2↑ |
– из одного сложного вещества образуются два простых. |
|||
|
|
|
|
|
|
|
Реакции замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.
2Na + 2H2O = 2NaOH + H2↑
Реакции обмена – это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Реакция нейтрализации, идущая с образованием соли и воды:
NaOH + HNO3 = NaNO3 + Н2O
II. По изменению степеней окисления химических элементов, образующих вещества
Реакции,
идущие с изменением степеней окисления
элементов, или окислительно-восстановительные
реакции.
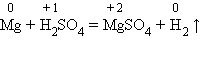
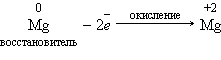
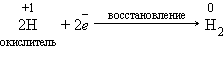
![]()
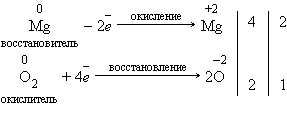
Реакции, идущие без изменения степеней окисления химических элементов. К ним, например, относятся все реакции ионного обмена, а также многие реакции соединения, например:
Li2O + Н2O = 2LiOH,
III. По тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
1.Экзотермические реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения.
N2 + O2 = 2NO – Q
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
4P + 5O2 = 2P2O5 + Q
Гидрирование этилена – пример экзотермической реакции:
CH2=CH2 + H2 |
|
CH3–CH3 |
+ Q |
Она идет при комнатной температуре.
2.Эндотермические реакции протекают с поглощением энергии.
Очевидно, что к ним будут относиться почти все реакции разложения, например:
Обжиг известняка:
CaCO3 |
|
CaO + CO2↑ |
– Q |
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
H2(г) + Cl2(г) = 2HCl(г) + 92,3 кДж
N2(г) + O2(г) = 2NO(г) – 90,4 кДж
IV. По направлению
По направлению различают:
Необратимые реакции протекают в данных условиях только в одном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды) и все реакции горения.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия – антонимы процессов: гидрирование – дегидрирование, гидратация – дегидратация.
Тепловой эффект химической реакции
По тепловому эффекту реакции делят на экзотермические и эндотермические.
1.Экзотермические реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения.
N2 + O2 = 2NO – Q
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
4P + 5O2 = 2P2O5 + Q
Гидрирование этилена – пример экзотермической реакции:
CH2=CH2 + H2 |
|
CH3–CH3 |
+ Q |
Она идет при комнатной температуре.
2.Эндотермические реакции протекают с поглощением энергии.
Очевидно, что к ним будут относиться почти все реакции разложения, например:
Обжиг известняка:
CaCO3 |
|
CaO + CO2↑ |
– Q |
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
H2(г) + Cl2(г) = 2HCl(г) + 92,3 кДж
N2(г) + O2(г) = 2NO(г) – 90,4 кДж
Химическое равновесие
Пример. Реакция синтеза аммиака является обратимой:N2 + 3H2 2NH3
Прямая и обратная реакции протекают одновременно в противоположных направлениях. Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия.
В состоянии равновесия скорости прямой и обратной реакции становятся равными – условие хим. равновесия
Современная формулировка принципа Ле-Шателье такова:Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия, т.е. равновесие смещается в сторону той реакции, которая ослабляет это воздействие.
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому. N2 + 3H2 2NH3 + Q
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам: При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции.
2. Влияние давления. Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам: При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом;
при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом
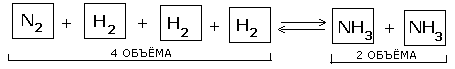
3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам: При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
давление, МПа 0,1 10 20 30 60 100
объемная доля NH3, % 0,4 26 36 46 66 80
Окислительно-восстановительные реакции
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции. Степень окисления – это условный заряд атома в соединении, вычисленный из предположения, что соединение состоит только из ионов.
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается. Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается. Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Растворы.
Раствором называется гомогенная (однородная) система, состоящая из двух или более независимых компонентов (растворенное вещество и растворитель), а также продуктов их взаимодействия. Компонент, количество которого преобладает в данной системе, называют растворителем.
По агрегатному состоянию растворы делятся:
газообразные растворы: воздух – это раствор кислорода, паров воды, углекислого газа СО2 и благородных газов в азоте;
твердые растворы: сплавы металлов;
жидкие растворы в свою очередь делятся:
растворы твердых веществ в жидкостях: соль+Н2О, сахар+Н2О , йод+Н2О
растворы газообразныхых веществ в жидкостях: лимонады, нашатырный спирт
растворы жидких веществ в жидкостях: уксус, водка (спирт + вода)
По относительным количествам растворенного вещества и растворители растворы бывают: разбавленные и концентрированные.
По соотношению преобладания частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и перенасыщенные.
Насыщенный раствор - это раствор, который находится в равновесии с твердой фазой растворенного вещества и содержит максимально возможное при данных условиях количество этого вещества.
Раствор концентрация которого ниже концентрации насыщенного раствора называется ненасыщенным. В таком растворе можно при тех же условиях растворить дополнительное количество того же самого вещества.
Перенасыщенным называется раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем возможно в насыщенном растворе. Перенасыщенный раствор нестабилен, и при изменении условий (например при энергичном встряхивании или внесении кристаллика соли – затравки для кристаллизации) образуется насыщенный раствор и осадок кристаллов соли.
Количественной характеристикой соотношения компонентов насыщенного раствора является растворимость. Наиболее распространенными способами такой характеристики служат:
коэффициент растворимости вещества (Р) – наибольшая масса вещества, способная при данной температуре раствориться в 100 г растворителя. Например, при 20ْ С в 100 г воды с образованием насыщенного раствора растворяется 36,0 г NaCI, значит Р(NaCI) = 36.
молярная растворимость вещества (S) - число молей вещества, способное при данной температуре раствориться в 1 л указанного растворителя с образованием насыщенного раствора. Так, S(NaCI) = 6,154 моль\л
коэффициент поглощения газа –наибольший объем газа, который может раствориться в единице объема растворителя при данной температуре и парциальном давлении газа 1 атм. Так при 20ْ С коэффициенты поглощения водой азота и кислорода, молекулы которых неполярны,составляют соответственно 0,016 и 0,031. Для газов, молекулы которых полярны, коэффициент их поглощения водой значительно выше, например для HCI – 500, NH3 – 1300.
Растворимость веществ существенно зависит от природы растворяемого вещества и растворителя, температуры и давления.
Зависимость от природы реагирующих веществ
Наибольшая растворимость достигается тогда, когда эти силы межмолекулярного взаимодействия имеют подобный характер: «подобное растворяется в подобном». Так вещества с ионным типом химической связи (соли, щелочи) или, полярные (спирты, альдегиды) хорошо растворимы в полярных растворителях, например в воде. И наоборот малополярные соединения, например оксид углерода (II) хорошо растворимы в неполярных соединениях, например в сероуглероде.
Зависимость от температуры.
Так как растворение процесс обратимый, значит к нему применим принцип Ле-Шателье: если растворение вещества происходит с поглощением теплоты, то повышение температуры приводит к увеличению растворимости.
Для большинства твердых веществ повышение температуры способствует увеличению растворимости.
Для газов повышение температуры способствует уменьшению растворимости, так как связи между молекулами растворимого вещества и растворителя - непрочные.
Теория электролитической диссоциации
Электролитами он назвал вещества, водные растворы которых проводят электрический ток, а неэлектролитами – вещества, водные растворы которых не проводят электрический ток.
Для объяснения свойств водных растворов электролитов шведский ученый С. Аррениус (1859–1927) в 1887 г. предложил теорию электролитической диссоциации. Согласно этой теории, при растворении в воде электролиты распадаются на свободные ионы. Этот процесс назвали электролитической диссоциацией. Растворы веществ тогда становятся проводниками электрического тока, когда они содержат ионы (положительно или отрицательно заряженные частицы), которые в электрическом поле приходят в направленное движение.
Электролитами могут быть только вещества с ионной и ковалентной полярной связями (соли, основания, кислоты).
Степень электролитической диссоциации. Сильные и слабые электролиты
С. Аррениус для количественной характеристики электролитической диссоциации ввел понятие степени электролитической диссоциации, обозначаемой греческой буквой α.
Степень электролитической диссоциации – это отношение числа молекул электролита, распавшихся на ионы, к общему числу растворенных молекул.
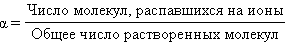
Если α = 0, то вещество совсем не распадается на ионы, оно является неэлектролитом. К неэлектролитам относятся вещества с ковалентными малополярными и неполярными связями, такие, как эфиры, углеводороды, кислород, азот и др.
Степень электролитической диссоциации может иметь значение от 0 до 1 (в процентах от 0 до 100 %).
Сильные электролиты – это такие электролиты, которые в водных растворах (даже концентрированных) практически полностью диссоциируют на ионы. У таких электролитов степень диссоциации стремится к 1 (100 %). К сильным электролитам относятся почти все соли, неорганические кислоты (HNO3, HCl, HBr, HI, HClO4, НМnО4, H2SO4), щелочи (LiOH, NaОН, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2).
Слабые электролиты – это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы. Их степень диссоциации значительно меньше 1 (100 %), в большинстве случаев она стремится к нулю. Но при разбавлении, как вы помните, степень диссоциации увеличивается.
К слабым электролитам относятся: многие неорганические кислоты (H2S, HF, H2CO3, H2SiO3, HNO2, H2SO3), органические кислоты, основания (за исключением щелочей), гидрат аммиака NH3 ∙ H2O, вода H2O, некоторые соли.
Различают три типа сред: нейтральную, щелочную, кислотную.
С точки зрения теории электролитической диссоциации основания - это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид - ионов ОН-.
В общем виде уравнение электролитической диссоциации основания имеет вид:
Основание -> Катион основания + Гидроксид - ион
NaOH Na++ OH-
Ba(OH)2 Ba2++ 2OH-
NH3·H2O NH4++ OH-
Кислоты. Кислоты исторически получили своё название из-за кислого вкуса водных растворов таких веществ, как хлороводород или уксусная кислота. С точки зрения теории электролитической диссоциации кислоты - это вещества, диссоциирующие в водном растворе с образованием катионов одного вида - катионов водорода Н+.
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
Кислота -> Катион водорода + Анион кислотного остаткаH2SO4 2H+ + SO42-
CH3COOH H+ = CH3COO-