
- •Химия (общая)
- •Введение
- •Раздел I. Опорные конспекты
- •Тема 1. Основые классы неорганических соединений
- •1. Оксиды
- •К лассификация оксидов
- •2. Кислоты
- •Классификация кислот
- •3 . Основания и амфотерные гидроксиды
- •Классификация оснований
- •1. По числу гидроксильных групп (он−1):
- •По степени растворимости в воде:
- •По степени диссоциации (α):
- •Классификация солей
- •1. Средние
- •2. Кислые
- •3. Основные
- •6. Комплексные
- •4. Двойные Состоят из двух различных атомов Ме и кислотных остатков одной кислоты
- •5. Смешанные
- •5. Ионные уравнения реакций
- •6. Генетическая связь между классами неорганических соединений
- •Основной оксид
- •Основание
- •Кислота
- •Задача №1
- •Тема 2. Строение атома
- •Электронная структура многоэлектронных атомов:
- •5. Приведем примеры соединений в устойчивых степенях окисления (простое вещество, оксиды и гидроксиды см. П.11)
- •Тема 3. Ковалентная химическая связь
- •Тема 4. Энергетика химических реакций
- •Х имические реакции
- •Протекают с выделением тепла Протекают с поглощением тепла
- •С истемы
- •Изолированная Открытая
- •Задача №1
- •Задача №2
- •Тема 5. Химическая кинетика (скорость химических реакций)
- •Химические реакции
- •Х имические реакции
- •График зависимости скорости прямой и обратной реакции от времени
- •Смещение химического равновесия
- •Тема 6. Способы выражения концентрации растворов
- •Массовая доля растворённого вещества
- •Молярная концентрация раствора
- •Закон эквивалентов
- •Перевод одного способа выражения концентрации раствора в другой
- •Задача № 1
- •Задача №2
- •Тема 7. Физико-химические свойства растворов неэлектролитов
- •II Закон Рауля
- •Задача № 1
- •Задача № 2
- •Задача № 3
- •Тема 8. Растворы электролитов. Ионные уравнения реакций
- •Электролиты
- •Э лектролиты Сильные Слабые
- •Диссоциация кислот и оснований
- •Диссоциация солей
- •Ионные реакции обмена
- •Составление молекулярных уравнений к кратким ионным уравнениям реакции
- •Тема 9. Гидролиз солей
- •Основание
- •Кислота
- •Задача № 1
- •I ступень
- •Задача № 2
- •Задача № 3
- •Тема 10. Окислительно-восстановительные реакции
- •С.О. Можно определить:
- •Окислители:
- •Подбор коэффициентов в о.В.Р. Методом электронного баланса
- •Подбор коэффициентов ионно-электронным методом (метод полуреакций)
- •Кислая Щелочная Нейтральная
- •Кислая среда
- •Щелочная среда
- •Нейтральная среда
- •Расчёт э.Д.С.
- •Тема 11. Гальванические элементы (г.Э.) химические источники тока (х.И.Т.)
- •Цинковый и медный полуэлементы До замыкания цепи
- •Для замыкания цепи необходимы:
- •П осле замыкания цепи
- •Выводы:
- •Тема 12. Электролиз
- •Э лектролиз
- •Электролиз расплавов солей
- •Электролиз растворов солей
- •К атод: (вос-е) Анод: (ок-е)
- •Возможные процессы:
- •Электролиз растворов электролитов с растворимым анодом
- •Возможные процессы:
- •Задача № 1
- •Возможные процессы:
- •Задача № 2
- •Тема 13. Электрохимическая коррозия металлов
- •Анод Катод
- •Водородная деполяризация
- •Кислородная деполяризация
- •Раздел II. Задания для самостоятельнной работы Задание к теме 1. Основные классы неорганических соединений
- •Задание к теме 2. Строение атома
- •Задание к теме 3. Ковалентная связь
- •Задание к теме 4. Энергетика химических реакций
- •Задание к теме 5. Кинетика химических реакций
- •Задание к теме 6. Способы выражения концентраций
- •Задание к теме 7. Растворы неэлектролитов
- •Задание к теме 8. Растворы электролитов
- •Задание к теме 9. Гидролиз солей
- •Задание к теме 10. Окислительно-восстановительные реакции
- •Задание к теме 11. Электрохимия. Гальванические элементы
- •Задание к теме 12. Электрохимия. Электролиз
- •Задание к теме 13. Электрохимия. Коррозия металлов
- •Сделайте вывод по результатам расчёта.
- •Задание к теме 14. Свойства металлов
- •Экзаменационные вопросы
- •Алгоритм ответа по химии металлов:
- •Тесты для самоподготовки к экзамену Вариант №1
- •Установите соответствие:
- •34. Класс Формула
- •Установите правильную последовательность действий:
- •Окислительно-восстановительная реакция Тип
- •76. Виды коррозии: Примеры:
- •78. Вид коррозионных процессов: При контакте фаз:
- •Список рекомендуемой литературы
- •Окончание таблицы а.1
- •Приложение б
- •Приложение г
- •Химия (общая)
- •4 26069, Г. Ижевск, ул. Студенческая, 11
Раздел I. Опорные конспекты
Тема 1. Основые классы неорганических соединений
1. Оксиды
Оксиды – это соединения, состоящие из двух элементов, один из которых кислород в степени окисления –2.
Названия состоят из: ● слова оксид;
● названия элемента с указанием степени окисления (если она переменная).
К лассификация оксидов


Несолеобразующие
(индифферентные,
безразличные) N2O-оксид
азота (I),
NO-оксид
азота (II), CO-оксид
углерода (II),
SiO-оксид
кремния (II).









Гидроксиды = вода + оксид


Основные оксиды – это оксиды металлов в низших степенях окисления (+1,+2), которым соответствуют основания, и которые взаимодействуют с кислотами, кислотными оксидами, а некоторые – с водой.
Na2O → NaOH
CaO → Ca(OH)2
BaO → Ba(OH)2
K2O → KOH
Химические свойства основных оксидов:
1) CaO + 2HCl → CaCl2 + H2O
2) СaO + CO2 → CaCO3
3) CaO + H2O → Ca(OH)2
Кислотные оксиды – это оксиды неметаллов, а также оксиды металлов в высших степенях окисления (+5, +6, +7), которым соответствуют кислоты, и которые взаимодействуют с основаниями, основными оксидами и с водой.
СO2 → H2CO3 SO3 → H2SО4
SiO2 → H2SiO3 SO2 → H2SO3
N2O5 → HNO3 Cl2O7 → HClO4
N2O3 → HNO2 CrO3 → H2CrO4
P2O5 → H3PO4 FeO3 → H2FeO4
P2O3 → H3PO3 Mn2O7 → HMnO4
Химические свойства кислотных оксидов:
1) SO3 + 2 NaOH → Na2SO4 + H2O
2) SO3 + CaO → CaSO4
3) SO3 + H2O → H2SO4
Амфотерные оксиды – это оксиды металлов в промежуточных степенях окисления (чаще всего +3,+4), которым соответствуют и основания и кислоты, поэтому они взаимодействуют как с кислотами, так и с основаниями.
Например: ZnO, BeO, Al2O3, Cr2O3.
 Zn(OH)2
– основание Al(OH)3
– основание
Zn(OH)2
– основание Al(OH)3
– основание
Z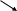 nO
Al2O3
nO
Al2O3
H2ZnO2 – кислота кислоты:
H3AlO3 – ортоалюминиевая
HAlO2 – метаалюминиевая
Химические свойства амфотерных оксидов:
1) ZnO +2 HCl → ZnCl2 + H2O
 ZnO + 2 NaOH t
Na2ZnO2
+ H2O
ZnO + 2 NaOH t
Na2ZnO2
+ H2O
цинкат натрия
ZnO + 2 NaOH + H2O → Na2[Zn(OH)4]
тетрагидроксоцинкат натрия
2) Al2O3 + 6 HCl → 2 AlCl3 + 3 H2O
Al2O3 + 6 NaOH t 2 Na3AlO3 + 3 H2O
ортоалюминат натрия
Al2O3 + 2 NaOH t 2 NaAlO2 + H2O
метаалюминат натрия
Al2O3 + 6 NaOH + 3 H2O → 2 Na3[Al(OH)6]
гексагидроксоалюминат натрия
Al2O3 + 2 NaOH + 3 H2O → 2 Na[Al(OH)4]
тетрагидроксоалюминат натрия
