
- •Химия (общая)
- •Введение
- •Раздел I. Опорные конспекты
- •Тема 1. Основые классы неорганических соединений
- •1. Оксиды
- •К лассификация оксидов
- •2. Кислоты
- •Классификация кислот
- •3 . Основания и амфотерные гидроксиды
- •Классификация оснований
- •1. По числу гидроксильных групп (он−1):
- •По степени растворимости в воде:
- •По степени диссоциации (α):
- •Классификация солей
- •1. Средние
- •2. Кислые
- •3. Основные
- •6. Комплексные
- •4. Двойные Состоят из двух различных атомов Ме и кислотных остатков одной кислоты
- •5. Смешанные
- •5. Ионные уравнения реакций
- •6. Генетическая связь между классами неорганических соединений
- •Основной оксид
- •Основание
- •Кислота
- •Задача №1
- •Тема 2. Строение атома
- •Электронная структура многоэлектронных атомов:
- •5. Приведем примеры соединений в устойчивых степенях окисления (простое вещество, оксиды и гидроксиды см. П.11)
- •Тема 3. Ковалентная химическая связь
- •Тема 4. Энергетика химических реакций
- •Х имические реакции
- •Протекают с выделением тепла Протекают с поглощением тепла
- •С истемы
- •Изолированная Открытая
- •Задача №1
- •Задача №2
- •Тема 5. Химическая кинетика (скорость химических реакций)
- •Химические реакции
- •Х имические реакции
- •График зависимости скорости прямой и обратной реакции от времени
- •Смещение химического равновесия
- •Тема 6. Способы выражения концентрации растворов
- •Массовая доля растворённого вещества
- •Молярная концентрация раствора
- •Закон эквивалентов
- •Перевод одного способа выражения концентрации раствора в другой
- •Задача № 1
- •Задача №2
- •Тема 7. Физико-химические свойства растворов неэлектролитов
- •II Закон Рауля
- •Задача № 1
- •Задача № 2
- •Задача № 3
- •Тема 8. Растворы электролитов. Ионные уравнения реакций
- •Электролиты
- •Э лектролиты Сильные Слабые
- •Диссоциация кислот и оснований
- •Диссоциация солей
- •Ионные реакции обмена
- •Составление молекулярных уравнений к кратким ионным уравнениям реакции
- •Тема 9. Гидролиз солей
- •Основание
- •Кислота
- •Задача № 1
- •I ступень
- •Задача № 2
- •Задача № 3
- •Тема 10. Окислительно-восстановительные реакции
- •С.О. Можно определить:
- •Окислители:
- •Подбор коэффициентов в о.В.Р. Методом электронного баланса
- •Подбор коэффициентов ионно-электронным методом (метод полуреакций)
- •Кислая Щелочная Нейтральная
- •Кислая среда
- •Щелочная среда
- •Нейтральная среда
- •Расчёт э.Д.С.
- •Тема 11. Гальванические элементы (г.Э.) химические источники тока (х.И.Т.)
- •Цинковый и медный полуэлементы До замыкания цепи
- •Для замыкания цепи необходимы:
- •П осле замыкания цепи
- •Выводы:
- •Тема 12. Электролиз
- •Э лектролиз
- •Электролиз расплавов солей
- •Электролиз растворов солей
- •К атод: (вос-е) Анод: (ок-е)
- •Возможные процессы:
- •Электролиз растворов электролитов с растворимым анодом
- •Возможные процессы:
- •Задача № 1
- •Возможные процессы:
- •Задача № 2
- •Тема 13. Электрохимическая коррозия металлов
- •Анод Катод
- •Водородная деполяризация
- •Кислородная деполяризация
- •Раздел II. Задания для самостоятельнной работы Задание к теме 1. Основные классы неорганических соединений
- •Задание к теме 2. Строение атома
- •Задание к теме 3. Ковалентная связь
- •Задание к теме 4. Энергетика химических реакций
- •Задание к теме 5. Кинетика химических реакций
- •Задание к теме 6. Способы выражения концентраций
- •Задание к теме 7. Растворы неэлектролитов
- •Задание к теме 8. Растворы электролитов
- •Задание к теме 9. Гидролиз солей
- •Задание к теме 10. Окислительно-восстановительные реакции
- •Задание к теме 11. Электрохимия. Гальванические элементы
- •Задание к теме 12. Электрохимия. Электролиз
- •Задание к теме 13. Электрохимия. Коррозия металлов
- •Сделайте вывод по результатам расчёта.
- •Задание к теме 14. Свойства металлов
- •Экзаменационные вопросы
- •Алгоритм ответа по химии металлов:
- •Тесты для самоподготовки к экзамену Вариант №1
- •Установите соответствие:
- •34. Класс Формула
- •Установите правильную последовательность действий:
- •Окислительно-восстановительная реакция Тип
- •76. Виды коррозии: Примеры:
- •78. Вид коррозионных процессов: При контакте фаз:
- •Список рекомендуемой литературы
- •Окончание таблицы а.1
- •Приложение б
- •Приложение г
- •Химия (общая)
- •4 26069, Г. Ижевск, ул. Студенческая, 11
Х имические реакции
 Необратимые
Обратимые
Необратимые
Обратимые
до конца (до завершения) в двух взаимнопро-
(), если образуется: тивоположных нап-
а ) осадок; равлениях ( )
б) газ;
в) слабый электролит.
Химическое равновесие – такое состояние системы, когда скорость прямой реакции равна скорости обратной реакции (1 = 2), а концентрации всех веществ в системе становятся постоянными.
nA
+ mB
qC + pD
График зависимости скорости прямой и обратной реакции от времени


1 пр.
1 пр.
1 = 2 динамическое химическое равновесие

2 обр
.
Вывод константы равновесия (К.р.)
Гомогенная реакция Гетерогенная реакция
2
 NO(Г)
+O2(Г)
2NO2(Г)
Ca
CO3(ТВ)
CaO(ТВ)
+ CO2(Г)
NO(Г)
+O2(Г)
2NO2(Г)
Ca
CO3(ТВ)
CaO(ТВ)
+ CO2(Г)
1. 1 = 2 (ЗДМ) 1. 1 = 2 (ЗДМ)
2. 1 = [NO]2 *[O2]*k1 2. 1 = k1
3. 2 = [NO2]2 *k2 3. 2 = [СO2] *k2
4. [NO]2 *[O2] *k1 = [NO2]2 *k2 4. k1 = [СO2] *k2
5. т.к. k1 и k2 – const, то 5. т.к. k1 и k2 – const, то
6 . k1 [NO2]2 6. k1 [СO2]
k2 [NO]2 *[O2] k2 1
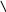
 k1
k1
k1
k1
k2 Р k2 р
7 . [NO2]2 7. КР = [CO2]
Р [NO]2 *[O2]
nA
+ mB
qC + pD


[C]q *[D]p для химической реакции (1)
Р [A]n *[B]
Смещение химического равновесия
Принцип Ле Шателье: если изменить одно из условий (С,р,Т), при которых система находилась в состоянии равновесия, то, равновесие смещается в сторону той реакции, которая противодействует произведённому изменению.
Влияние концентрации:
3 H2 + N2 2 NH3 3 H2 + N2 2 NH3
[H2] [H2]


[N2] [N2]
[NH3] [NH3]


Влияние давления:
3
 H2
+ N2
2 NH3
H2
+ N2
2 NH3
3 +1 = 4 моль 2 моль
р р
р

р

Влияние температуры:
3 H2 + N2 2 NH3 (- Н х.р.) экзотермическая реакция
t t
t
t
C исходная = С равновесная + С израсходованная к моменту равновесия
С равновесная = С исходная – С израсходованная к моменту равновесия
РЕШЕНИЕ ТИПОВОЙ ЗАДАЧИ ПО ТЕМЕ:
«ХИМИЧЕСКАЯ КИНЕТИКА»
Задача
Равновесие гомогенной системы: 2 NO + O2 2 NO2, - установилось при следующих концентрациях веществ:
[NO]p. = 0,8 моль/л., [O2]p.= 0,6 моль/л, [NO2]p. = 0,4 моль/л Вычислите исходные концентрации NO и O2.
Д ано: 2 NO + O2 2 NO2
[NO]p. = 0,8 моль/л, Решение:
[O2]p.= 0,6 моль/л, 1. Cисх. = С равн. + С израсх к моменту равновесия
[NO2]p. = 0,4 моль/л 2. Определим сколько моль NO и О2 израсходовано
[NO]исх. = ? к моменту равновесия.
[O2]исх = ?
Согласно уравнению реакции:
2 моль NO вступает в химическую реакцию и образуется 2 моль NO2
X моль NO - 0,4 моль NO2
[NO] израсх. = 2 *0,4/2 = 0,4 моль
1 моль O2 вступает в химическую реакцию и образуется 2 моль NO2
Х моль О2 – 0,4 моль NO2
[O2] израсх. = 0,4/2 =0,2 моль
3. [NO] исх. = 0,8 +0,4 =1,2 моль/л
[O2] исх. = 0,6 + 0,2 = 0,8 моль/л
Ответ: [NO]исх. = 1,2 моль/л, [O2] исх. = 0,8 моль/л
