
- •Тема I. Строение атом
- •Тема 2. Периодический закон и система химических элементов д. И. Менделеева. Химическая связь
- •Тема 3. Энергетика химических процессов
- •Тема 4. Химическая кинетика и химическое равновесие
- •Тема 5. Растворы
- •Тема 6. Окислительно-восстановительные реакции
- •Тема 7. Комплексные соединения
- •Тема 8. Электрохимия
- •Тема 9. Электрохимическая коррозия металлов и защита от коррозии
- •Тема I. Строение атомов и систематика химических элементов
- •Тема 2. Химическая связь
- •Тема 3. Энергетика химических процессов
- •Тема 4. Химическая кинетика и химическое равновесие
- •Тема 5. Растворы
- •Тема 6. Окислительно-восстановительные реакции
- •Тема 7. Комплексные соединения
- •Тема 8. Электрохимия
- •Тема 9. Обзор свойств элементов и их соединений на основе системы д. И. Менделеева в связи с применением их в сельскохозяйственном производстве
Тема 6. Окислительно-восстановительные реакции
С окислительно-восстановительными реакциями связаны процессы дыхания, обмена веществ, фотосинтеза, гниения, брожения, нервной деятельности человека и животных. При помощи окислительно-восстановительных реакций получают металлы, органические и неорганические соединения, проводят очиcтку сточных вод, газовых отходов и выбросов фабрик и заводов, что имеет большое значение для охраны окружающей среды. Окислительно-восстановительные реакции лежат в основе металлургических процессов, коррозии металлов, они лежат в основе преобразования энергии взаимодействующих химических веществ в энергию электрического тока.
Реакции, идущие с изменением степени окисления атомов, входящих в соcтав реагирующих веществ, называются окислительно-восстановительными:
![]()
Окислительно-восcтановительные реакции - это диалектическое единство одновременно протекающих противоположных процессов - окисления и восстановления.
Окисление - это процесс отдачи электронов атомом, молекулой или ионом, в результате степень окисления повышается. Вещества, отдающие свои электроны в ходе реакции, называются восстановителями.
Пример I.![]() ,
,
![]() .
.
Восстановление - это процесс принятия электронов атомом, молекулой или ионом, степень окисления при этом понижается. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями.
Пример 2.
![]() ,
,
![]() .
.
Окислительно-восстановительные свойства атомов и ионов обусловливаются строением их электронных оболочек и энергетическими характеристиками: энергией ионизации и сродством к электрону.
Процессы окисления и восстановления выражают электронными уравнениями. В них указывается изменение степени окисления частиц (атомов, ионов) и количество электронов, отданных восстановителем и принятых окислителем.
Например
![]() - процесс окисления.
- процесс окисления.
Степень окисления атома алюминия повысилась от нуля до +3. Это значит, что вещество из восстановленной формы превращается в окисленную. Восстановленной формой будет металлический алюминий, а окисленной – ион Al3+
![]() - процесс воcстановления.
- процесс воcстановления.
В результате реакции степень окисления элемента понижается, вещество из окисленной формы (S°) переходит в восстановленную форму (S2-).
Составление уравнений окислительно-восстановительных реакций
Уравнения окислительно-восстановительных реакций носят сложный характер. При их составлении рекомендуется:
1. Соблюдать равенство суммарного числа электронов, отданных восстановителем и принятых окислителем. Электронный баланс сохраняет электронейтральность системы.
2. Сохранить число атомов исходных веществ в продуктах реакции независимо от изменения состава соединений. Этот баланс основан на законе сохранения массы веществ при их химических превращениях.
3. Условно разделить суммарный химический процесс на частные реакции - окислительную и восстановительную, в которых наряду с молекулами (ионами) участниками превращений являются электроны. Число электронов, отданных восстановителем, является коэффициентом для окислителя в суммарном уравнении, в число электронов, принятых окислителем, является коэффициентом при восстанавливающейся частице.
4. При составлении уравнений с кислородосодержащими анионами
(![]() ...)
...)
нужно помнить, что в водных средах необходимо участие молекул воды и ионов Н+ и ОН- (в зависимости от реакции среды) в окислительно-восстановительном процессе. Если окислитель теряет кислород, переходя в катион, то атомы кислорода входят в состав образующихся Н2О или ОН-:
![]() .
.
Если восстановитель принимает кислород, переходя в анион с большим содержанием кислорода, то источником последнего является Н2О или ОН-:
![]() .
.
Уравнения окислительно-восстановительных реакций имеют сложный характер, их составление представляет трудную задачу. Рассмотрим один из методов составления этих уравнений - метод электронного баланса. При использовании этого метода весь процесс удобно проводить в несколько стадий:
1. Установление формул исходных веществ и продуктов реакции.
2. Определение степени окисления элементов в исходных веществах и продуктах реакции.
3. Определение числа электронов, отдаваемых восстановителем и принимаемых окислителем, и коэффициентов при восстановителях и окислителях.
4. Определение коэффициентов при всех исходных веществах и продуктах реакции, исходя из баланса атомов в левой и правой частях уравнения.
Например, составим уравнение реакции окисления фосфора азотной кислотой.
1. Записываем схему реакции, установив форму исходных и полученных веществ:
![]() .
.
2. Определяем степени окисления элементов в исходных веществах и продуктах реакции:
![]()
3. Составляем электронные уравнения, определяем число электронов, отдаваемых восстановителем и принимаемых окислителем. Так как количество отданных электронов должно быть равно количеству принятых, то находим наименьшее общее кратное число перемещающихся электронов (в данном случае оно равно 15). Это и будет баланс электронов для данной реакции:


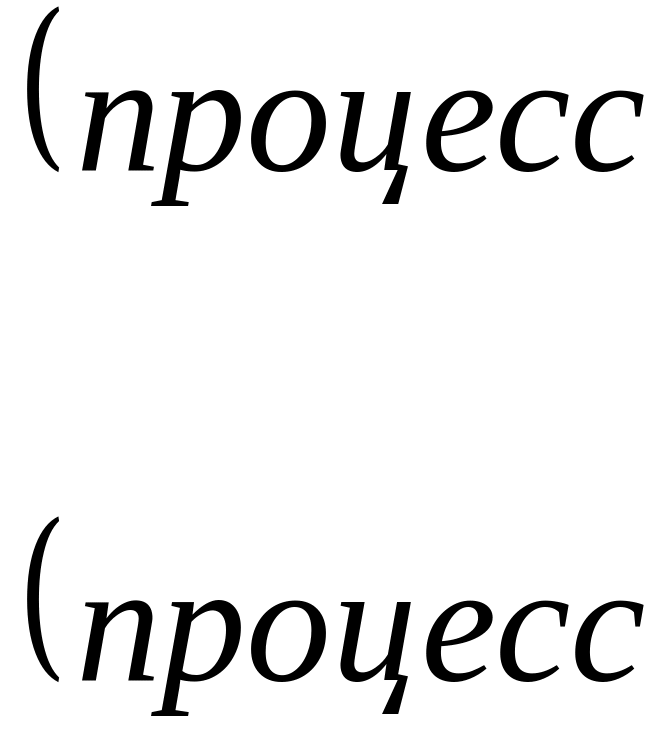
4. Находим коэффициенты при окислителе и восстановителе. Из электронных уравнений видно, что на каждые три молекулы фосфора приходится пять молекул азотной кислоты, следовательно, множители 3 и 5 являются коэффициентами перед формулами окислителя (HNO3) и восстановителя (Р):
![]()
5. Определяем коэффициенты для всех продуктов реакции; исходя из баланса атомов в левой и правой частях уравнения для данной реакции, находим, что в левой части недостает трех атомов водорода и двух атомов кислорода, следовательно, помимо указанных в схеме продуктов в реакции участвует вода:
![]()
6. Для того, чтобы убедиться, правильно ли для всех исходных веществ и продуктов реакции определены коэффициенты, подсчитываем количество атомов кислорода в левой и правой частях уравнения.
При составлении окислительно-восстановительных реакций необходимо учитывать, сколько атомов (ионов) изменяет степень окисления в ходе реакции. При составлении электронных уравнений это обязательно должно быть учтено.
Например:
As2S3 + НNO3 → H3AsO4 + H2SO4 + NО

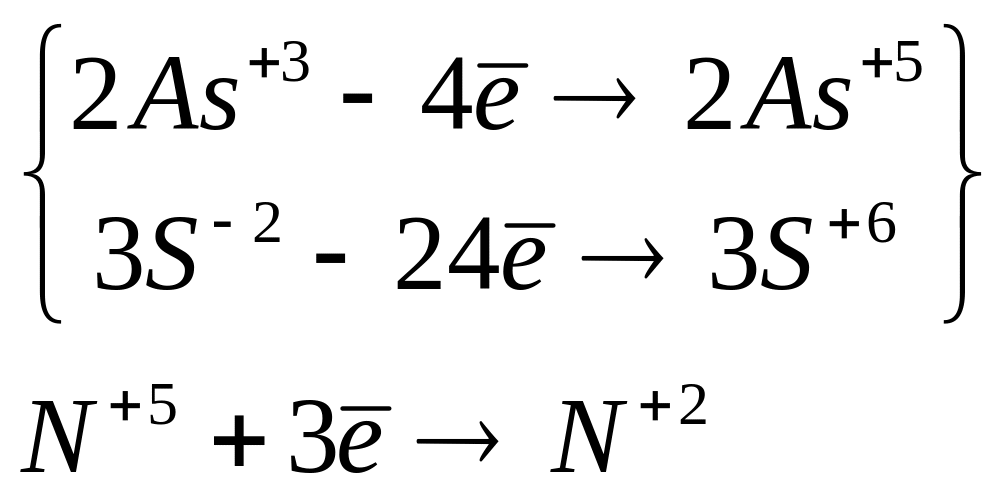
Как видно из данного уравнения, два иона мышьяка и три иона серы отдают 28 электронов, баланс равен 84. В качестве окислителя выступает HNO3, а воccтановителя - As2S3. Записываем схему реакции с учетом коэффициентов окислителя и восстановителя:
3As2S3 + 28HNO3 → 6H3AsO4 + 3H2SO4 + 28NO.
Для баланса по водороду и кислороду необходимо записать в левую часть уравнения четыре молекулы воды: 3As2S3 + 28НNO3 + 4H2O = 6H3AsO4 + 9H2SO4 + 28NO.
Данное уравнение является окончательным.
Итак, обобщим правила определения стехиометрических коэффициентов в окислительно-восстановительных реакциях. Поскольку количества отданных и принятых электронов должны быть равными, вводят дополнительные множители, устанавливающие электронный баланс. Эти множители подбираются по правилу нахождения наименьшего общего кратного и представляет собой стехиометрические коэффициенты при окислителе и восстановителе. Затем уравнивают количества атомов, не участвующих в окислительно-восстановительном процессе, в следующем порядке:
1) число атомов металлов, не изменяющих степени окисления;
2) ионы кислотных остатков;
3) количество молекул среды (кислоты или щелочи);
4) количество ионов водорода (молекулы образовавшейся воды);
5) правильность расстановки коэффициентов осуществляется подсчетом общего количества атомов кислорода слева и справа.
Рассмотренный многоступенчатый метод составления окислительно-восстановительных реакций приведен для разъяснения этой сложной задачи.
