
- •2. Неконкурентное ингибирование
- •3. Бесконкурентное ингибирование
- •3) Увеличение концентрации субстрата может повысить ионную силу реакционной среды и, как следствие, затормозить скорость ферментативной реакции.
- •Пептидазы
- •Условия действия ферментов
- •1) Kантикоагулянты ;
- •2) Kфибринолитические средства
- •3) Kантиагрегантные средства
- •Витамин b12 формируют красные кровяные клетки
- •Витамин b12 участвует в строительстве нервных клеток
- •Другие функции витамина b12
- •1. Синтез и биологическая роль серотонина
- •2. Синтез и биологическая роль щетилхолина
- •3. Синтез и биологическая роль γ-аминомасляной кислоты
- •Рыбий жир и витамин e
- •Витамин d в составе рыбьего жира
- •Отв1) мальтоза
- •Сахароза
- •Трегалоза
- •Упрощенная схема метаболизма гликогена
- •Важность поддержания нормального уровня глюкозы в крови
- •Как поддерживается нормальный уровень глюкозы в крови?
- •Глюкагон
- •76 Молекул атф.
- •60 Молекул атф
- •Роль секрета желез тонкой кишки в пищеварении.
- •Особенности пищеварения в тонкой кишке.
- •4 Атф. Энергия необходима для процессов активации глицерина и жирных кислот.
- •2 Молекулы, так как на синтез 3 молекул стеариновой кислоты требуется 24 атф, а при окислении 1 ацетил-коА образуется 12 атф.
- •1. Желчные кислоты: общие сведения
Задача № 1
Глутаматдекарбоксилаза катализирует реакцию:
В6
Глутаминовая кислота → ГАМК + СО2
1. По изменению концентрации каких веществ можно охарактеризовать активность фермента?
2. Как можно увеличить скорость данной реакции?
Отв1) Присутствие в реакционной среде некоторых ионов может активировать образование активного субстрат ферментного комплекса, и в этом случае скорость ферментативной реакции будет увеличивается. Такие вещества получили название активаторов. При этом вещества, катализирующие ферментативные реакции, непосредственного участия в них не принимают. На активность одних ферментов существенно влияет концентрация солей в системе, другие ферменты не чувствительны к присутствию ионов. Однако некоторые ионы абсолютно необходимы для нормального функционирования некоторых ферментов. Известны ионы, которые тормозят активность одних ферментов и являются активаторами для других. К числу специфических активаторов относятся катионы металлов: Na+, K+,Rb+,Cs+,Mg2+, Ca2+,Zn2+,Cd2+,Cr2+,Cu2+,
Mn2+,Co2+,Ni2+,Al3+. Известно также, что катионы
Fe2+,Rb+,Cs+ только в присутствии Mg действуют как активаторы, в других случаях эти катионы не являются активаторами. В большинстве случаев один или два иона могут активировать тот или иной фермент. « Например, Mg2+- обычный активатор для многих ферментов, действующий на фосфоримированные субстраты, почти во всех случаях может быть заменён Mn2+, хотя другие металлы его заменить не могут. Следует заметить, что щелочноземельные металлы вообще конкурируют друг с другом, в частности, Са2+ подавляет активность многих ферментов, активируемых Mg2+ и Zn2+. Причина этого до настоящего времени не ясна» (Г.А. Смирнова Основы биологии). Механизм влияния ионов металлов- активаторов может быть различным. Прежде всего, металл может быть компонентом активного центра фермента. Но может действовать как связующий мостик между ферментом и субстратом удерживая субстрат у активного центра фермента. Имеются данные о том, что ионы металлов способны связывать органическое соединение с белками и, наконец, один из возможных механизмов действия металлов как активаторов - это изменение константы равновесия ферментативной реакции. Доказано, что анионы также влияют на активность ряда ферментов. Например, очень велико влияние СI- на активность А - амилазы животного происхождения. Наряду с существованием активаторов ферментов известен ряд веществ, присутствие которых тормозит каталитическое действие ферментов или полностью инактивирует его. Такие вещества принято называть ингибиторами. Ингибиторы - это вещества, действующие определённым химическим путём на ферменты и по характеру своего действия, могут быть подразделены на обратимые и необратимые ингибиторы. Для обратимоготорможения Характерно равновесие между ферментом и ингибитором с определённой константой равновесия. Система такого типа характеризуется определённой степенью торможения, зависящей от концентрации ингибитора, при этом торможение достигается быстро и после этого не зависит от времени. При удалении ингибитора с помощью диализа активность фермента восстанавливается. Необратимое торможение, прежде всего, выражается в том, что диализ не способствует восстановлению активности фермента. И в отличии от обратимого торможения усиливается со временем, так что может наступить полное торможение каталитической активности фермента при очень низкой концентрации ингибитора. В этом случае эффективность действия ингибитора зависит не от константы равновесия, а от константы скорости, определяющей долю фермента, подвергшегося торможению в данном случае.
Отв2)
Ответ к задаче №1
Активность фермента определяется по убыли субстрата или накоплению продукта (глутаминовой кислоты, СО2, ГАМК). Увеличить скорость реакции можно за счет повышения концентрации субстрата, фермента или кофермента.
Задача № 2
Фермент трипсин способен расщеплять пептидные связи белков. Почему обработка трипсином приводит к инактивации многих ферментов?
Для обоснования ответа вспомните:
1. Что такое ферменты?
2. К какому классу ферментов относится трипсин?
Отв1
Ферме́нты, или энзи́мы[1] (от лат. fermentum, греч. ζύμη, ἔνζυμον — закваска) — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу).
Ферментативная активность может регулироваться активаторами и ингибиторами (активаторы — повышают, ингибиторы — понижают).
Белковые ферменты синтезируются на рибосомах, а РНК — в ядре.
Термины «фермент» и «энзим» давно используют как синонимы (первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной).
Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни слов латинского и греческого языков).
Отв2)
ТРИПСИН, фермент класса гидролаз. катализирующий гидролиз в белках пептидных связей, образованных остатками основных аминокислот - аргинина и лизина. катализирует также гидролиз сложных эфиров и амидов аминокислот (втрипсинч. гидрофобных) и некоторых карбоновых к-трипсин
трипсин-фермент большинства позвоночных. Синтезируется в поджелудочной железе в форме неактивного предшественника (профермента) трипсиногена, который в двенадцатиперстной кишке в результате отщепления N-концевого 6-членного фрагмента (под действием энтерокиназы) превращается в трипсин Фермент легко подвергается саморасщеплению (автолизу) с образованием смеси активных b-, g- и y-T.
трипсин способен превращать в активные ферменты все проферменты поджелудочной железы (напр., профермент фос-фолипазы, химотрипсиноген), в связи с чем занимает ключевое положение среди пищеваритрипсин ферментов.
Ответ к задаче №2
Ферменты являются белками, а трипсин действует на пептидные связи, что приводит к инактивации ферментов.
Задача № 3
Ингибитор снижает активность фермента до 30% от исходного уровня. Повышение концентрации субстрата катализируемой реакции восстанавливает 80% активности фермента. К какому типу относится данный ингибитор?
Для ответа:
1. Вспомните типы ингибирования.
2. Действие какого ингибитора зависит от концентрации субстрата?
Отв1)
Ингибиторы
М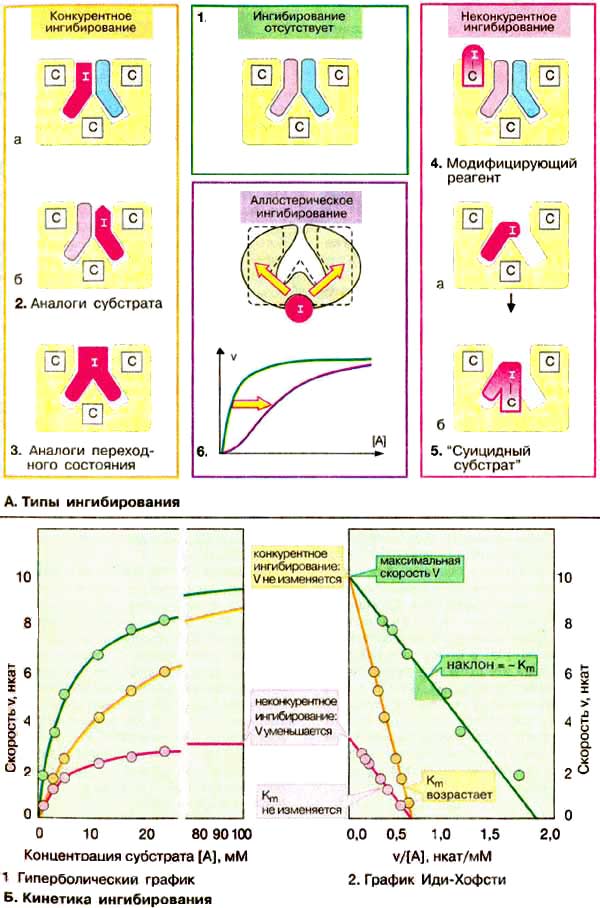 ногие
соединения могут влиять на обмен веществ,
модулируя активность соответствующих
ферментов. Особенно важные функции при
этом выполняют ингибиторы
ферментов.
Ингибиторами ферментов являются
многие лекарственные
вещества природного
или синтетического происхождения (см.
сс. 188, 250, 376 и 388). Метаболиты также
могут быть ингибиторами ферментов в
процессах регуляции (см. с. 116).
ногие
соединения могут влиять на обмен веществ,
модулируя активность соответствующих
ферментов. Особенно важные функции при
этом выполняют ингибиторы
ферментов.
Ингибиторами ферментов являются
многие лекарственные
вещества природного
или синтетического происхождения (см.
сс. 188, 250, 376 и 388). Метаболиты также
могут быть ингибиторами ферментов в
процессах регуляции (см. с. 116).
А. Типы ингибирования
Большинство ингибиторов ферментов действуют обратимо, т. е. не вносят в молекулу фермента каких-либо изменений после своей диссоциации. Однако существуют также необратимыеингибиторы ферментов, которые необратимо модифицируют целевой фермент. Принцип действия ингибитора, тип его ингибирования определяют путем сравнения кинетики реакции (см. с. 98) в присутствии ингибиторам без него (см. схему Б). Различают конкурентное (А, слева) инеконкурентное (А, справа) ингибирование. В регуляции обмена веществ важную роль играеталлостерическое ингибирование (А, 6).
Так называемые аналоги субстрата (2) имеют свойства, подобные свойствам субстрата целевого фермента. Они обратимо блокируют часть молекул имеющегося в наличии фермента, но не могут далее превращаться в продукт. Поэтому для достижения половины максимальной скорости реакции необходимы более высокие концентрации субстрата: в присутствии такого ингибитора константа Михаэлиса Km растет (Б). Субстрат в высоких концентрациях вытесняет ингибитор с фермента. Поэтому максимальная скорость V (см. с. 98) при этом типе торможения не претерпевает изменений. Так как субстрат и ингибитор конкурируют за место связывания на ферменте, данный тип торможения называют конкурентным. Аналоги переходного состояния (3) также действуют как конкурентные ингибиторы.
Если ингибитор реагирует с функционально важной группой фермента, не препятствуя связыванию субстрата, такое ингибирование называется неконкурентным (на схеме справа). В этом случае Kmостается неизменной, напротив уменьшается концентрация функционально активного фермента [Е]t и, следовательно, максимальная скорость реакции V. Неконкурентные ингибиторы действуют как правило необратимо, поскольку они модифицируют функциональные группы целевого фермента (4).
В случае так называемых "суицидных субстратов" (5) речь идет о субстратных аналогах, содержащих дополнительно реакционную группу. Вначале они связываются обратимо, а затем образуют ковалентное соединение с активным центром фермента. Поэтому ингибирование такими соединениями проявляется как неконкурентное. Известным примером такого ингибитора является антибиотик пенициллин (см. с. 250).
Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра (6). Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности (см. с. 118). Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
Отв2)
2. Неконкурентное ингибирование
Неконкурентное ингибирование тоже обратимо, но не может быть ослаблено или устранено повышением концентрации субстрата
В случае неконкурентного ингибирования ингибитор присоединяется к ферменту не в активном центре, где связывается субстрат, а совсем в другом месте. При этом кон формация молекулы фермента изменяется таким образом, что происходит обратимая инактивация его каталитического центра. Неконкурентные ингибиторы связываются обратимо как со свободным ферментом, так и с комплексом ES, образуя неактивные комплексы EI и ESI.
Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент. При данном типе ингибирования благодаря образованию стабильной ковалентной связи фермент часто подвергается полной инактивации, и тогда торможение становится необратимым (Н.З. Хазипов, А.Н. Аскарова, 2001).
Наиболее важные неконкурентные ингибиторы представляют собой образующиеся в живых организмах промежуточные продукты метаболизма, способные обратимо связываться со специфическими участками на поверхности некоторых регуляторных ферментов и изменять при этом активность их каталитических центров. Примером может служить ингибирование L-треониндегидратазы L-изолейцином (А. Ленинджер, 1985).
Примером необратимого ингибирования является действие йодацетата, ДФФ, а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это действие заключается в связывании и выключении функциональных групп или ионов металлов и молекуле фермента.
Следует указать, что неконкурентное ингибирование также может быть обратимым и необратимым, поскольку отсутствует конкуренция между субстратом и ингибитором за активный центр. Примеры необратимого ингибирования приведены ранее. При обратимом неконкурентном ингибировании субстрат S и ингибитор I связываются с разными центрами, поэтому появляется возможность образования как комплекса EI, так и тройного комплекса EIS; последний может распадаться с освобождением продукта, но с меньшей скоростью, чем комплекс ES.
Этот тип неконкурентного ингибирования чаще всего наблюдается у ферментов, катализирующих превращения более одного субстрата, когда связывание ингибитора не блокирует связывание субстрата с активным центром. Ингибитор при этом соединяется как со свободным ферментом, так и с ES-комплексом (Т.Т. Березов, Б.Ф. Коровкин, 1990).
3. Бесконкурентное ингибирование
В редких случаях степень торможения активности фермента может увеличиваться с повышением концентрации субстрата. Для этого типа торможения был предложен термин "бесконкурентное ингибирование".
Бесконкурентное ингибирование имеет место, когда ингибитор взаимодействует с ферментом только в составе фермент-субстратного комплекса, препятствуя его распаду (Уэбб Л., 1966).
Примером необратимого действия ингибиторов на ферменты могут служить фосфорорганические вещества, применяемые в качестве инсектицидов.
При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным
Один из механизмов такого торможения обусловлен возможностью соединения ингибитора с комплексом ES с образованием неактивного или медленно реагирующего тройного комплекса EIS (Т.Т. Березов, Б.Ф. Коровкин, 1990).
Ингибирование субстратом -- частный случай бесконкурентного ингибирования, когда две молекулы субстрата связываются с ферментом, что препятствует образованию продукта
Активность многих ферментов тормозится избытком субстрата, причем имеется несколько механизмов этого процесса.
1) Если в образовании фермент-субстратного комплекса участвует несколько функциональных групп фермента, то возможно одновременное присоединение к активному центру двух или более субстратов, что однозначно приведет к образованию неактивного комплекса.
2) В случае избытка субстрата возможно его присоединение не только к активному центру, но и к другим химическим группировкам, функционально связанным с активным центром. Такого рода взаимодействие может помешать ферментативной реакции.
