
- •«Дальневосточный государственный университет»
- •АкАдемия экологии, морской биологии и биотехнологии
- •Учебно-методический комплекс дисциплины
- •Специальность — 020201.65 Биология Форма подготовки - очная
- •Содержание учебно-методического комплекса дисциплины (умкд) «органическая химия»
- •Аннотация умк
- •«Дальневосточный государственный университет»
- •АкАдемия экологии, морской биологии и биотехнологии рабочая учебная программа дисциплины
- •Специальность — 020201.65 Биология Форма подготовки - очная
- •I. Структура и содержание теоретической части курса Лекции 34 часа
- •1. Основные понятия и определения в органической химии (1 час.)
- •2. Изомерия органических веществ (1час.)
- •3. Номенклатура органических соединений (1 часа)
- •1. Алканы (2 часа)
- •2. Алкены (2 часа)
- •3. Алкины и диены (2 часа)
- •4. Арены (2 часа)
- •1. Спирты (2 часа)
- •2. Фенолы (1 час.)
- •3. Карбонильные соединения (2 часа)
- •4. Карбоновые кислоты и их производные (2 часа)
- •5. Оксикислоты. Оптическая изомерия винных кислот (1 час)
- •6. Двухосновные и оксокислоты (2 часа)
- •1. Нитросоединения (1 час)
- •2. Амины (2 часа)
- •3. Соли диазония. Азосоединения (2 часа.)
- •4. Ароматические гетероциклические соединения (3 часа)
- •II. Структура и содержание практической части курса
- •Лабораторные работы (34 часов)
- •III. Контроль достижения целей курса
- •Перечень типовых экзаменационных вопросов
- •IV. Тематика и перечень курсовых работ и рефератов
- •V. Учебно-методическое обеспечение дисциплины Список литературы
- •Лекция 2
- •Лекция 3
- •Лекция 4
- •Лекция 5
- •Лекция № 6
- •Лекция № 7
- •Лекция 8
- •Лекция 9
- •Лекция № 10
- •Лекция 11
- •Лекция 12
- •Лекция 13
- •Лекция 14
- •Лекция 15
- •Лекция 16
- •Лекция 17
- •Элементный качественный анализ органических веществ
- •Опыт 1. Определение углерода и водорода в органических веществах
- •Сплавление с металлическим натрием.
- •Проба на азот
- •Перегонка. Определение показателя преломления
- •Выполнение работы.
- •Перекристаллизация
- •Экспериментальная часть
- •Лабораторная работа № 4 Определение температуры плавления
- •Лабораторная работа № 5 Экстракция. Хроматография на незакрепленном слое сорбента
- •Часть 1. Экстракция
- •Часть 1. Хроматография
- •Лабораторная работа № 6 Качественный функциональный анализ углеводородов, спиртов и фенолов
- •Часть 1. Углеводороды
- •Экспериментальная часть
- •Часть 2. Спирты и фенолы
- •Экспериментальная часть
- •Опыт № 1. Растворимость в воде и отношение к индикаторам.
- •Опыт № 2. Отношение спиртов и фенолов к щелочам.
- •Опыт № 3. Образование и гидролиз алкоголятов.
- •Лабораторная работа № 7 Качественный функциональный анализ карбонильных соединений и углеводов.
- •Экспериментальная часть
- •Лабораторная работа № 8 Качественный функциональный анализ карбоновых кислот, аминов и аминокислот.
- •Часть 1. Карбоновые кислоты
- •Выполнение работы. Цель работы: знакомство с реакциями карбоновых кислот и их производных и идентификация неизвестного кислородсодержащего углеводорода.
- •Часть 2. Амины и аминокислоты
- •Экспериментальная часть
- •Специальность – 020201.65 «Биология»
- •Тема 1. Изомерия и номенклатура органических соединений
- •1. Какие из перечисленных веществ являются межклассовыми изомерами?
- •2. Какие из перечисленных ниже видов изомерии (попарно) относятся к структурной изомерии?
- •3. Какие из перечисленных веществ являются изомерами? к какому виду изомерии относятся эти изомеры?
- •4. Какие виды изомерии характерны и сколько оптических изомеров существует для 2,3,4,5-тетрагидроксипентаналя? Контрольные вопросы
- •Задания для самостоятельного решения
- •Тема 2. Способы получения и химические свойства углеводородов
- •1. Какие реакции характерны для алканов?
- •2. В каких условиях протекает реакция хлорирования метана?
- •Контрольные вопросы
- •Задания для самостоятельного решения
- •Тема 3. Кислородсодержащие органические соединения
- •Задания для самостоятельного решения
- •Тема 4. Азотсодержащие органические соединения
- •Задания для самостоятельного решения
- •Специальность – 020201.65 «Биология»
- •Пример: Карточка № 1
- •Билет № 1
- •Тексты контрольных работ
- •Контрольная работа «Циклоалканы, простые эфиры»
- •Тестовые задания Углеводороды (вариант 1)
- •2. При взаимодействии циклопентена с n-бромсукцинимидом при освещении образуется:
- •3. Из каких двух соединений можно (по крайней мере, на бумаге) получить по схеме диенового синтеза 1,2,4,5-тетраметилциклогексадиен-1,4?
- •5. Продуктом взаимодействия этилбензола с сн3со-ci в присутствии AlCi3 является:
- •Углеводороды (вариант 2)
- •Итоговая контрольная работа
- •Специальность – 020201.65 «Биология»
- •Специальность – 020201.65 «Биология»
- •Техника безопасности при работе в лаборатории органической химии
Часть 2. Амины и аминокислоты
Цель работы: знакомство с реакциями аминов и аминокислот.
Краткая теория
Амины.
Аминами называются производные аммиака, в которых один, два или все три атома водорода замещены на углеводородные радикалы. Амины могут быть первичными - RNH2, вторичными - R2NH и третичными – R3N.
При выполнении работы следует помнить следующее:
1. Химические свойства аминов определяются наличием неподеленной электронной пары у атома азота. Эта пара электронов обуславливает то, что амины являются основаниями (акцепторами протонов), а также выступают в роли нуклеофилов. Основные свойства аминов зависят от количества и строения радикалов, связанных с азотом. Электронодонорные заместители усиливают основность аминов, так как увеличивают электронную плотность на атоме азота. Растворимые в воде алифатические амины образуют гидроксиды алкиламмония:
 R2NH
+ H2O
(R2NH2)OH
R2NH2+
+
OH-
R2NH
+ H2O
(R2NH2)OH
R2NH2+
+
OH-
2. В ароматических аминах неподеленная пара электронов атома азота участвует в сопряжении с ароматическим ядром и становится менее склонной к образованию связи с протоном. Поэтому ароматические амины являются более слабыми основаниями и образуют соли только с достаточно сильными кислотами:
ArNH2 + H+ ArNH3+
3. Как нуклеофилы амины вступают в реакции алкилирования и ацилирования. При взаимодействии с азотистой кислотой в кислой среде первичные амины образуют диазониевые соли:
HX
 RNH2
+ HNO2
(R-N=N)+
X-
RNH2
+ HNO2
(R-N=N)+
X-
4. Соли диазония алифатических аминов очень неустойчивы и сразу разлагаются с выделением азота, поэтому продуктами реакции диазотирования первичных алифатических аминов являются спирты:
HX H2O
AlkNH2 + HNO2 (Alk-N=N)+ X- AlkOH + N2 + HX
5. Соли диазония ароматических аминов более устойчивы и могут реагировать без выделения азота. При их взаимодействии с фенолами или ароматическими аминами (реакция азосочетания) образуются окрашенные соединения. Реакция азосочетания является качественной реакцией на первичные ароматические амины.
Ar,OH
 (Ar-N=N)X
Ar-N=N-Ar,OH-п
(Ar-N=N)X
Ar-N=N-Ar,OH-п
Аминокислоты
Аминокислоты - органические соединения, которые содержат две функциональные группы, противоположные по характеру: кислую карбоксильную и основную аминогруппу. Это создает возможность образования внутренних солей – бетаинов: +NH3(CH2)nCOO-.
Аминокислоты вступают в реакции по карбоксильной группе – этерификация, солеобразование. С основаниями образуют обычные соли, а с ионами тяжелых металлов комплексные соли:
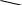
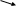 O=C-O
NH2-CH2
O=C-O
NH2-CH2
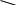
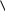 Cu
Cu
CH2-NH2 O-C=O
Аминокислоты также дают все реакции аминов: образуют соли с кислотами, алкилируются, ацилируются, вступают в реакции конденсации с карбонильными соединениями. При реакции аминокислот, содержащих первичную алифатическую аминогруппу, с азотистой кислотой происходит диазотирование и распад соли диазония с образованием гидроксикислоты:
H2O
R-CH-COO- + HNO2 (R-CH-COO-) R-CH-COOH
+NH3 N2+ -N2 OH
Эта реакция используется для качественного определения -аминокислот в растворе.
Кроме реакций по амино- и карбоксильной группам аминокислоты могут вступать в реакции и за счет радикалов. Например, аминокислоты, которые содержат ароматические кольца, нитруются концентрированной азотной кислотой.
