
- •2*1 Заттардың молекулалық массаларын
- •2.13)Атом,молекула,атомдық және молекулалық масса,изотоптар,моль ұғымдарын мысалдар келтіре отырып дәлелдеңіз.
- •3.7 Тотығу-тотықсыздану реакцияларын іске асыру үшін термодинамикалық сипаттамалар қолдаңыныз
- •3*10Электролиттік диссоциация теориясы
- •Қышқылдардың, сілтілердің, тұздардың диссоциациялануы Қышқылдар
- •Негіздер[өңдеу]
- •Орта тұздар
- •Қышқыл тұздар[өңдеу]
- •Негіздік тұздар[өңдеу]
- •3*11. Диссоциациялану константасы, сұйылту заңын бейорганикалық химияда қолданыңыз
- •3* 12 Күшті және әлсіз электролиттер ерекшеліктері
1* 1. Элементтердің атомдық массасын анықтау әдістерін түсіндіріңіз
Әртүрлі заттардың құрамына кіретін атомдардың массалары бірдей болмайтындықтан элементердің атомдарының массасын өзара алыстырып табу қажеттігі туыдайды. Д.Дальтонның ең жеңіл зат сутектің бір атомының массасын оныңөлшемі ретінде пайдаланған.1860 жылы француз ғалымы Ж.Стасс оттек атомының массасының өлшем бірлігі ретінде ұсынған. Сонда сутек атомының масасы 1,008 болып шыққан.
1961 жылы халықаралық таза және қолданбалы химия ұсынысымен атом массасының шкаласы ретінде физика ғылымындағыдай ең жеңіл көміртек атомының изотопы 12С қолданыла бастады. Қазіргі пероидтық кестеде атомның атомдық массасы көміртек массасының атомдық бірлігіне 12С/12 бөлігіне шағылып алынған. Табиғи элементтердің атомдық массасы оның изотоптарының салсытырмалы мөлшерін есерке ала отырып табатын орташа шаманы көрсетеді. Табиғи хлор екі изотоптан тұрады: оның 75,53% массасы 34,969 м.а.б тең 35Cl изотопы қалған 24,47 % массасы 36,962 м.а.б. тең 37Cl изотопы. Осы мәліметтерді пайдаланып хлордың орташа атомдық массасын есептеп шығаруға болады:Ar(Cl) (75,53%)(34,969m.a.b)/100+(24,47%)(36,966 m.a.b)/100=26,412 m.a.b.+9,0
45m.a.b=35,457m.a.b.
Қазіргі кезде атомның массасын дәл табу үшін масса спектометр деп аталатын аспап қолданылады. Газ күйіндегі атомдардың немесе молекулалардың шоғыры масса спектометрдің вакуумды камерасына бағытталады. Ондағы жоғары энергиясы бар электрондар ағынымен қиылысып молекула ионданады. Түзілген оң иондар құбырдың сыртынан келіп тұрған жоғары кернеудің әсерінен вакуумы ортада х саңылаудан өтіп молекула күйіндегі қалған газдардан ажырап күшті магнит полюстерінің арасынан өзінің ұшу траекториясын өзгертеді. траекторияның ауытқу дәрежесі әр ионның зарядының массаға қатынасына е/m тәуелді.
Әр элемент атомының үйреншікті масса бірліктерін кг арқылы өлшесек тым аз сан шығар еді. Мысалы сутек атомы массасы mᴴ=1,672*10⁻²⁷кг, оттектікі m=2,667*10⁻²⁷кг көміртектікі m=1б1993*10⁻²⁶
Ar(H)=1,674*10⁻²⁷кг/ 1/12*10⁻²⁶кг=1,0079
Ar(O)= 2,667*10⁻²⁷кг/ 1/12*1,993*10⁻²⁶кг=15,9994
Элементтердің атомдық массасы оның көміртектік бірлікпен көрсетілген атомның массасы.
Канниццаро атомдық массалар табудың жалпы әдісін ұсынды.
Қосылыстар |
Молекулалық масса |
Көміртек.ң пайыздық мәні |
Мол.массаның комір,ке тиесілі бөлігі |
Коміртек (I)оксиді |
28 |
42,86 |
12 |
Бензол |
78 |
92,31 |
72 |
Коміртек диоксиді |
44 |
27,27 |
12 |
Нафталин |
128 |
93,75 |
120 |
Этил спирті |
46 |
52,2 |
24 |
Ацетон |
68 |
62,07 |
36 |
Атомдық массасы ізделген элементтің (айталық көміртек), ұшқыш қосылыстарынан мүмкіндігінше көбірек алып, олардың молекулалық массаларын табады, одан химиялық талдау арқылы қосылыстың құрамындағы сол элементтің пайыдық мәнін табады. Осы екі санға сүйеніп, әрбір қосылыстың молекулаліқ массасын істеліп отырған элементке тиесілі бөлімін есептеп шығарады.
Бұл кестеден мол. Массаның көміртекке тиесілі бөлімін көрсетеін сандардың ең кішісі он екі екенін көреміз. Бұл көміртектің атомдық массасы болады. Ұшқыш қосылыс түзбейтін элементтердің мысалы металлдардың атомдық массасын табу үшін Дюлонг пен Птидің заңын пайдаланады.
Заттың қатты күйдегі меншікті жылу сыйымдылығының атомдық салмаққа көбейтіндісі 26 Дж/моль*К жуык туракты шама.
Атомдык массага кобейтиндиси атом жылусыйымдылыгы деп аталады 22-29 Дж\моль*К аралыгында болады. А*С= 26 Дж/моль*К
Мысал: металлдың меншікті жылусйымьдылығы 0.5Дж\г*К тен. Сол металлдын атомдык массасы А=26Дж\моль*К\0.5Дж\г*К=52 г\моль А-атомдардын молярлык массасы. Осы әдістердің қайсысымен болса да табылған атомдық массаны сол элементтің эквивалентінің молярлық массасымен салыстырып жөндеуге болады, ал элементтің эквивалентінің молярлық массасы әртүрлі қосылыстарының талдауларынан есептеп шығаруға болады. Элементтің атомдарының молярлық массасы , оның эквивалентінің молярлық массасы және валентігі арасында мынандай байланыс бар А=Э*В
1* 2.Электронның ашылуы және оның касиеттерін түсіндіріңіз
ХІХ ғасырдың соңы мен ХХ ғасырдың басында ғылымның дамуы бұрында беймәлім болып келген заттың ішкі құрылысының сырларын ашып беруге мүмкіндік туғызды. Табиғат танудағы революция,- деп бұл кезде химия ғылымы үшін аса маңызды қарапайым бөлшек - электронның атом құрамына кіретіні анықталды. Бұл жаңалық 1879 жылы жүргізілген ағылшын ғалымы У.Крустың тәжірибесінен басталды. Крукс ауасын сорып азайтқан шыны балонның екі ұшына электродтар орнатып оларды жоғары кернеулі тоқ көзімен қосқанда (-1000В) катод пластинкадан көзге көрінбейтін сәуле шығатынын байқайды.Бұл сәуле ағыны жолында кездескен ұсақ қағаз қиқымдарын өзімен бірге ілестіре кетіп шыныға тиген жерін қыздырып сәулелендіреді.Демек катод сәулелері деп аталған бұл сәуленің кинетикалық энергиясы,өзіне сай массасы бар.Әрі катод сәулелері электр және магнит өрісінде бағытын өзгертіп,оң полюске қиыстап ,өзінің теріс зарядты бөлшектердін ағыны екенін танытты.Катод әулелерінің бір ерекшелігі катод болып тұрған металдың табиғатына және шыны түтіктің ішіндегі газ түрінде ешбір тәуелсіздігі.Олай болса бұл сәуле кез келген атомнан шығады. Ағылшын физигі Дж.Томсон 1897 ж.катод сәулелеріне байланысты барлық мәліметтерді жинақтай отырып,оны атомның ең кіші теріс зарядты бөлшегі деген қорытындыға келді.Екінші ағылщын ғалымы Стонэйдің ұсынысы бойынша Томсон бұл кіші бөлшекті электрон деп атап,е таңбасымен белгіледі.Қазіргі дәл мәлімет бойынша нейтрон зарядының шамасы е=4.80286*10-10 эл.ст.бір=1/60206*10-19 кулон(к).Магниттән электр өрісінде бұрылған электрон ағынының траеекториясының қисықтығына қарап зарядының массасына қатынасын анықтауға болады.e/m=5.273*1017(дәреже).Бұдан электр зарядын біле отырып оның тыныш күйдегі массасын есептеп шығарса m=9.109*10-28
1* 3. Сутек атомы құрылысының Бор теориясын түсіндіріңіз
Дания физигі Н.Бор 1913 жылы сутек атомының спектрінің түзілу сырын түсіндірумен бірге электрондық құрылысының негізін салды. Жарықтың кванттық теориясы негізінде Бор келесідей қорытынды жасады: атомдағы электрондар энергиясы үздіксіз өзгермейді, секіріс арқылы яғни дискретті өзгереді. Сондықтан атомдағы электрондардың кез келген энергетикалық жағдайлары емес, олардың тек бекітілген жағдайлары болады. Басқаша айтқанда, атомдағы электрондардың энергетикалық жағдайлары квантталған. Бір бекітілген жағдайдан екішісіне өту кезінде электромагниттік сәуле бөлінеді не сіңіріледі. Бор теориясының негізгі қағидаларын постулаттар (постулат – дәлелсіз қабылданатын тұжырымдар) түрінде берді:1. Электрон ядроны айналу кезінде тек белгілі орбиталар бойымен қозғалады. Бұл орбиталар стационарлы деп аталады. 2.Стационарлы орбиталармен қозғалғанда электрон электромагниттік сәулелену бөлмейді. 3.Электрон бір стационар орбитадан екіншісіне ауысқанда сәулелену байқалады. Сол кезде электромагниттік сәуле бөлінеді немесе сіңіріледі, оның энергиясы атомның соңғы және бастапқы күйінің айырмасына тең.Соңғы тұжырымдама біршама түсініктемені қажет етеді. Ядро айнала қозғалатын электрон энергиясы орбита ядросына тәуелді. Ядроға жақын орналасқан орбитада электрон энергиясы аз болады. Электронды ядродан алыс орбитаға ауыстыру үшін, электронның оң зарядталған ядромен тартылыс күшін үзу керек, бұл энергияның жұмсалуын қажет етеді. Аталған үрдісте жарық кванты сіңіріледі. Осыған сәйкес айтылған жағдайда атом энергиясы артады да, қозған күйге ауысады. Электронның кері бағытқа ауысуы (алыс орбитадан жақын орбитаға) атом энергиясының азаюына әкеледі, энергия электромагниттік сәуле кванты түрінде бөлінеді. Электронның ауысу энергиясы келесі теңдеумен өрнектеледі: Е = Еб – Ес , мұндағы Еб – бастапқы (ядродан алыс орналасқан) орбитадағы электрон энергиясы, Ес – соңғы (ядроға жақын орналасқан) орбитадағы электрон энергиясы. Планк теңдеуін ескерсек Е=hv, онда hv=Еб-Ес, бұдан v=(Еб –Ес)/h.Соңғы теңдеу бойынша сәулелердің жиіліктерін немесе толқын ұзындықтарын есептеуге болады, яғни атом спектрін есептеп табуға мүмкіндік бар. Бор теориясы атом спектрлерінің физикалық табиғатын атомдағы электрондардың бір стационарлы орбитадан екіншісіне ауысу нәтижесі ретінде түсіндірді.Электронның энергиясы артық деңгейге ауысуы атом энергияны сіңірген кезде жүзеге асырылады. Электрон энергиясы азайғанда энергия бөлінеді. Энергияның өзгерісі тең болады: ΔЕ1=Е2–Е1=hv1 және ΔЕ2=Е3–Е1=hv2.. ΔΕ2>ΔΕ болғандықтан, онда ν2>ν1. Сәуленің жиілігі электронның ауысуы кезінде бөлінген немесе сіңірілген энергия мәнінен байланысты. Сонымен Бордың атом құрылысы моделі сызықтық спектрлердің пайда болуын және сутегі атомдары бөліну спектрлерінің көріну аймағындағы серияларды түсіндірді.Алайда теорияда ішкі қарама-қайшылықтар болды: механика және электродинамика заңдарына сәйкес келмейтін постулаттармен қатар, Бор теориясында бұл заңдар атомдағы электронға әсер етуші күштерді есептеу үшін қолданылды. Постулатпен байланысты сұрақтар пайда болды; мысалы, электрон бір орбитадан екіншісіне ауысқанда қайда болады? Салыстырмалық теориясына сәйкес, бірде бір физикалық үрдіс жарық жылдамдығынан артық жылдамдықпен жайыла алмайды. Сондықтан электронның жаңа орбитаға ауысу үрдісі қас-қағымда жүре алмайды, ол белгілі бір уақытта жүзеге асады. Осы уақыт ішінде электрон бастапқы және соңғы орбиталардың аралығында болады. Алайда теория осындай “аралық” жағдайларды рұқсат етпейді.Сонымен, Бор теориясына басқа ғалымдар толықтырулар енгізгенімен, электронның атомда тек шеңбер тәріздес орбита бойымен ғана емес, кеңістікте әртүрлі орналасқан эллипс тәріздес орбиталармен қозғалатын мүмкіндігі қарастырылды. Аталған теория көп электронды атомдардағы, тіпті сутегі атомындағы спектрлік сипаттамаларды түсіндіре алмады. Мысалы, сутегі атомы спектріндегі сызықтардың әртүрлі интенсивтігінің мәні түсініксіз болды, атом спектрлері жеке сызықтарының бірнеше бөліктерге ыдырауы түсіндірілмеді.Көпэлектронды атомдардың мөлшерлік есептеулері өте күрделі болды. Теория сутегі атомының магниттік қасиетін қате сипаттап, молекуладағы химиялық байланыстың түзілуін түсіндірмеді. Осының бәріне қарамастан Бор теориясы атом құрылысы туралы түсініктердің дамуында маңызды кезең болды. Планк- Энштейн гипотезасымен қатар теория үлкен денелерге –макроэлемент объектілеріне қолданылатын табиғат заңдарын микроэлементтерге – атомдар, электрондар, фотондар – қолдануға болмайтындығын көрсетті
1*4. Кванттық механиканың негізгі ұстанымдары: зат табиғатының екіжақтылығын айқындаңыз. Де Бройль гипотезасы және Гейзенберг жұмыстарына сүйеніп электрон бұлты туралы түсіндіріңіз
Квантты механика теориясы 1924-1926 жылдары де Бройль Шредингерің,Гейзенбергтің және Дирактың қатысуымен құрылды.Квантты механика-қозғалыстың заңдылықтарын,микробөлшектердің әрекеттесуін,өте кіші массасы бар бөлшектерді(элементарьлы бөлшектер,атомдардың молкулалары) зерттейтін физикалық теория.Квантты механиканың негізінде микробөлшектердің корпускулярлы –толқындық көзқарасы және Гейзенбергтің анықталмағыштық белгісіздік принципі жатыр.
Луи де Бройль 1924 жылы жаңа идея ұсынды:Егер белгілі жағдайда сәуле энергиясы жай бөлшектерге тән қасиет көрсетсе,онда ол толқындық қасиет көрсетуі мүмкін ғой.Кез келген микробөлшектерге екі жақты қасиет тән-олар бір мезгілде толқынды және бөлшектік қасиет көрсетеді, демек ядроның айналасындағы орбитадағы электрон белгілі ұзындығы бар толқынмен байланысады.Де Бройль электронға немесе кез келген басқа бөлшекке тән толқын ұзындығы олардың массасы мен жылдамдығына тәуелді деген болжам айтты.(лямбда=h/m*жылдамдық) Бөлшекік материяның толқындық қасиетін сипаттау үшін, Де Бройль материялдық толқын деген терминді енгізді.Де Бройльдің болжамынан массасы m,жылдамдығы кез келген денеге материялды толқын сәйкес келеді деген тұжырым шығарды.Дегенмен теңдеуден көрініп тұрғандай әдеттегі өлшемді денемен байланысқан толқын ұзындығы өлшеуге де келмейтін өте аз шама болады.Ал массасы өте аз электрондар үшін іс басқаша.Есептеулердің көрсетуі бойынша энергиясы шамамен 1.6*10-17 Дж болатын электрондар үшін Бройльдің толқын ұзындығы 1.2 Е болады .Бұл өлшем шамамен кристалдық тор параметрлеріне сәйкес келеді.Гейзенбергтің анықталмағыштық принципі.Егер микро әлем құбылысын толқындық дүние корпускулалық теорияның біреуімен сипаттаса онда нәтиже анықталмағыштық қасиетімен өрнектеледі.Микробөлшектердің толқындық қасиеттерінің артық болуынан әрбір берілген уақыт шамасындағы олардың кеңістіктегі орнын белгілеу және олардың қозғалыс жылдамдығын кез келген дәлдікпен анықтау мүмкін емес.Неміс физигі В.Гейзенберг бір мезгілде бөлшектің орны мен импульсін анықтауға болатын дәлдіктің шектеулік принципі болады деген қорытындыға келген.Гейзенберг тұжырымдаған шектеулік анықталмағыштық принципі деп аталады және анықталмағыштық қатынаспен байланысқан:∆х*∆p= const=h/2∏. Бұл принцип атомдағы электронның бір мезгілде импульсі мен кеңістіктегі орнын дәл анықтаудың мүмкін еместігін көрсетеді.Сондықтан электрон ядроны әрқашан тұраққты радиуспен белгілі дөңгелек орбитамен айналады деуге бомайды.Электрон әрбір берілген уақыт шамасында өзінің толқындық қасиеттеріне сәйкес ядро айналасының белгілі бір аумағына тармайды.Мұндай кез келген нүктеде электрон тығыздығы біркелкі ықтимадықпен тараған көлем шартты түрде орбиталь деп аталады.Берілген орбитальдағғы электронның күйі стационарлық және Гейзенбергтің анықталмағыштық принципімен өрнектеледі:∆х=∆(m*жылдамдық)=const
Осы теңдеуден мынадай тұжырым шығады:х неғұрлым кіші болса соғұрлым ядроға жақын болады,үлкен жылдамдықпен қозғалады,керісінше,электрон ядродан қашықтай берсе ,ядроға құлап кетпес үшін қозғалыс жылдамдығы азаяды.Де Бройльдің болжамы және Гейзенбергтің анықталмағыштық принципі атом құрылысы теориясы дамуына жаңа қарқын берді.Де Бройль гипотезасы және Гейзенбергтің анықталмағыштық принципі атом құрылысы теориясын түсіндіруге кең түрде қолдануға болатын жаңа бастамалар болып табылады.Бұл теория электронның толқындық қасиеттеріне негізделіп олардың импульсі мен бір сәттік орнын аныөқтауға болатын ешқандай ұмтылыс жасалынбайды.Электронның кеңістіктің нақты бір жерінде болу ықтималдылығы оның толқындық қысиеттерімен байланысты және таралудың толқындық заңдарына бағынады,осыдан,электронның ядро маңындағы кеңістіктің нақты бір жерінде боу ықтималдылығын толқындық процесстердің теңдеулерін қолдану арқылы сипаттауға болады.
Квантты механика қатал математикалық дәлдікпен электронның ядро маңындағы кеңістікте болу ықтималдылығын анықтауга мүмкіндік береді.Атомдағы электрондардың күйі ықтималдылық функциясымен бағаланады .Бұл функцияны толқындық немесе пси-функция деп атайды.Бұл функцияның математикалық мәні х,у,z координаттарына уақытқы тәуелді .Оны мынадай түрде жазуға болады ....(х,у,z…)
1* 5. Квант сандары, олардың мәнін анықтаңыз
Атомдағы электронның күйін толық көрсету үшін үш бірдей бүтін сан қажет. Олардың бәрі квант сандары деп аталып n,l,m деп белгіленеді. Бұл квант сандары электрон қозғалысын физикалық тұрғыдан сипаттайды, әрі электрон бұлтының геометриялық ерекшеліктерін бейнелейді.
Бас квант саны электронның мүмкін болатын ядродан ара қашықтығын, яғни электрон бұлтының орташа көлемін және электронның энергиясын анықтайды. Белгілі бір квант санының мәніне сәйкес келетін электрондардың саны атомда электрондық деңгей түзеді, ал электрондар орналасқан деңгейді электрондық қабат дейді. Бас квант санының мәндері бірден басталатын бүтін сандармен, ал бұларға сәйкес келетін электрондық деңгейлер немесе қабаттар латынша бас әріптермен көрсетіледі.
Бас квнат саны n 1, 2, 3, 4, 5, 6, 7…
Энергетикалық деңгей K, L, M, N, O, P, Q…
немесе қабат.
Орбиталь квант саны l бас квант санына тәуелді болады және ол электрондардың пішіндерін анықтайды.
Бас квант саны n=1 сәйкес келетін бірінші деңгейде 1s деңгейшесі болады, оның электроны ядроны айналғанда 1=0 сәйкес пішіні шар тәрізді электрон бұлтын немесе орбиталь түзеді. .. Ал n=2 болғанда орбитальдар 2s2p болып келеді.
Магнит квант саны m орбитальдардың кеңістікте орналасуын сипаттайды, анығы, бір пішіндес орбитальдардың жалпы санын және олардың кеңістіктегі орналасу ретін көрсетеді. Квант-механикалық ұстанымдар бойынша магнит квант саны –l…0…+l аралығындағы бүтін сндардың мәніне ие болады. Магнит квант саны- бір пішіндес орбитальдардың жалпы санын белгілеп беретіндіктен квант қабатында пішіні ұқсас 1s, 3p, 5d, және 7f орбитальдар болады.Шыныда да s- орбиталь сфера тәрізді болса, p- орбитальдан әр осьтің боймен бір-біріне перпендикуляр болып келетін үш pₓpᵧpz оритальдары түзіледі.
Орбиталь квант саны 1=0 сәйкес келетін s деңгейшеде шар пішіндес бір бағытта орналасатын орналасатын бір орбиталь болады. Егер 1=1 сәйкес келетін p-деңгейшеде пішіндері бірдей гантель тәрізді үш орбиталь болады, олар үш күйде, яғни кеңістікте үш түрлі бағытта орналасады. 1=2 магнит квант санының бес мәні сәйкес келеді, d-деңгейшеде әр түрлі бағытта орналасқан пішіндері күлтелі орбиталь болады.
Спин квант саны s – электрон бұлттарының мөлшерін, пішінін, әр кеңестікте орналасу \ын белгілейтін үш квант санымен қоса электрон сапасывн сипаттайтын квант саны. Электронның бұл қасиеті біз көріп жүрген макраденелер дүниесінде тән емес әрі оғансалыстырып ұқсатып айтуға да келмейді.Соған қарамастан әдетте оны қарапайымдап өз өсін айналып иіріліп тұрған” ұршыққа” ұқсатады.Электронда өз өсінен қарама қарсы екі бағытта “ұршыққа” зырлай алады деп есептелініп оның мәндерін –1/2+1/2 деп белгілейді.Ендігі жерде атомдағы электронды толығымен сипаттау үшін 4 бірдей квант санын пайдаланады.Электронды қарапайым бөлшек деп қарап,оның кеңістіктегі қозғалысын 3 кординатамен n,l,m белгілесе,өз өсінен айналуын 4 ші координата s анықтайды.
1* 6. Атомдардың периодты түрде өзгеретін қасиеттері.
Химия тарихындағы ерекше маңызды ірі табыс Д.И.Менделеев ашқан периодтық заң болды.Осы заң негізінде элементтердің периодтық жүйесі жасалды. Периодтық заң - жаратылыстың негізгі заңдарының бірі, оның ашылуы химияда жаңа дәуір туғызды. Д.И.Менделеев периодтық кестені XIX ғ. 60 жж ашқан еді. Осы кезде белгілі болған элементтер саны 28 болса, Д.И.Менделеевтің заманыңда 63, ғасырдың аяғында 83 болды. Осы кезде 113 элемент белгілі. Период ішіндегі элементтердің қасиеттері күшті сілтілік металдан басталып, бірте-бірте металдық қасиеті кеміп, амфотерлі қасиеті артып, ақыры бейметалдардың ең күштілері галогендерге келіп, инертті газбен бітеді. Горизонталь бағыт,период бойымен солдан оңға қарай.Бұл бағытта атомдық салмақ, ядро заряды, электрон саны біртіндеп өседі, осы ған сай металдық қасиет әлсіреп, бейметалдық қасиет күшейеді. Мундай өзгеру алғашқы периодтарда айқынырақ, кейінгі периодтарда баяуырақ болады. Вертикаль бағыт, негізгі және қосымша топшалар бойымен жоғарыдан төмен қарай. Бұл бағытта атомдық салмақ, ядро заряды, электрон саны сылыстырмалы түрде өзгереді, бірақ электрондық кұрылымының ұқсастығына байланысты және квантты қабаттары Атомның электртерістілігі – химиялық байланыстарда басқа атомдардың валенттілік электрондарын
санының артуына сай элементтердің қасиеті өте баяу өзгереді, айырмашылықтан ұқсастық көп. Гортизонталь жәнне вертикаль бағыттағы өзгерушілікті ұластыра қарасақ, кестенің сол жақ төменгі бұрышында негізгі топшаларда нағыз күшті металдар, оң жақ бұрышындағы негізгі топшаларды нағыз бейметалдар орналасқан Диоганаль бағыт кестенің сол жақ төменгі бұрышында негізгі топшаларда нағыз күшті металдар(Rb,Cs,Fr,Ba,Ra), оң жақ бұрышындағы негізгі топшалар нағыз бейметалдар(N.F.O.P.Cl.Br.S) орналасқан
Атомдардың периодты түрде өзгеретін қасиеттері: 1.атом радиусы 2- электртерістілік 3- қасиеттері
4- иондану энергиясы 5- электрон тартқыщтық 6- тотығу дәрежесі
7- валенттілік 8- атомдық массасы
1* 7 Иондану энергиясы, электрон тартқыштық
энергиясы, электртерістік ұғымдарын түсіндіріңіз
Иондану энергиясы қалыпты күйдегі атомның электронын үзіп алу үшін жұмсалатын энергия Эо-е=Э+.Иондану энергиясы иондану әлеуеті деп те аталады.Оның щамасын көбіне 1 моль атомға шағып береді,өйткені 1 атом үшін иондану энергиясының мәні тым аз.Иондану энергиясын I деп белгілеп,оның мөлшерін электронвольт арқылы есептейді.Бірірнші электронға қарағанда екінші үшінші электрондарды үзіп алу қиындай береді,сондықтан I1<I2<I3…Атомда көп электрондардың болуы оның үзілуге тиісті электронына әртүрлі әсер етеді.Ядро зарядын көлегейлеу(экрандау)-қарастырылып отырған электронмен ядроның өзара тартылуын кемітетін электронқабаттарының болуы.Неғұрлым ядро мен үзілуге тиісті электронның арасында электрон қабаттары көп болса,соғұрлым көлегейлеу эффекті күшті болады.Квант механикалық көзқарас бойынша электрондар атомның кез келген нүктесінде болуы ықтимал.Сондықтан тіпті сыртқы деңгейдегі электрондар ішкерідегі элекрон қабатына өтіп,бір мезгілде ядроға жуық маңда да болуы мүмкін.Мұны электронның ядроға өтуі деп атайды.Бұл құбылыстың нәтижесінде электронның ядромен байланысы беріктене түседі.Өту эффектіне ядроға жуық маңдағы электрон қатпарларының тығыздығы үлкен әсер етеді,атап айтқанда n бірдей десек,l-дің мәні неғұрлым кішірейген сайын соғұрлым ядроға жуық маңдағы электрон бұлты тығызырақ бола түседі.Сондықтан да s-электрондардың өтімділігі мықты болып табылады,олардың көлегейлеу қасиеті де күшті.Онан кейінгі өтімдірегі p-электрондар,олардың көлегейлеуі орташа.Өтімділігі де,көлегейлеуі де нашар d-электрондар болып саналады. Атомдардың басқа да көптеген қасиеттері сияқты иондану энергиясы да периоды түрде өзгеріп отырады.Бірінші топ элементтерінің иондану энергиясы өте аз,себебі сыртқы қабатағы жалғыз электронның ішкері жатқан енжар элементтерге тән қауызы бар қабаттардың әсерінен ядродан күшті көлегейлеу болып саналады.Ал Li-ден Cs-ге қарай атом мөлшерінің артуына сай жалғыз электронның ядромен байланысы әлсіреп I кеми түседі.Екінші топтағы элементтердің иондану энергиясы Li-ден Na-ға қарай ауысқанда иондану энергиясы арта түседі.Бұл жағдай электрон қабатының бірдей болып,ядро зарядының біртіндеп өсуімен түсіндіреді.Бірақ I мәнінің өсуі біркелкі емес.Be мен N кейінгі B мен O-нің мәндері біршама кішірейеді.Мұндай заңдылық ол атомдардың электрондық конфигурациясының ерекшеліктерінен туады.Бериллиймен салыстырғанда бордың иондану энергиясы аз.Хунд ережесі бойынша азот атомының соңғы электрон қабатының құрылымының р орбиталында бір-бірден электрон бар,жоғары симметриялы.Ал оттектің соңғы электроны р орбиталдардың бірін жұптайды.Бір орбиталдағы қос электронның бірін-бірі тебуі күшті болғандықтан электронды үзіп алу оңайға түседі.сондықтан азотқа қарағанда оттегінің иондану энергиясы кішілеу.Мұндай заңдылық басқа периодтың элементтерінде де байқалады. Оларда да иондану энергиясының ең кіші мәні сілтілік металдарға,ең үлкені енжар элементтерге сай келеді.Аралық декадалардағы элементтердің атомдардың иондану энергиясы онша көп өзгермейді,себебі оардағы с электрондар ядрога қарай өтіп кетеді де көлегейленіп тұрады.Ал период үлкейген сайын көлегейлеу арта түседі.Радиустың баяу артуы,лантанойдтық сығылудың нәтижесінде өзара өте жуық болуы,В топтарында жоғарыдан төмен қарай иондану энергиясының артуына әкеліп соғады.Бұған көлегейлеудің әсері де сай келет.Атомдардың иондану энергиясының мәні тек химиялық байланыстың беріктігіне әсер етумен шектелмей элементтердің тотықсыздандырғыш қасиеті де тікелей осы шамамен анықталады.Неғұрлым электрон атомнан оңай үзіліп,иондану энергиясының шамасы аз болса соғұрлым берілген элемент күшті тотықсыздандырғыш болады.Электронтартқыштық.Химиялық байланыс түзетін электрондарды атом маңайында ядро өрісі ұстап тұрады.Ядро өрісі атомға жақын келгенде жеке электрондар да өзіне тартып ала алады.Бірақ оларды атом айналасындағы өз электрондары кейін тебеді.Осыған байланысты көптеген элементтердің атомдары үшін сырттан келген электронды ядроның тарту күші оны электро бұлтының кейін тебу күшінен артық екені анықталды.Электрон қосып алған атом теріс зарядты ионға айналады,осы кезде бөлінген энергия Е оның электронтартқыштығын сипаттайды: Э+е=Э-.Электронтартқыштықтың мәні әлі де көп элементтер үшін дәл анықталмаған.Бірақ белгілі мәндерден оныңпериод және топ бойынша атомдардың электрондық құрылымына сай белгілі бір заңдылықпен өзгерет.Электронтартқыштығы ең көп элементтер 8 топтағы р элементтер.Ал ең азы 2 және 8 топ элементтеріне тән.Сондықтан бұлардың атомдарының электрон қосып алуға бейімділігі жоқ.Бейметал топтарында электрон тартқыштық қасиет төменнен жоғары қарай өседі.Бұл қасиет берілген элементтің атомының тотықтырғыштық қабілетін сипаттайды.Бірақ газ күйіндегі бейметалдардың молекулусы 2 атомнан тұратын болғандықтан диссоциациялану процесі тотықтырғыштық қабілетке үлкен әсер етеді.Электртерістік әрбір атомның элетрон беру не қосып алу қабілетін сипаттайтын иондану энергиясы мен электронтартқыштықтың қосындысының жартысына тең шама: ЭТ= -эв г-атом.Электрон электерістігі төмен элементке қарай ауысады.Сондықтан реакция кезінде атомның электрон қосып алу не беруі осы ЭТ иәндеріне байланысты.Галогендердің электронын үзіп алу үшін өте көп энергия жұмсалуга тиісті әрі олар өздеріне электрон қосып алғанда бөліп шығаратын энергия шамасы да үлкен болады.Сондықтан галогендердің электртерістігі жоғары.Олар электрон қосып алып тотықтырғыш қабілет көрсететіндіктен ЭТ-ң үлкен мәні басқа да осы тәрізді бейметалдарға тән. Ал сілтілік металдарда керісінше иондану энергиясы тым аз,ал электронтартқыштығы жоққа тән,сондықтан ЭТ болымсыз болады.ЭТ-ң өте аз болуы элементтің тотықсыздандырғыш қабілетін,яғни электрон бергіштігін сипаттайды.Период бойынша алғандаатомның құрылысы күрделенген сайын ЭТ мәні өседі.ЭТ ең азы 1 топтагы элементтер,ең үлкені 7 топтағы р элементтер.Бір топ ішіндегі элементтердің ЭТ мәндері төменнен жоғары қарай өседі.ЭТ-ті абсолют көрсеткіш деп санамады,өйткені оның шамасы берілген атом қандай атомдардың қоршауында тұрғандығына байланысты
1* 8. Коваленттік байланыс, коваленттік байланыстың
қанығуы, бағытталуы, полюстенуін түсіндіріңіз
Ортақ электрон жұбын түзу арқылы пайда болатын химиялық байланыс. Коваленттік байланыс түзілуінің үрдісін көбінесе схема түрінде береді, ондағы электрондар нүктемен белгіленген. Егер атомдардың арасында бір коваленттік байланыс болса (жалғыз ортақ электрондық жұп), онда ол дара, егер екеу болса, қос (екі ортақ электрондық жұп), үштік (үш ортақ электрондық жұп) деп аталады. H2 затын құратын ковалентті байланыс - екі сутегі атомдарында ортақ екі электроны бар.Коваленттік байланысты екі түрге бөледі: полярлы және полярлы емес. Полярлы емес коваленттік байланыстың электрон бұлттары ортақ электрон жұбымен құрылған, яғни электрондық байланыс бұлттары екі атом ядроларына қатысты кеңістікте симметриялы орналасқан. Полярлы емес коваленттік байланыс бейметалдарда пайда болады және металл жұптарында, химиялық элементтің бір атомынан: Н2, О2, О3, N2, S2, Li2, Na2, C, Si және басқалары құрылса, полярлы коваленттік байланыстың электрон бұлттары электртерістілігі жоғары атомға қарай ығысқан (НСl, H2O, H2S, NH3 және т.б). өзіне тарту қабілеті. Электрондық бұлттардың формасы әртүрлі болғандықтан, олардың тұйықталуы әртүрлі тәсілдермен жүзеге асуы мүмкін. Тұйықталу әдісі мен симметриясына байланысты түзілген бұлттар σ − , π − және δ-байланыстары болып ажыратылады. σ-байланыс (сигма-байланыс) – бұл байланыс бұлттардың тұйықталуынан атомдардың байланыс сызықтарының маңайында іске асады. Симметрия шарттары негізінде келесідей қорытынды жасуға болады: s-орбиталь электрондары σ-байланыс түзілуінде, p-электрондар σ және π-байланыстар, ал d-электрондар σ, π, δ-байланыстары түзілуіне қатысады. Бұлттар қабаттасуы σ-байланыс кезінде максимал болады. Коваленттік байланыс тек қана қарама-қарсы спиндері бар электрон бұлттарының қабаттасуы нәтижесінде түзілмейді. Коваленттік байланыс сонымен қатар донорлы-акцепторлы механизммен түзілуі мүмкін. Бұл жағдайда химиялық байланыс бір атомның екі электрон бұлттары мен басқа атомның бос орбиталі нәтижесінде түзіледі (NH4+).К.б\ң бағытталуы.К.б\ты түзетін электрон бұлттарының белгілі бір бағыты болады,осының салдарынан молекулалар кеңістікте белгілі құрылысқа иеб\ды. Бұл мәселені ВБ теориясы қарастырады. Бұл теория\ң х\қ байланыс атомдарының жалқы электронды орбитальдары\ң бүркесуі нәтижесінде түзіледі. Олардың өздерінің пішіндеріне сай бағыттары б\ды.Ковалентті байланыстың полюстігі байланыстырушы электрон бұлтының молекуладағы орналасу ретіне қарай коваленттік байланыс полюсті жане полюссіз деп 2 ге бөлінеді.Фтор молекуласындағы байланыс фтор атомдарының жалқы электронды 2р z орбитальдарының бүркесуі арқылы жасалады.Бұл мысалда электрон бұлттарының бүркесу бөлігі дәл ядролар ортасында болады.Екі фтор атомының да электр терістіктері бірдей,сондықтан олар байланыстырушы электрон бұлтына бірдей күшпен әсер етеді.Байланысиырушы электрон бұлты ешқандай атомға қарай ығыспаған.Екі атомның ешқайсысында да артық заряд жоқ.Мұндай байланыс полюссіз ковалентті байланыс деп аталады.
Егер байланыстырушы электрон бұлты қосылысқан екі атомның біріне қарай ығысқан болса ондай байланысты полюсті ковалентті байланыс деп атайды.
1* 9. Гибридтену теориясы бойынша молекулалардың кеңістіктегі конфигурациясын айқындаңыз.
Гибридтеліну дегеніміз әр түрлі атомдық орбитальдардың арласып,энергиялық ждағынан тиімді біркелкі АО-ң түзілуі. Мұндай гибридті орбиталдар басқа атомдармен хим-қ байланыс түзуге өте бейім.Гибридті орбиталдардың саны гибридтенуге қатынасқан орбиталдардың санына тең.Гибридті орбиталдар электрон бұлттарының пішіні мен энергиясы жағынан бірдей болып келеді.Олар атомдық орбиталдарға қарағанда хим-қ байланыс түзу сызықтың бойында жатады,сондықтан электрон бұлттарының бүркесуіне қолайлы жағдай туады.АО гибредтену түрлері көп. Олардың ең маңыздыларын қарастырайық: .sp-гибридтену.Периоодтық жүйедегі екінші топша элеиенттерінің галогендерімен қосылыстарында sp-гибридтену түрі іске асды Берилийдің сутекпен және галогендермен қосылыстарын қарастырайық.Берилий негізгі жағдайда жұптаспаған электрондары жоқ.Бірақ оның барлық қосылыстарының құрылысы түзу сызықты болып келеді.Осындай құрылысты ВБ теориясыментүсіндіру үшін,Ве электрондарының қозған жағдайын қарастырады,осының нәтижесінде екі жұптаспаған электрондар пайда болады.Ве-ң әртүрлі екі орбиталі бірігіп жаңа жәнне ұқсас екі гибридті электрондар пайда болады.sp-гибридтену.Бір s-орбитальдарымен және екі р-орбиталдарымен қосылып,жаңа үш sp-гибридтелу дейді.Олардың валенттік бұрыштары
120ºжәне бір жазықтықта орналасқан ең қолайлы жағдай орналасады.Осындай гибридтену периодтық жүйедегі үшінші топша элементтерінің молекулаларына тән. Әр түрлі гибридті орбитальдардың кеңістіктегі құрылысы да әр түрлі болады:сызықты,үшбұрышты,тетраэдрлі.Валенттік жұп электрондардың тебелісу теориясы толық гибридтелу бойынша байланысқа қатыспайтын электрон жұптарының тебісу әсері байланыстырушы жұп электрондарға қарағанда көбірек.Сонымен ВБ әдісін қолданып қорытынды жасауға болады :
1.ВБ әдісі көптеген молекулалардың геометриялық құрылысын түсіндіруге мүмкіндік береді.
2.Гибридті орбиталдардың кеңістікте орналасуы өзара электрон бұлттарының приципіне бағынады.
3.Гибридтеліну коволентті баланыстың ерекше қасиеті,байланыстың бағытталынуын сипаттайды.Ковалентті байланыстың иондық байланыстан басты айырмашылығы,иондық байланысқа бағытталу қасиеті тән емес.
Көміртек атомының 2s және 2р –орбитальдары байланыс түзуге бастапқы таза күйінде қатыспайды,байланыс түзбестен бұрын олар өзара арласып ,пішіндері және энергиялары бірдей 4 гибридті орбитальдарға айналады.Гибридтенуге 1s және 3р орбитальдар қаттысатындықтан түзілген орбитальдар sp3 гибридті орбитальдар деп аталады.sp3 гибридті 4 орбитальдің төртеуінің де пішіндері бірдей және олар тетраедрдің төбелеріне қарай бағытталған ,араларындағы бұрыш 109 градус .Сонымен шар тәрізді s орбиталі гантель тәрізді 3 р орбиталімен араласқанда пішіндері бастапқы s және p- орбитальдарына ұқсамайтын жаңа пішінді sp3 гтбридті орбитальдар түзіледі.бастапқы 2s және 2p-орбитальдарының энергиялары әр түлі, яғни 2p- орбитальдардың энергиясы 2s- орбитальдікінен жоғары болса, гибридтенуден кейін олардың энергиялары теңеседі.
1*10. Иондық байланыс. Иондық байланыстың бағыталмағыштығы мен қанықпауын түсіндіріңіз
Иондық байланыс түзілуі кез келген атомдарға тән емес,тек ерекше қасиет көрсеткен атомдардың арасында пайда болады. Байланысқа түсетін атом электрон беріп,оң зарядты ионға катионға айналу керек. Атом электрон қосып алып теріс зарядты ионға аниондарға айналу қажет. «а» типті атомдар оң зарядты иондарға жатады,олардың заряды атомның қанша электрон бергеніне байланысты. «б» типтес атомдар электртерістікті деп айтады заряды түзілген иондардың теріс зарядына тең. Иондық байланыс теориясын құрған Коссель болатын. Мысал ретінде екі бос атомдарды алайық біреуі –цезий атомы, екіншісі-газ күйінде хлор атомы. Жоғарыда айтылғандай осы екі атомдар, біреуі электрон беріп, екіншісі электрон қабылдап бос иондарға айналады. Электрон ауысу процесіне энергияның өзгеруі де сай болуы қажет. Цезий атомы мен хлор атомының арасында электрон ауысуы екі энергитикалық процестен тұрады.Біріншісі-цезий атомы иондану үшін энергия жұмсалады. ( цезийдің АО бір электронды жұлып алуға керекті энергия).Мұндай энергияны иондану энергиясы деп аталады. Сr(г) Сr(г)+е ИЭ=89,4 ккал\г-атом Екіншісі-сол электрон хлор атомының 3p AO келіп осы орбитальдарға жалқы электронмен жұпрасады бұл процесте энергия бөлінеді оны электрон тартқыштық энергиясы деп аталады. CI()+e → CI() →ЭТар=86,5ккал\г-атом.
Периодық жүйедегі элементтердің иондар түзу қабілеттілігі атомдардың электрондық құрлысына тікелей байланысты. Элементтердің ион түзу қабілеттігін атомдардың иондану энергиясымен және электрон терістікпен бағалауға болады.Сілтілік және сілтілік жер металдардың иондану энергиясы төмен болғандықтан олар оң зарядталған катиондарды тез түзеді.Ал басқа злементтер химиялық реакция нәтижесінде катиондар оңай алынбайды себебі катионның түзілуі атомдарды иондарға жұмсалатын энергияның ұтымымен байланысты.Электрон тартқыштың қабілеті жоғары болғасын 7-ші топтың р-элементтері(галогендер) аниондарды жеңіл түзеді. Жалпы қарапайым иондардан тұратын қосылыстар негізінде сілтілік және сілтілік жер металдар мен галогендер әрекеттескенде пайда болады.Электр заряды бар бөлшектер бір-біріне тартылып не болмаса тебіседі.Тартылуы не тебілісу күштері бөлшектердің стереохимия құрлысы мен құрамына байланысты егер иондарды зарядталған шар тәрізді деп алса, онда иондардың электр күштері қоршаған кеңістікте барлық жағына біркелкі бағытталады.
Кез келген ион өзіне қарай бағытталған қарама-қарсы зарядталған ионды тарта алады. Басқаша айтқанда иондық байланыс коваленттіге қарағанда бағыттылықсыз байланыс деп атайды.Қарама-қарсы зарядталған иондар бір-бірімен әрекетескенде олардың электрөрістері толық қанықпайды.
Иондар басқа бағыттардан өзіне қарай қарсы зарядталған иондарды тарта алады.Иондық байланыс ковалентті байланысқа қарағанда қанықпаған байланыс. Иондық байланысты былай сипатауға болады.Әрекеттесуші атомдардың ядро аралығында электрон бұлтының тығыздығы болмағандықтан атомдардың электрон бұлттары бүркеспейді. Иондық байланыстың бағыттылығы жоқ байланыс барлық бағыттарда бірдей таралған.Иондық байланыс қанықпаған байланыс.Орталық атомды кеңістікте қоршап тұрған бөлшектердің саны (координациялық сан) бөлшектердің көлеміне байланысты .
1*11.Молекулааралық әрекеттесу. Ван-дер-Ваальс
күштерінің табиғатын түсіндіріңіз
Молекулааралық өзара әсер – электрлік қасиеті жағынан бейтарап молекулалар немесе атомдар арасындағы өзара әсер. Бұл әсер молекулааралық қашықтыққа (r) тәуелді және өзара әсердің потенциалдық энергиясы U(r) арқылы өрнектеледі. Заттардың көптеген қасиеттері мен агрегаттық күйі осы U(r)-дің шамасы арқылы анықталады Химиялық заттар үш агрегаттық күйде болады: газ,сұйық,қатты.Тіпті,инертті газдар атомдарының валенттік АО толық электрондармен толсада,өте төмен температурада әуелі сұйықталып,әрі қарай қатты затқа айналады. Инертті газдардың ковалентті байланыс түзе алмайтындығы жақсы белгілі. Инертті газдардың әуелі сұйықталып ,сонан кейін кристаллға айналуы,олардың атомдарының арасында тартылыс күштері бар екендігін дәлелдейді. Газдар,сұйық,қатты заттардың молекула арасындағы тартылыс күштерді молекула арасындағы күштердеп атайды.Молекулалар арасындағы тартылыс күштері бар екендігін бірінші рет 1873ж Ван-дер-Ваальс түсіндірген.Идеал газдарға мына теңдеу PV=nRT орындалуы керек.Бірақ іс жүзінде реальды газдарға мұндай заңдылық көп жағдайда орындала қоймайды.Ван-дер –Ваальс осы заңдылықтың орындалмайтын себебін газ молекулаларының арасында өздеріне тән тартылыс күштері арқылы түсіндіреді. Оның болжамы бойынша бір-біріне жақын орналасқан молекулалар арасында тебіліс күштері әсер етеді де, ал молекулааралық қашықтық (r) артқанда бұл күштер тартылыс күштерімен алмасады. Осы болжамдарды пайдалана отырып ол нақты газдардың күй теңдеуін [(р + а/V2)(V-b) = RT ] қорытып шығарды. Молекулааралық өзара әсердің табиғаты электрлік және ол тартылыс күштері (ориентациялық, индукциялық, дисперсиялық) мен тебіліс күштерінен тұрады. Ориентациялық күштер полюсті молекулалар арасында әсер етеді; индукциялық (поляризациялық) күштер полюсті және полюссіз молекулалардың және сонымен қатар полюсті молекулалардың да арасында әсер етеді. Дисперсиялық молекулааралық өзара әсер полюссіз молекулалар арасында байқалады. Қазіргі кезде молекулалар аралық күштер бірнеше құбылыстардың негізінде пайда болады деп есептейді. Молекулаларды байланыстыратын күштердің табиғатын Ван-дер-Ваальс зерттеген,кейін Дебай,Кезон,Лондон өзінің үлесін қосты.Бүгінгі күні Ван-дер-Ваальс күштері (Ев) бірнеше күштерден тұратындығы айқындалды:Ев= Ек + Ед + Ел + Ет Ек-Кезюм,Ед- Дебай Ел-Лондон Ет-тебісу күштері.Молекулалар арасындағы әрекеттесулер:ориентациялық әрекеттесу,индукциялық әрекеттесу,дисперсиялық әрекеттесу.Полюсті молекулалар біріне-бірі жақындасып,қарсы зарядтармен тартылысып,бағдарласады,ориентацияланады. Осы күштерді оринтациялық күштер деп атайды.Лездік дипольдар бірімен-бірі әрекеттесуі-дисперсиялық әрекеттесу деп аталады. және сонымен қатар полюсті молекулалардың да арасында әсер етеді. Дисперсиялық молекулааралық өзара әсер полюссіз молекулалар арасында байқалады.
1* 12. Химиялық реакция жылдамдығына
температураның және зат табиғатының әсерін
айқындаңыз
Заттар әрекеттесу үшін олардың бөлшектерінің өзара кездесіп соқтығысуы қажет. Соқтығысу нәтижесінде бөлшектердің электрон бұлттарыныңң тығыздықтары өзгеріп, жаңа химиялық байланыстар түзіледі. Тәжірибе жүзінде температура әрбір 10градусқа артқанда реакция жылдамдығы 2-4 есе өсетіндігі анықталған. Бұл ереже оны ашқан автордың есімімен Вант Гофф ережесі деп аталады. Температура артқанда бөлшектердің қозғалысы шапшаңдап , соқтығыс саны көбейеді. Алайда температура он градусқа жоғарылағанда бөлшектердің жылдамдығы бар болғаны бір екі пайызға ғана артады. Соған қарамастан жылдамдықтың күрт өзгеруінің сырын түсіну үшін әрекеттесетін ортада болатын белсенді бөлшектермен, олардың ерекшеліктерімен таныстық. Кез келген химилық реакция жүру ушін қажетті әрі жеткілікті шарт тек бөлшектердің өзара соқтығысуы ғана болса, онда бірдей концентрациялы реагенттердің әрекеттесу жылдамдығының әр түрлі болуын түсіндіре алмас едік. Әр соқтығысудың нәтижесінде әрекеттесу акты туа берсе, реакция атаулының бәрі қопарылыстың жылдамдығындай шапшаңдықпен жүрер едіХимиялық реакцияның жылдамдығы әр түрлі болады. Кейбіреулері өте тез, біреулері баяу болады. Оның жылдамдығы басқа процесстердің жылдамдығы сияқты уақытпен өлшенеді.химиялық реакция жылдамдығына: әрекеттесуші заттардың табиғаты, қысым, температура, әрекеттесуші заттардың концентарциясы және катализатор әсер етеді. Әрекеттесуші заттардың табиғатының әсері. Заттың табиғатының хим.реакцияның жылдамдығына әсері үлкен. Кейбір реакциялар өте тез, біреулері баяу жүреді. Мыс: а) 2Rb
2H2O=2RbOH+H2(қопарылыс болады). б) Ag+H2O=реакция өте баяу жүреді,айлап, жылдап өтеді. Температураның әсері. Заттардың өзара әрекеттесулері үшін олардың бөлшектері бір- бірімен соқтығысуы қажет. Соның нәтижесінде бөлшектердің электрон бұлттарының тығыздықтары өзгеріп, жаңа хим-қ байланыстар түзіледі.
1* 13 Вант-Гофф ережесімен Аррениус теңдеуін
қолданылуын түсіндіріңіз
Жылдамдықтың тем-ға тәуелділігін Вант- Гоффтың эмпирикалық ережесімен бағалуға облады: «тем.әрбір 10ºС-қа артқанда реакцияның жылдамдығы 2-4 есе өседі»:Вант-Гофф ережесінің математикалық теңдеуін реакцияның жылдамдық константаларының не жылдамдықтарының арақатынасы арқылы өрнектейді:
U t2/Ut1=γ t2-t1/10
Аррениус теңдеуі. Аррениус көптеген реакцияларда температура жоғарылаған кезде жылдамдықтың артып сызықты болмайтынына назар аударады. Реакция жылдамдығының константасы мына теңдеуге бағынады.
lgK=lgA-Eакт /
2,3RT
Бұл теңдеу Аррениус теңдеуі деп аталады. Мұнда Еакт – активтену энергиясы, R- молярлы газ тұрақтысы, Т-абсолют температура, А-молекулалар арасындағы бір секунд ішіндегі жалпы соқтығысу саны. Соқтығысу молекулалардың рекацияға қолайлы ориентациялары кезінде молекулалар арасында болады.
1* 14 Гомогенді және гетерогенді катализ түсінігін,
катализдің реакция жылдамдығына әсерін түсіндіріңіз
Химиялық реакцияның жүру жылдамдығына «бөгде» заттардың әсері болғандығы ХVIII-ғасырда белгілі болған. 1812 жылы орыс химигі Киргхов крахмалға күкірт қышқылын араластырып қыздырса оның қантқа айналатынын, бірақ реакция нәтижесінде күкірт қышқылы өзгермей қалатынын байқаған.Сөйтіп реакцияның жылдамдығына катализатор заттардың үлкен әсері болатындығы анықталды.
Катализатор деп – реакцияның жылдамдығын өзгертіп, бірақ реакция нәтижеінде өздері химиялық өзгермей қалатын заттарды айтамыз.
Қалыпты жағдайдаәрекеттеспейтін кейбір заттар катализатор қатысында реакцияласа бастайды. Катализаторлар реакцияның жылдамдығын милион есеге дейін өсіре алады.
Қазііргі кезде өнеркәсіпте, әсіресе химия өнеркәсібінде катализаторлар ерекше орын алады, өйткені олардың қатысуымен түрлі процестер тездетіліп оңайланады, соның нәтижесінде керекті заттардың өнімі артады. Әр реакцияның өзіне ғана лайықты катализаторлары болады. Айталық , этил спиртінен катализатор алюминий оксиді болса, этилен алынады.:С2Н5ОН=C2H4+H2O
Ад катализатор фосфор қышқылдары болса диэтил эфирі алынады:2С2Н5ОН=C2H5OC2H5+H2O
Катализатор әсерінен реакцияда активті молекулалардың саны өседі, соның нәтижесінде реакцияжылдамдайды. Екіншіден катализатор белсендірілу энергиясы кемітеді. Мысалы, қант пен судың арасындағы реакцияның С12Н22О12+Н2О=C6H12O6+ C6H12O6
Активтену энергиясы 113,4 кДж/моль.катализатор қатысында активтену энергиясы кемиді – күкірт қышқылы қатысса 107,1кДж/моль, фермент қатысса 10кДж/моль дейін болады.
Ерогендң заттың қоспасын химияда жүйе деп атайды. Жүйе гомогенді яғни біртекті және гетерогенді болады. Гетерогенді жүйе екі немесе одан да көп бөліктен тұрады, физикалық не химиялық қасиеттерінде бөліктердің айырмашылығы болады және олардыді және беттері ғана жанасады. Бірімен-бірі араласпайды. Катализ процесі де гомогенді және гетерогенді болады. Гомогенді катализде катализатор әрекеттесуші заттар және өнімдер бір фазада болады. Гетерогенді катализде катализатор,әрекеттесуші заттар және өнім әртүрлі фазаға жатады(Мысалы, күкірт қышқылын контакт әдісімен алғанда қолданылатын катализатор Pt, қатты фазада әрекеттесуші заттар SO2мен O2 газ фазасында күкірт қышқылы сұйық фазада болады)гомогенді катализде катализатордың әсері аралық қосылыстар түзілуі арқылы түсіндіріледі. Айталық A+B=AB реакциясы өте баяу жүрсін.Оған катализатор қатыстырсақ реакция тездейді, өйткені жүйеде аралық қосылыс А+К-АК түзіледі. Аралық активті комплестің энергиясы өте жоғары болғандықтан активтендіру энергиясы төмендейді.
Түзілген аралық қосылыс Б затымен АБ қосылысын түзеді, катализатор К бос куйде бөлініп шығады АК+Б-АБ+К бұл сызбанұсқадан катализатор реакцияға қатысқанымен нәтижесінде оның химиялық куйі өзгермей қалатындығын көреміз.
А+Б=АБ О2+2Н2SO3=2H2SO4
A+K=AK O2+2NO=2NO2
AK+Б=АБ+К 2NO2+2H2SO3=2H2SO4+2NO
Не болмаса
ВГ=В+Г 2KClO3=2KCl+3O2
ВГ+К=В+ГК 2KClO3+6MnO2=2KCl+6MnO3
КГ=Г+К 6MnO3=6MnO2=3O2
Катализатор рөлін атқаратын азот оксидімен марганец диоксиді химиялық өзгерместен бқлініп шығады.
Гетерогенді катализде катализатордың әсері адсорбция арқылы ,яғни әрекеттесуші зат молекулаларының катализатор бетіне сіңірілуі арқылы түсіндіріледі.Адсорбцияның нәтижесінде катализатор бетінде әрекеттесуші заттың концентрациясы өседі,одан молекулалардың өзара түйісулері жиіленеді,демек реакция жылдамдығы артады.
Гетерогенді катализде катализатор көбіне қатты күйде болады.Қатты зат бетіндегі адсорбцияның нәтижесінде адсорбция жылуы бөлінеді,сөйтіп реакциялық жүйенің энергиясын арттырады.Осы энергияның әсерінен реакцияның активтену энергиясы төмендейді,яғни жылдамдығы артады.
Сөйтіп гомогенді катализде гетерогенді катализде катализатордың ролі реакцияның активтену энергиясының төмендеуімен байланысты.
1* 15. Химиялық байланыс және кристалдық тор
энергияларын айқындаңыз
Химиялық байланыстың табиғаты-химияның ең негізгі мәселелерінің бірі. Химиялық байланыс дегеніміз- барлыө элементтердің жекелей атомдары бір-бірімен немесе басқа атомдарымен қосылып, жай немесе күрделі бөлшектер түзу мүмкіндігі.Заттардың алғашқы химиялық құрылыс теориясын 1861 жылы орыстың ұлы ғалымы А.Н.Бутлеров ұсынды. Бутлеровтың құрылыс теориясын әрмен қарай Голландия ғалымы Вант-Гофф пен Франция ғалымы Ле Бель дамытты. Олар 1874 жылы көміртек атомының валенттіліктері тетраэдрдің төбелеріне бағытталған деген болжам айтты. Олардың пікірі бойынша,егер көміртек атомының тетраэдрдің орталығында орналасқан деп есептесе, оның валенттліктері тетраэдрдің төбелеріне қарай бағытталып, бірімен-бірі 109,6 градус бұрыш жасап тұрады. Бутлеров еңбектері заттар молекуласының құрылысын таңып білуге үлкен көмегін тигізді. Осыған қарамастан XIX ғасырда атомдардың молекулаға бірігу себебі және валенттіліктің мазмұны әлі де белгісіз болып қала берді. Бұл сұрақтарға жауап тек XX ғасырда атом құрылысы анықталғаннан кейін барып табылды. Қазіргі кездегі ұғымдар бойынша химиялық байланыс атомдардың сыртқы электрондық қабаттырының әсерлесуі нәтижесәнде пайда болады, демек, атомдарды байланыстыратын күштердің электрлік табиғаты бар деп есептеледі. Химиялық байланыстың 4 түрі бар: коваленттік, иондық, сутектік және металдық байланыс. Бұлардың ішіндегі ең жиі кездесетін және ең негізгісі – коваленттік байланыс.
Кристалдық тор энергиясы.
Иондардан,атомдардан,молекулалардан кристалл түзілгенде, оған қабаттасып энергия бөлініп шығады, ол энергияны кристалыдық тордың энергиясы дейді. Иондардың зарядының және олрадың радиустарының шамасына қарап, кристалдық тордың эенргиясын есептеп шығаруға болады. Заттың қаттылығы,беріктігі,ұшқыштығы сияқты т.б қасиеттері осы энергияға тәуелді.
1* 16. Стандартты энтропия олардың әртүрлі
процесстердегі өзгеруін түсіндіріңіз
Әр түрлі заттардың энтропиясын өзара салыстыры алатындай болу үшін,әрі үдеріс кезінде олардың өзгеруін есептейтіндей мүмкіндік тудыру үшін,жылу эффекттері тәрізді,стандартты жағдайды таңдап алады.Ол бұрыннан белгілі температураның 25°С (298°К),қысымның 1атм, тең кезі.Стандартты жағдайда газдарды идеал күйде,ал ерітінділердің концентрациясын 1мольге тең деп санайды.Міне,осындай шартқа сай анықталған энтропия мөлшерін стандартты энтропия деп атап,S°298 деп белгілейді.Химиялық реакцияның жүруі бір ғана ішкі энергияның азаюына сай бола бермейтінді, басқа да белгісіз фактордың әсеріне тәуелді. Ол фактор маңызды термодинамикалық функция –энтропия деп аталады. Энтропия да энергия сияқты әрекеттесуші бөлшектердің көп санынан тұратын кез - келген жүйенің қасиеті.Сонымен қатар,энтропияның өзгеруі жүйе күйіне тәуелді болады. Термодинамиканың бірінші заңы энергиямен байланысты болса,екінші заңы энтропиямен байланысты. Екінші заң былай айтылады: жылу мөлшері Q жүйеге T температурада қайтымды процесс арқылы сіңірілсе,жүйенің энтропиясы S мына шамаға тең болады: ΔS Энтропияның өлшемі ретінде шартты энтропиялық бірлік пайдаланылады,э.б.=4.1840кДж/моль*К. Энергияның кез келген түрі механикалық,электрлік,химиялық және басқалары түгелімен жылуға өте алады.Алайда,қайтымды толық ауыса бола алмайды,өйткені жылу энергиясының бір бөлімі таралып кетеді.Әртүрлі физикалық және химиялық процестерде энергетикалық өзгерудің қайтымсыздық дәрежесін сипаттауға энтропия қолданылады. Энтропия физикалық немесе химиялық процесстерде энергияның өз бетінше басқа түрлеріне ауыса алмайтын және жұмыс жүргізуге қолданыла алмайтын түріне ауысу шамасы деп қарастыруға боллады.Энтропияның өсуі процестердің өз бетінші жүруін,оның мүмкіншілігін сипаттайды. Энтропия өсуі арқылы жүретін процестердің мүмкіндігі зор және бұл процестер көп жағдайда өз бетінше жүреді. Егер кристалл зат суда еритін болса,энтрапия өседі.Энтрапия өсуі арқылы жүретін процестер тек тұйық жүйелерде ғана жүретінін ғана ескеруін керек.Мұндай процестер қайтымсыз болып табылады.Барлық қайтымды процестерде энтрапия өзгермейді.ΔS=0.Кей жағдайларда табиғатта процестер өз бетінше энтрапия өзгеруімен де жүруі мүмкін.Бұл тек жүйе тұйық болмаған жағдайда және энергия өзгерген кезде ғана болады.Энтрапияны да энергияны да өлшеуге болмайды,оны тек жүйенің жылулық сипаттамаларын қолдана отырып сипаттауға болады.Бастапқы күйден соңғы күйге ауысу процесінде жүйенің энтрапия өзгерісін мына формуламен оңай табуға болады:ΔS=Sc-Sb=R*LnWc\Wb7Энтрапия заттың бөлшектерінің қозғалысын көрсететін және заттың бнрілген күйіндегі ықтималдық сипаттамасы.S=k*LnW болатын қасиеті.
Күрделі О3-Тің әр бағытта қозғалу мүмкіншілігі тіпті жоғары.Осыған орай бұл үш бөлшектің бірте-бірте энтропиясы ұлғаяды.Бір ,екі,төрт және алты атомнан тұратын қатты күйдегі күкірттерді келтірейік:
S0S 1=40,0, S0 S 2=54,5, S0S 4=73,1, S0S 6=90,0 э.б.
Мұрдай заңдылық газ, сұйық және қатты күйдегі күрделі заттар үшін де анық байқалады:
S0 298 Э.Б. WCI 2(K) WCI 4(K) WCI 5(K) WCI 6(K)
31 50 66 75
S0298 Э.Б. CCI 4(C) SiCI 4(C) GeCI 4(C) SnCI 4(C) PbCI 4(C)
74,0 79,0 83,0 87,4 89,4
S0298 Э.Б. SO SO2 SO3
53,0 59,2 61,2
Бір типті қосылыстардың ,мәселен тұздардың ,энтропиялары бірінен-бірі онша алшақ кетпейді:
S0298 Э.Б. BaCO3 BaTiO3 NaCIO2 CaCO3 CaSiO3
26,8 25,8 26,7 22,7 20,9
гайганы коринеди . Периодтык жуйеде орналаскан табигаты мен курылымы уксас элементтердин энтропиясы да белгили бир зандылыкпен озгереды. Мысалы, топша б-ша алганда:
S0298.э.б F Cl Br J2
48.4 53.3 58.6 62.3
S0298.э.б Be Mg Ca Sr Ba Ra
2.3 7.8 10.0 12.7 16.0 17.0
Молекулалардагы не атомдардагы болшектердин сандары(электрон, протон, нейтрон) арткан сайын энтропия жогарылай туседи.
Период б-ша орналаскан элементтерди алса:
S0298.э.б. Na Mg Al Si
12.2 7.77 6.77 4.47
Олардын атомдык массаларынын артып, курделене тускенине карамастан энтропиялары кемиди. Онын себеби бул катардагы атомдардын курылымынын ерекшкликтерине сай каттылыгынын арта бастауынды, ен «жумсак» натрийдин энтропиясы «катты» кремнийден алдекайда жогары болып шыгатынында.
Курдели заттардын энтропиясынын оларды кураушы элементтердин рет номирине тауелдилигин байкау ушин бир типти косылыстарды бутиндей периодтык жуйе б-ша алып карауга болады.
1* 17. Химиялық тепе- константасы,оның Гиббс
энергиясымен байланысын түсіндіріңіз тендік
Химиялық термодинамиканың негізгі теңдеуі Гиббс энергиясы болып табылады. ДельтаG=дельта H-TдельтаS. Мұндағы делтаН және делтаS күй функциялары: дельтаН-энтальпия, дельтаS-энтропия,Т-температура. Дельта G- Гиббстің еркін энергиясы, оны алғаш рет ұсынған американдық ғалым математик және термодинамик Д.У.Гиббстің атымен аталады. Дельта G- Гиббстің еркін энергиясы –энтальпия мен энтропияның дельта S арасындағы өзара байланысты көрсетеді. Энтальпия кез келген химиялық реакцияны энергиясы төмен күйде жүруіне жағдай жасайды, бөлшектерді мейлінше күрделі қосындыға біріктіруге бағыт береді.энтропия жүйеде «ретсіздіктің» максимальды өсу бағытына ұмтылатын, яғни бөлшектер мейлінше ретсіз орналасатын күй функциясы. Н және S функциялары бір бірімен тәуелсіз болса да, көптеген хим-қ процестер осы екі функцияның өзгерісімен жүреді. Хим-қ реакцияларда бөлшектер құрылысы күрделі бөлшектерге бірігуге ұмтылып, энтальпияны төмендетеді. Екінші жағынан бөлшектер жекеленіп, энтропияны үлкейтеді. Бұл функцияны изобара-изотермиялық потенциал д.а., кейде оны жай ғана «термодинамикалық потенциал» д.а. гиббс энергиясы,энтальпия Н және энртопия S тәрізді физ-қ шамалар күй функциясы д.а. кейбір заттар мен иондардың стандартты түзілу Гиббс энергиясы G298 (кДж/моль). Стандартты түзілу энергиясының көмегімен кез келген хим-қ процестің стандартты бос энергиясының өзгерісін есептеу ыңғайлы. Стандартты бос энегрияның өзгерісі былайша өрнектеледі:
Келтірілген теңдеуден мынадай қорытынды шығады: хим-қ реакцияның бос энергиясы жеке реакция өнімдерінің түзілу бос энергияларының қосындысынан бастапқы реагентттердің мәндерінің қосындысын алып тастағандағы айырымға тең. Дельта Gº шамасы бойынша процестің мүмкнідігін және мүмкін еместігін анықтауға болады. барлық өздігінен жүретін хим-қ процестер жүйеде Гиббс энергиясы төмендейтін бағытта жүреді. Процестің жүру мүмкіндігі дельта G<0 орындалуына байланысты болады, яғни дельта G өзгерісі теріс таңбалы шама болуға тиіс. Егер G~=40 кДж/моль град немесе бұдан да төмен болса, онда реакция өздігінен жүреді.
Энтропиялық фактор- Т дельта S реакцияның өздігінен жүру қабілетіне белгілі бір дәрежеде әсер етеді. 0ºК жақын температурада, Т дельта S шамасы 0-ге жақын болады, сондықтан дельтаG шамасы мен таңбасына ең алдымен энтальпиялық фактор әсер етеді. Гиббс энергиясының шамасына әсер ететін энтропиялық фактор температураның жоғарылауымен үлкейеді. өте жоғары температурада энтропиялық фактор Тдельта S энтальпиялық факторды бүркелемейді. Жоғары да емес, төмен де емес температурада дельта G- ге екі фактор да әсер етеді. Энтальпия, энтропия және Гиббс энергиясының өзара және температурамен байланысты.Гиббс энергиясының өзгерісі реакция өнімдері мен бастапқы заттардың табиғатына және физ-қ күйіне тәуелді болады, процестің жүру жолына тәуелді емес.
1.18. Стандартты электродтық потенциалдар қатарын
түсіндіріңіз
Металдардың тотықсыздандырғыштық қабілеті әр түрлі: натрий ауадағы оттекпен жылдам, ал мыс тек қыздырғанда тотығады. Темір шеге тотияйынның ерітіндісінде қызғылт мыс қабатымен қапталады, ал мыс сымы темір купоросының ерітіндісінде өзгермейді. Металдардың әр түрлі тотықсыздандырғыштық қасиетін ескеріп, орыс ғылымы Н.Н.Бекетов 1865ж.металдар белсенділігінің ығыстырғыштық қатарын құрастырды. Оны қазіргі кезде металдардың электрхимиялық кернеу қатары деп атайды:Li K Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au
Металдардың тотықсздандырғыштық қасиеті күшейеді әлсірейді
Металдың белсенділігі оның тұзының ерітіндісіне металл пластинкасын салғанда пайда болатын кернеумен анықталатыны дәлелденді. Мұндай жүйені электрод деп атайды. Металл⁄ерітінді бөліну шекарасында пайда болған потенциалдың айырылымы электродық потецоналы деп атайды. Жеке электродтық потенциалын тікелей өлшеуге болмайды. Сондықтан электродтық потенциалды кез келген температурада шартты түрде потенциалы нөл деп алынған стандартты сутектік электродпен салыстыра өлшейді.
Зерттелетін электрод пен стандартты сутекті электродтан құрастырылған тізбекте пайда болған кернеуді электродтық потенциал деп атайды.
Электродтық потенциалды әдетте Е әрпімен белгілейді. Сонымен қатар оны тотығу-тотықсыздану потенциалы деп те атайды. Стандартты жағдайдағы электрондық потенцалын стандартты электродтық поткнцал деп атайды.
Сандартты электродтық потенциалды белгілегенде, Е0 танбасының жанына сол потенциалға сай жүйені көрсетеді. Мысалы,E0Li+⁄Li Li+ ē ↔ Li0 жүйесіне жатады. E02H+⁄2H жазуы стандартты сутекті потенциалды білдіреді.
Көптеген металдар үшін стандартты электродық потенциал эксперимент жүзінде анықталған. Бірақ сілтілік және сілтілікжер металдардың Е0 шамасын тек теориялық жолмен есептейді, өйткені бұл металдар сумен әрекеттеседі.
Стандартты электродық потенциалдар қатары металдардың химиялық қасиеттерін сипаттайды. Потенциалдың алгебралық шамасы неғұрлым аз болса, бұл металдың тотықсыздандырғыштық қабілеті соғұрлым жоғары және оның иондарының тотықтырғыштық қабілеті соғұрлым төмен болады.
Сулы ортада жүретін тотығу-тотықсыздану процестері кристалдық тордың бұзылу энергиясына, атомнан электронды үзіп алу энергиясына, сондай-ақ иондардың гидраттану энергиясына тәуелді. Осыдан барып неліктен металдардың электрохимиялық кернеу қатарында бірінші орында франций емес литийй тұрған түсіндіріледі. Приодық жүйеде элементтердің дара қасиеттердінің өзгеру зандылықтары көрсетілген, ал электрохимиялық кернеу қатары металдардың сулы ортадағы белсенділігін сипаттайды. Бұл қатарға енгізілген сутек, сумен және қышқылдармен жүретін рякцияларда металдар мен сутектің тотықсыздандырғыштық белсенділіктерін салыстыруға мүмкіндік береді. Электрохимиялық кернеу қатарындағы металдардың орнына байланысты зандылықтар көптеген химилық процестерді бағдарлауға көмектеседі. Металдардың кернеу қатарын қолданған кезде олардың қасиеттерінің ерекшеліктерін есте сақтау керек. Мысалы,белсендігі жоғары металдарды Li, Na, K, Ca, Ba, белсендігі төмен металдарды тұздарының ерітінділерінен ығыстыру үшін пайдалануға болмайды. Сендер сілтілік және сілтілікжер металдары кәдімгі жағдайда сумен шабытты әрекеттесетінін білесіңдер.
Қорғасын сұйылтылған күкірт қышқылымен әрекеттеспейді, өйткені оның бетінде бірден аз еритін қорғасын сульфаты PbSO4 тұзынан қорғағыш қабат түзіледі.
Келтірілген мысалдар кқрсеткендей, стандартты электродтық потенциал қатарын қолданғанда қарастырылған процестердің ерекшеліктерін ескеру қажет. Бұл қатар сулы ортады жүретін тотығу-тотықсыздану реакциаларындағы металдардың химиялық белсендігін сипаттайды. Химиялық реакцияларда металдар өздерінің валенттік электрондарын беріп, тотықсыздандырғыш болады, негіздік қасиет көрсетеді. Металдарды тотықтыратын жай заттар бейметалдар және әр түрлі күрделі заттар: су, қышқылдар, сілтілер, тұздар, оксидтер. Металдар мен олардың иондарының әр түрлі тотықсыздандырғыштық белсендігі стандартты электродтық потенциал қатарында берілген.
1.19.
Гальвани элементтерінің электр қозғаушы
күштерін айқындаңыз.
Кез келген тотығу-тоықсыздану реакциясында
тотықсыздандырғыштың электроны
тотықтырғышқа ауысатынын білдіреді.
Мәселен, мырыш пластинкасын тотияйын
ерітіндісіне батырғанда оның бетін бос
мыс қаптай бастайды. Бұл үдеріс мырыш
пен ерітіндінің түйіліскен жерінде
жүреді. Өйткені электрондар бірден
ерітіндідегі мыс иондарына көшеді. Рас,
мұндай үдерісті екіге айырып, тотықсыздануды
бөлек тотығуды бөлек жүргізуге болады.
Ол үшін олардың арасын бөліп, электрондар
ағынын сыртқы тізбек арқылы беру қажет.
Мұндай ұстанымда жұмыс істейт н
құрал-галвани элементі. Электролит
ерітінділеріне бағытталған мырыш пен
мыс пластинкалары гальвани элементінің
электрондары деп аталады. Тотығу үдерісі
жүретін электрот-анод, тотықсыздану
үдерісі жүретін электрот-катотдеп
аталады. Екі үдеріс бірге жүрілетіндіктен
оның жалпы теңдеуі жоғарғыдағыдай етіп
бейнеленеді. Демек, гальвани элементіндегі
мыс пластинкасы жуандап мырыш еріп
жіңішкеленеді. Ішкі тізбекте де ток
туады. SO4(2-) иондары жартылай өткізгіш
қабаттан өтіп, бос мырыш иондарына
байыған мырыш сульфаты ерітіндісіне
қарай ал мырыш екі плюс ионы оң иондары
мыс плюс екі ионы азайған мыс сульфаты
ерітіндісіне қарай ауысудан туады. Егер
сыртқы тізбектегі сымның ортасын
вольтметрмен жалғаса, екі электрод-метал
пластинкаларының арасындағы элементтер
айырымын өлшеп алуға болады. Бұл
элементтер айырымы мырыш пен мыс плюс
екі ионының арасында жүрілетін тотығу
тотықсыздану реакциясының нәтижесінде
жүреді. Оның осы гальвани элементінің
электр қозғаушы күші деп атайды. Гальвани
элементінде химиялық реакцияның
энергиясы бірден электр энергиясына
айналатын болғандықтан оларды электр
энергиясының химиялық көздері деп
атайды. Гальвани элементінің негізін
құрайтын химиялық тізбекті арнайы
сұлбамен белгілейді: (+)Cu l Cuso4
н
құрал-галвани элементі. Электролит
ерітінділеріне бағытталған мырыш пен
мыс пластинкалары гальвани элементінің
электрондары деп аталады. Тотығу үдерісі
жүретін электрот-анод, тотықсыздану
үдерісі жүретін электрот-катотдеп
аталады. Екі үдеріс бірге жүрілетіндіктен
оның жалпы теңдеуі жоғарғыдағыдай етіп
бейнеленеді. Демек, гальвани элементіндегі
мыс пластинкасы жуандап мырыш еріп
жіңішкеленеді. Ішкі тізбекте де ток
туады. SO4(2-) иондары жартылай өткізгіш
қабаттан өтіп, бос мырыш иондарына
байыған мырыш сульфаты ерітіндісіне
қарай ал мырыш екі плюс ионы оң иондары
мыс плюс екі ионы азайған мыс сульфаты
ерітіндісіне қарай ауысудан туады. Егер
сыртқы тізбектегі сымның ортасын
вольтметрмен жалғаса, екі электрод-метал
пластинкаларының арасындағы элементтер
айырымын өлшеп алуға болады. Бұл
элементтер айырымы мырыш пен мыс плюс
екі ионының арасында жүрілетін тотығу
тотықсыздану реакциясының нәтижесінде
жүреді. Оның осы гальвани элементінің
электр қозғаушы күші деп атайды. Гальвани
элементінде химиялық реакцияның
энергиясы бірден электр энергиясына
айналатын болғандықтан оларды электр
энергиясының химиялық көздері деп
атайды. Гальвани элементінің негізін
құрайтын химиялық тізбекті арнайы
сұлбамен белгілейді: (+)Cu l Cuso4 Znso4l
Zn (-) Ерітіндіге оң иондарын беретін,
сондықтан артық электрондар шоғырланған
мырыш пластинкасы теріс плюс, ерітіндіден
оң иондарды өздеріне тартып, жинап
алатын мыс пластинкасы оң плюс деп
саналады, ал оларды жартылай өткізгіш
қабат таңбасы (ll) бөліп тұрады. Гальвани
элементтерін өз тұздарына батырған
кез- келген екі металдан жасауға болады.
Өйткені элнктр тоғы тууы үшін екі
электротта белгілі бір эллементтер
айырымы туу жеткілікті. Мәселен, мырыш
пен темір пластинкаларын өз тұздарына
батырғанда екуі де теріс зарятталады,
соған қарамастан электроттарды өзара
қосқанда белсендірек мырышқа жиналған
электрондар, одан белсендісіздеу
темірдегімен салыстырғанда молырақ
болғандықтан, біріншісінен екіншісіне
қарай ағып, электр тоғын тудырады.
Znso4l
Zn (-) Ерітіндіге оң иондарын беретін,
сондықтан артық электрондар шоғырланған
мырыш пластинкасы теріс плюс, ерітіндіден
оң иондарды өздеріне тартып, жинап
алатын мыс пластинкасы оң плюс деп
саналады, ал оларды жартылай өткізгіш
қабат таңбасы (ll) бөліп тұрады. Гальвани
элементтерін өз тұздарына батырған
кез- келген екі металдан жасауға болады.
Өйткені элнктр тоғы тууы үшін екі
электротта белгілі бір эллементтер
айырымы туу жеткілікті. Мәселен, мырыш
пен темір пластинкаларын өз тұздарына
батырғанда екуі де теріс зарятталады,
соған қарамастан электроттарды өзара
қосқанда белсендірек мырышқа жиналған
электрондар, одан белсендісіздеу
темірдегімен салыстырғанда молырақ
болғандықтан, біріншісінен екіншісіне
қарай ағып, электр тоғын тудырады.
1*20. Электролиттер және бейэлектролиттерге арналған
Рауль заңын түсіндіріңіз
Рауль заңы ерітінді бетіндегі бетіндегі қаныққан бу қысымының салыстырмалы төмендеуі еріген заттың молдік үлесіне тең. Еріген және балқыған күйінде электр тогын өткізетін заттар электролиттер ал еріген және балқыған күйінде электр тогын өткізбейтін заттар бейэлектролиттер деп аталады.Электролиттерге тұздар,қышқылдар және негіздер,ал бейэлектролиттерге көптеген бейорганикалық заттар,мысалы,эфирлер,спирттер,қант,глюкоза және тағы баскалар жатады.Ұшпайтын бейэлектролиттер сұйық ерітінділерін қарастырған Рауль заңына бағынады.
∆Р/P0=P0-P/P0=N2 (1)
∆t(қату)=km(2)
∆t(қайнау)=km(3)
∏=cRT (4)
1,2,3 және 4 теңдеулерімен сипатталатын қасиеттердің барлығы да еріген заттың ерітіндідегі молекулаларының санына тәуелді.Сондықтан сұйық ерітінділер үшін Рауль заңын былай тұжырымдауға болады:Сұйытылған ерітінділердің қасиеттері (буқысымының төмендеуі ,қайнау температурасының жоғарылауы, қату температурасының төмендеуі және осмос қысымы) ерітіндідегі еріген заттың бөлшектерінің салыстырмалы санына тура пропорционал.Бейэлектролиттердің ерітіндісінің концентрациясы белгілі болса ,оның қасиеттерін жоғарыда келтірілген теңдеулер бойынша есептеуге болады.Мысалы,глюкозаның 0.1 молярлық ерітіндісінің (3) теңдеуі бойынша есептелген қату температурасының төмендеуі (∆t( қату)=0.186) тәжірибе жүзінде анықталған шамаға (∆t1(қату )=0.186) тең.Дәл сол сияқты глюкоза ерітіндісінің (1),(2) және (4) теңдеулер бойынша есептеоген басқа да қасиеттері де тәжірибелік деректермен үйлеседі.Электролиттер ерітінділері үшін мынадай теңдеулер орындалады.
∆Р1/∆P=I (5)
∆t1( қайнау)/∆t(қайнау )=I (6)
∆t1 (қату )/∆t(қату )=i (7)
∏1(дәрежеде)/∏=і (8)
Мұндағы ∆Р1, ∆t1(қату), ∆t1( қайнау) ∏1- электролит ерітіндісінің тәжірибе жүзінен анықталған бу қысымының төмендеуі, қайнау температурасының жоғарылауы, қату температурасының төмендеуі, және осмос қысымы; ∆Р, ∆t(қайнау), ∆t(қату),∏- және (1,2,3,4) теңдеулер көмегімен есептелген шамалар; і- тәжірибе жүзінде анықталған шамалардың теория бойынша есептелген шамалардан қанша есе үлкен екенін көрсететін коэффицент.
Енді осы коэффицентті ескеріп Рауль және Вант-Гофф заңдарын мынадай жалпы түрде жазуға болады.
∆Р/P0=P0-P/P0=і*N2(9)
∆t(қату)=іЕm(10)
∆t(қайнау)=ікm (11)
∏=іcRT (12)
Бейэлектролиттер үшін изотондық коэффицент і=1, сондықтан (9) және (10) теңдеулер (1), (4) теңдеулерге айналады. Электролиттер үшін изотондық коэффициент әрдайым бірден үлкен шама і>1. Мысалы , КСl сұйытылған ерітіндісі үшін і=1,85, ал сурьма SrCl2 үшін і=2,5 т.с.с.
2*1 Заттардың молекулалық массаларын
криоскопия, эбулиоскопия әдістерін талдаңыз
Ерітінділердің қайнау және қату температуралары олардың бетіндегі бу қысымына байланысты айтылды.Сұйықтың қайнау температурасы деп сұйық бетіндегі бу қысымының сыртқы атмосфералық қысымға теңескен кездегі температураны айтады.Ерітіндімен таза еріткіштің қайнау температураларының айырымы қайнау температрасының жоғарлауы деп аталады.Ерітінді мен еріткіштің қату температурасы арасындағы айырмашылықты қату температурасының төмендеуі деп атайды.Рауль көптеген ерітінділердің қату және қайнау температураларын өлшеп,мынадай қорытынды жасады. Ерітіндінің қайнау температурасының жоғарлауы мен қату температурасының төмендеуі еріген заттың концентрациясына пропорцияна л(Раульдің екінші заңы) Математикалық түрде раульдің екінші заңын былай өрнетеледі:Қайнау=Е×m Ϫtқату=К×m
Мұнда m-ерітідінің мольдік концентрациясы,Е-эбулиоскопиялық тұрақты,К-криоскопиялық тұрақты,Ϫtқайнау-қайнау температурасының жоғарлауы,Ϫtқату-қату температурасының төмендеуі. Эбулиоскопиялық және криокопиялық констаталар тек ерігіштің табиғатына байланысты бұл тұрақтыларды К,Е тәжірибелік жолмен Ϫtқайнау,Ϫtқату мөлшерлерді қолдана отырып концентрациясы белгілі ерітінділерге табады.Эбулиоскопиялық константа еріген заттың концентрациясымен табиғатына тәуелсіз еріткіш табиғатына ғана тәуелді тұрақты шама.Криокопиялық константа еріген заттың табиғатымен концентрациясына тәуеліз.Еріткіш табиғатына ғана тәуелді.Эбулиосопиялық константа моляльдығы бірге тең ерітіндінің таза еріткішпен салыстырғанда қанша градус жоғары қайнататынын көрсетеді.Криоскопиялық константа моляльдығы бірге тең ерітіндің таза еріткішен салытырғанда қанша градус төмен қататынын көрсетеді.
2* 2. Газдардың, сұйықтардың және қатты заттардың
суда ерігіштігін талдаңдар
Газдар да қатты заттар сияқты суда ериді. Мысалы, 20о С-та және 1 атмосфера қысымда судың бір литрінде 17,9 мл ( қалыпты жағдай) ауа ериді.
Газдардың ерігіштігімен танысу үшін мынадай тәжірибе қарастырылады. Жабық ыдыстың ішіне су құйылып, су үстіндегі бос кеңістік газбен толтырылсын (113-сурет). Су мен газ бірінен-бірі жанасу беті арқылы бөлінген. Үздіксіз және ретсіз қозғалып жүрген газ молекулалары судың бетіне соқтығысып, суда қалып қояды, яғни, суда ери бастайды. Еру нәтижесінде судағы газ молекулаларының концентрациясы артады. Ерітіндідегі газ молекулалары да үздіксіз және ретсіз қозғалыста болады. Осылай қозғалып жүрген молекулалардың кейбіреулері (жылдамырақ қозғалып жүргендері) ерітіндіден бөлініп, су үстіндегі газбен толтырылған кеңістікке қайта оралады. Онымен жабық ыдыста қарама-қарсы бағытталған екі үдеріс – газдың еруі мен ерітіндіден бөліну үдерістері жүріп жатады. Егер қысым мен температура тұрақты болса, біраз уақыттан соң бұл үдерістердің жылдамдықтары теңесіп, жүйеде тепе-теңдік орнайды.
А (газ) ↔ А(ерітінді)
Уақыт бірлігінде газдың қанша молекуласы ерісе, соншасы ерітіндіден бөлініп шығады, яғни ерітіндідегі газ молекулаларының концентрациясы тұрақты шамаға айналып, ерітінді газға қанығады. Міне, осындай қанық ерітіндінің концентрациясы газдың ерігіштігі деп аталады.
Газ ерігенде көлем кішірейеді, яғни ΔV˂0.
Ле-Шателье көлем кішірейетін (газдың еру) бағытына ығысып, ерігіштік артады. Газ ерігіштігіне қысымның әсері Генри заңымен анықталады: Тұрақты температурада газдың ерігіштігі оның қысымына тура пропорционал.
Генри заңы мынадай теңдеумен өрнектеледі: с=k*P, мұндағы с – газдың ерігіштігі (моль/л), Р – газдың қысымы (атмосфера); к – пропорционалдық коэффициент, немесе Генри коэффициенті (моль/л.атм).
Сұйықтарды бірімен-бірін араластырғанда мынадай үш жағдай болуы мүмкін.
Шексіз ерігіштік. Сұйықтықтар өзара араласып, бірінде-бірі шексіз ериді, мысалы, спирт пен су.
Шектеулі ерігіштік. Сұйықтықтар бірінде- бірі шекті мөлшерде ғана ериді. Осының салдарынан олар екі қабат түзіледі, жоғары қабат – аналиннің судағы ерітіндісі; төменгі қабат – судың аналиндегі ерітіндісі. Температураны жоғарылатқанда бұл сұйықтықтардың өзара ерігіштігі артып, 167оС-тан бастап бір-бірінде шексіз ери бастайды.(7.30-кесте). Сұйықтықтар шексіз араласа бастайтын температура ерудің дағдарыстық температурасы деп аталады. Анилин мен судың дағдарыстық температурасы 167оС.
Анилин мен судың өзара ерігіштігі 7.30 - кесте
TоС |
Жоғары су қабатындағы аналиннің мөлшері(%) |
Төменгі анилин қабатындағы судың мөлшері (%) |
20 |
3,1 |
5,0 |
40 |
3,3 |
5,3 |
80 |
5,5 |
6,5 |
120 |
9,1 |
9,9 |
160 |
24,9 |
28,8 |
167 |
- |
|
Сұйықтықтар бір-бірінде өте аз ериді. Мұндай сұйықтықтар іс жүзінде бірімен – бірі араласпайды. Іс жүзінде араласпайтын сұйықтықтарға май мен судың, керосин мен судың және хлороформ мен судың қоспалары мысал болады.
Араласпайтын сұйықтықтар екі қабатқа бөлінеді, жеңілдеуі жоғары қабатта, ауырлауы төменгі қабатта болады. Араласпайтын екі сұйықтықтан құралған жүйеге сол сұйықтықтардың екеуінде де еритін үшінші зат енгізсе, ол зат екі қабатқа (еріткішке) бөлініп таралады. Температура тұрақты болғанда бұл заттың еріткіштердегі концентрацияларының қатынасы тұрақты шама болады, оны таралу заңы деп атайды:

Мұндағы С1 – заттың бірінші еріткіштегі (қабаттағы) концентрациясы; С2– заттың екінші еріткіштегі (қабаттағы) концентрациясы; К – таралу коэффициенті. Мысалы, хлороформ мен судан тұратын жүйеге йод енгізсе, йод хлороформда да және суда да еріп екі қабатқа бөлініп таралады. Йодтың хлороформ мен су арасындағы таралу коэффициенті 250. Еріген йоды бар суға хлороформ қосып, араластырғанда йодтың хлороформға ауысады. Тепе-теңдік орнағанда йодтың хлороформдағы канцентрациясы судағыдан 250 есе үлкен болады. Демек, хлороформның көмегімен йодты оның судағы ерітіндісінен жинақтап, бөліп алуға болады. Еріген затты ерітіндіден араласпайтын сұйықтық көмегімен бқліп жинақтау әдісі – шайғындау ( экстрация) деп аталады. Шайғындау ерітіндіден заттарды бөліп алуда кең қолданылады
2* 3. Қышқыл мен негіздің Аррениус ұсынған иондық теориясы және оның шектеулігін дәлелдеңіз
Қышқылдар,негіздер,тұздардың еруінен түзілген ерітінділердің бір ерекшелігі-өз бойынан электр тогын өткізуі.Әдетте сұйық күйдегі таза сусыз қышқылдар токты тым әлсіз өткізеді.Олардың судағы ерітіндісінің өткізгіштігі әлдеқайда жоғары.Құрғақ тұздар,қышқылдар мен негіздер қатты күйде ешбір ток өткізбейді.Таза судың бойына да ток жүрмейді.Еріткіш(су) мен еріген зат ( қышқыл,негіз,тұз) бірге келгенде күрделі өзгеріске ұшырап электр тогын өткізетін қасиетке ие болады.Мұндай ерітіндісі ток өткізетін заттарды электролиттер,ток өткізбейтіндерді бейэлектролиттер деп атайды.Электр тоғын тұздар,негіздер,қышқылдардың ерітінділері ғана өткізіп қоймайды, оларды қыздырып балқытқанда түзілетін балқымасы да өткізеді. Ерітіндінің де,балқыманың да тоқ өткізуіне себепші болатын олардағы зарядты бөлшектер-иондардың болуынан. Швецияның ғалымы Сванте Аррениус (1887ж) қышқыл,негіз және тұздар суда ерігіенде олардың молекулалары оң және теріс иондарға ажырайды,яғни электролиттік диссоцияланады деген пікір айтады.Электролиттік диссоциациялану салдарынан ерітіндінің ішіндегі бөлшектерінің жалпы саны көбейеді,өйткені әрбәр молекула екі,болмаса бірнеше иондарға ыдырайды. Сондықтан осмос қысымының көрсеткіші концетрациялары бірдей болса да бейэлектролит ерітіндікілерден жоғарырақ болады.Бұл теория бойынша қышқылдар- еpітіндіде сутек катионын түзетін заттар.Молекуласы бір ғана сутек катионын түзетін қышқыл бір негізді,ал екі немесе одан да көп сутек катионын түзетін қышқылдар көп негізді қышқылдарға жатады.Мысалға,тұз қышқылының бір молекуласы ерітіндіде бір сутек ионын HCl(ер.)↔H+(ер) Cl-(ер)
Ал фосфор қышқылының бір молекуласы үш сутек ионын түзе алады: H3PO4(ер)↔ 3Н+(ер)+РО43-.Тұздарда электролиттік диссоциация кезінде металл катиондары мен қышқыл қалдығы аниондарын түзетін заттар жатады.Орта тұздар күшті электролиттер,олардың еріген бөлігі толық диссоциацияланады.Қышқыл тұздар алдымен металл иондарын,одан соң сутек иондарын бөліп,сатылап диссоциаланады. Негіз тұздар алдымен қышқыл қалдығы анионын,одан соң гидроксид анионын бөліп сатылап диссоциацияланады.Әдетте,қышқыл қалдығының бөлінуі аяғына дейін жүреді,ал гидроксид иондарының бөлінуі аяғына дейін жүрмейтін қайтымды үдеріс болып келеді. Ол иондардың санын табуды үйренгеннен кейін,ерітіндідегі жалпы бөлшек саны белгілі болады,одан соң электролит ерітінділері Вант-Гофф пен Рауль заңдарына бағынбайды деген пікір теріс екендігі анықталды.
2* 4. Франклин ұсынған қосылыстардың сольвожүйелер теориясы. Аммонохимия, оның аквохимиямен ұқсастығын дәлелдеңіз
Аррениус ұсынған электролиттік диссоциация теориясы қышқылдар мен негіздердің табиғатын жаңа тұрғыдан көрсеттіИондық теориябойынша қышқыл-суда ерігенде сутек ионын Н+ бөлетін заттар,өйткені қышқылдарға тән жалпы қасиеттер-металдарға,индикаторларға әсері,дәмі,т.т. бәрі тек сутек катионының қасиеті.Негіздер-судагидроксид ионын ОН- бөлетін заттар.Олардың жалпы қасиеттері:қышқылдық табиғатты заттарға,индикаторларға әсер,денеге тигенде сабындануы т.т. бәрі тек гидроксид анионына тән.Қышқыл мен негіздердің өзара бейтараптану реакциясының теңдеуі: Н++ОН-=Н2О.Бұдан қышқылдың немесе негіздің күшін білу үшін ерітіндідегі Н+ және ОН- иондарының концентрациясын анықтау жеткілікті.Осыдан барып қышқылдар мен негіздердің басты сипаттамалары:диссоциациялану константасы,сутектік көрсеткіш рН,т.б. шықты.Күшті қышқылдар мен күшті негіздердің әрекеттесуінің жылу эффектінің тұрақты болатыны түсіндірілді.Қышқылдар мен негіздердің иондық теориясының арқасында бүтіндей суда жүретін үдерістердің аквахимиясының негізі қалыптасты.Бірақ Аррениус теориясы тиімсіз.Оның теориясында бір ғана қышқыл Н+,бір ғана негіз ОН- бар.Сондықтан бейтараптану реакциясы да жалғыз,әрі оның негізінде тұз түзілудің орнына су түзіліп тұр.Су-қышқыл мен негіздің бірін-бірі толығымен бейтараптануынан шығат.Иондық теорияға сай бір ғана екідайлы зат-су.Оның әрі негіздік,әрі қышқылдық қасиеті бұрыннан белгілі.Бірақ Аррениус теориясында судан басқа екідайды зат жоқ,себебі одан басқа ешбір зат диссоциацияланған кезде бірден Н+ және ОН- иондарын бірге бөліп шығара алмайды.Аррениус теориясы тиімсіз болса да ол әлемдік деңгейде мойындалды,себебі ол диссоциациялану дәрежесі,диссоциациялану константасы,сутектік көрсеткіш,тепе-теңдік константасы,гидролиздену константасы сияқты сандық өлшеуіштердің мәнін ашып берді.Еріткіштер ретінде басқа сұйықтықтар алынғанда иондық теория түсіндіре алмайтын жайттардың беті ашылды.Бірақ суда жүретін процес пен бейсулы еріткіште жүретін процестің арасында үлкен ұқсастық бар екенін алғаш Франклин байқады.Ол өзінің сольвожүйелер теориясын ұсынды.Судың диссоциациялануына сай аквохимия заңдарына қарап,дәл осыған ұқсатып сұйық аммиактың диссоциациялануын жазып:
2Н2О=Н3О++ОН- 2ИН3=ИН4++ИН2- аммонохимия негіздерін салуға болады.Сұйық аммиак көптеген бейорганикалық заттарды ерітеді.Бұл ерітінділер ток өткізеді,яғни еріген заттар электролиттік диссоциацияға ұшырайды.Сонда сұйық аммиак ерітіндісінде жүретін процестер сулы ерітіндідегі процестерге ұқсас екендігі көрнеді.Сулы ортада оксоний Н3О+ катионын түзетін заттар қышқылдар болса,сұйық аммиакта аммоний NH+4 катионын бөле диссоциацияланатын заттар қышқылдық қасиет көрсетед.Сол сияқты судағы гидроксид ОН- аниондарының орнына аммиакта NH-2 амид аниондары жүреді.Сольвлжүйелер теориясында қышқылдар-диссоциацияланған кезде еріткіштің өзі түзетін оң ионға ұқсас катион-лиат беретін заттар,ал негіз-диссоциацияланғанда еріткіштің өзі түзетін теріс ионға ұқсайтын анион-лионий бөлетін заттар.
2* 5. Бренстедтің протондық теориясы. Протолиттердің жіктелуін талдаңыз
.Протон-сыртында электрон қауызы жоқ жалғыз ион.Оның мқлшері басқалардан 10000 есе кіші,осыған орай ол тым қозғалғыш,қте белсенді бқлшек,басқа иондар мен молекулалардың электрон бұлтына еркін еніп кете алад,ерекше сутектік байланыс тузеді.Осы протонды арқау етіп алған қышқылдық-негіздік теорияны Бренстед ұсынған.Протондық теория бойынша сутек катионы Н+ қатысқан реакциялар протолитті реакциялар деп аталады.Теория бойынша өзінен протон бөле алатын бөлшек-қышқыл,ал протон қосып алатын бөлшек-негіз деп саналады.Бренстед теориясындағы қышқылдың анықтамасы Аррениус теориясындағы анықтамамен сай келеді.Сулы ерітіндіде Н+ бөлетін молекула протондық теория тұрғысынан алғанда қышқыл болып шығады.Бірақ ол зат еріткіш болмағанда да судан басқа еріткіште де өзінен протон бөлетіндей қабілеті болса қышқыл қатарында қала беред.Ал протондық теориядағы негіздің анықтамасы Аррениус теориясымен сәйкес келмейд,одан анғұрлым кең мағына береді.Протондық теория бойынша құрамында сутек атомы бар барлық химиялық қосылыстар-қышқылдар.Протолиттік реакциялардың ерекшелігі-қышқылдық-негіздік әрекеттесудің нәтижесінде жаңа қышқыл мен жаңа негіз шығады,олардың өзара бейтараптанып тұз түзетіндігіне еш мән берілмейді.протолиттік реакцияның жалпы түрі мынадай: НА + В ВН+ + А-
Алғашқы қышқыл НА негіз В-мен әрекеттесіп жаңа қышқыл ВН+ береді.Қышқыл1-ден шығатын А-негізді негіз1 деп атап,бұрынғы негіз В-ны негіз2 деп белгілейді.Олай болатын себебі қышқыл1 мен негіз1 өзара іліктес жұп құрайды,дәл осылай қышқыл2 мен негіз2 де іліктес жұп береді:НА А- және ВН+ В.Протондық теория бойынша қышқылдар мен негіздердің қатарына молекулалармен бірге иондар да жатады.Сондықтан оларды бейтарап,катионды,анионды деп бөледі.Көпнегізді қышқылдардың гидроаниондары екідайлы қасиет көрсетеді.Су,аммиак тәрізді еріткіштерле екідайлы зат ретінде қабылданады,өйткені олар протонды бөліп шығара да,қосып ала да алады.Бұл теорияда Арениус теориясындағыдай екідайлы заттың бір уақытта қышқылдық әрі негіздік қасиет көрсетуі шарт емес,тек қышқыл әрі негіз ретінде әрекеттесе алу қабілеті болуы шарт.Протондық теория қазіргі кезде ең кең таралған теоориялардың қатарына жатады.ол протон доноры мен акцепторы қатысатын барлық қышқылдық-негіздік әрекеттесулерді бір жүйеге келтіріп қарайды.Протондық теорияның басты артықшылығы- аса маңызды шамаларды есептеп шығаруға болатын сандық теңдеулердің болуы.Ол протолиттік реакциялардың жүру теңдігін үдеріске қатысатын қышқылдар мен негіздердің диссоциациялану константасымен байланыстырады,оған еріткіштің әсерін ескереді.
2*6 Усановичтің қышқылдық-негіздік әрекеттесу теориясының әмбебаптығын дәлелдеңіз
Усанович теориясы – қышқылдық-негіздік әрекеттесудің жалпылама теориясы. Оны академик М.И.Усанович ұсынған (1938). Теорияның басты ерекшелігі – 20 ғ-дан бері химиялық ғылымында қалыптасқан қышқылдық қасиеттің әмбебап иесі саналған сутекті жоққа шығару болды. Усанович қышқылдарға негізбен әрекеттесіп тұз түзуге қабілетті болатын бөлшектерді жатқызды. Солардың қатарында барлық катиондар, соның ішінде протондар бар. Негіздер қатарына табиғаттағы қышқылдарға қарама-қарсы заттар жатқызылады, өйткені олар қышқылдармен әрекеттескенде тұз түзеді. Демек, барлық аниондарда негіздік қабілетті бөлшек бар, себебі оларқышқылдық табиғаты бар катиондармен тікелей қосылып тұз түзеді. Усановичтің қышқылдар мен негіздерге берген анықтамасы бұдан бұрынғы әйгілі болған иондық, сольвожүйелер және протондық, электрондық теориялардың анықтамаларын қамтиды. Усанович теориясында химиядағы үйреншікті екі ұдайлылық (амфотерлік) қасиеттер кеңейте талқыланады, себебі ол барлық полюсті қосылыстарға тән. Полюсті бөлшектің молекуласының электр терістілігі жағынан катионқышқылдық, ал электрон жағынан анион-негіздік қабілетке ие болатындықтан олар әрдайым екі ұдайлылық қасиет көрсетеді. Жалпы алғанда заттар мен бөлшектердің әрекеттесетін серіктесіне байланысты қышқылдық немесе негіздік рөл атқаруы қышқылдық-негіздік табиғаттың салыстырмалы сипатқа ие болатынын дәлелдейді. Әрі бұл Усанович теориясының диалектілік мәнін аша түседі. Қарама-қарсы қасиеті бар заттар мен бөлшектердің, яғни қышқылдар мен негіздердің өзара күресі, дәлірек айтсақ, химиялық әрекеттесуі олардың бастапқы қасиеттерін әлсіретеді, көбіне түгелдей жойып жібермейді. Осыдан барып барлық дерлік заттарға белгілі бір дәрежеде қышқылдық (негіздік) қасиеттер тән деген қорытынды шығады, әрі ол сол заттың қышқылдар (негіздер) класына жатуына тәуелді еместігін көрсетеді. Усанович теориясы дәстүрлі химиялық реакциялармен қатар кешентүзу процестерін де қамтиды. Ол көптеген жайлардың сырын айқын ашып берді. Мысалы, күрделі эфирлердің қалайы (ІV) мен сүрменің (ІV) галогенидтеріне қосылып, алил катионды бөліп, электролиттік диссоциацияға ұшырауын тек жалпылама теория тұрғысынан түсіндіруге болады. Кейбір аниондар электрон жұптарының доноры бола алмайды және протон қосып ала алмайды, алайда өзінен катиондар бөліп шығарып, күшті негіздік қасиет көрсете алады, олар ВН4 немесе АlН4. Бұл бөлшектер Льюис анықтамасы бойынша негіздерге жатпайды, өйткені бос электрон жұбы жоқ, дәл осылайша Бренетед көзқарасына сай өзіне протон қосып ала алмайтындықтан негіз бола алмайды. Ал өзінен Н-анионын бөле отырып, негіздік функцияға ие болатынын Усанович теориясы ғана дәлелдеп береді. Мұндай кешенді аниондарға сәйкес келетін сутекті қышқылдар бос күйінде кездеспейді, сондықтан оларды Усанович «болмайтын қышқылдар» деп атаған. Усанович теориясы кез келген жай және күрделі заттың, зарядты бөлшектің құрамына сүйеніп, олардың мүмкін болатын хим. қасиеттерін күні бұрын болжап бере алады. Усанович теориясы химияда кеңінен қолданыс тауып келе жатқан жалпылама теория болып саналады.
2* 7. Вернердің координациялық теориясын талдаңыз
А.Вернер қатты күйінде де,суда ерігенде де тұрақты болып келетін күрделі жоғары ретті қосылыстарды координаталық немесе кешенді қосылыстар деп атады.Координация термині бір бөлшектің жанында басқа бірнеше бөлшектер шоғырлануын білдіреді.1893 ж А.Вернер ұсынған координациялық теория бойынша координациялық қосылыстардың құрылымының ортасында кешентүзуші ион не атом орналасады.Координациялық қосылыстар кешенді бөлігіндегі орталықта кешентүзуші мыс ионын Сu2+ лигандтар –төрт су молекуласы қоршап тұр.Кешентүзуші мен лигандтар бірігіп координациялық қосылыстары ішкі сферасын,ал қалғандары (SO2-4,H2O) сыртқы сфераны құрайды.Ішкі сфераны басқа бөлігінен айыру үшін шаршы жақшаға алып жазады: [NH4]Cl, [Ag(NH3)2]Cl Бұлардың орталықтағы кешентүзушінің маңына шоғырланған лигандтар: иондар, бейтарап молекулалар болатыны көоініп тұр. Кешентүзушінің айналасындағы шоғырланған лигандтар саны координациялық сан деп аталады. Жиі кездесетін координациялық сан мәндері 4 пен 6 (90 асады) одан кейінгілері 2 мен8. Кешенді ионның сыртқы сферадағы иондардың зарядының қосындысына тең,тек мәндері қарама-қарсы болады. Кешентүзушінің координациялық саны аса маңызды сипаттама болып табылыды,өйткені ол кешеннің құрамы менқұрылымын анықтайды.Анығырақ айтқанда,координациялық сан орталықтағы кешентүзушінің айналасындағы қанша орын бар екендігін көрсетеді. Кешеннің құрамына кірген енген лигандтар екі не одан да көп орын алуы мүмкін. Ондай лигандтарды полидентатты деп атайды. Жоғарыда келтірілген кешенді қосылыстардың құрамындағы лигандтар монодентатты,себебі:олар кешентүзушінің жанындағы бір ғана орынды иеленеді.Дентаттылығы бойынша моно,ди,три,тетра,пента,гекса,гепта,окта,ноно,дека т.б бола алады.Дидентатты кешенге этиламин жатады.Полидентатты кешендерді хелаттар деп те атайды.
2.8. КООРДИНАЦИЯЛЫҚ ҚОСЫЛЫСТАРДЫҢ, ҚҰРЫЛЫСЫ, ЖІКТЕЛУІ, АТАУЫН ТАЛДАҢЫЗ.
А. Вернер қатты күйінде де, суда ерігенде де тұрақты болып келетін күрделі жоғары ретті қосылыстар координациялық немесе кешенді қосылыстар деп аталады. Координация термині бір бөлшектің жанында басқа бірнеше бөлшектер шоғырлануын білдіреді. 1893 ж Вернер ұсынған координациялық теория бойынша координациялық қосылыстардың құрылымының ортасында кешентүзуші ион не атом орналасады. Мысалы, тотиайнның молекудасын алайық: CuSO₄+5H₂O=[CU(H₂O)₄]SO₄+H₂O Координациялық қосылыстар кешенді бөлігіндегі орталықта кешентүзуші мыс ионын Сu²⁺ лигандтар – төрт су молекуласы қоршап тұр. Кешентүзуші мен лигандтар бірігіп координациялық қосылыстары ішкі сферасын, ал қаоғандары сыртқы сферасын құрайды. Ішкі сфераны басқа бөлігінен айыру үшін квадрат жақшаға алып жазады: [NH₄]Cl. [Ag(NH₃)₂]Cl. K₃[Fe(CN)₆]. [Pt(NH₃)₂Cl]Cl₂ Бұлардан орталықтағы кешентүзушінің маңына шоғырланған лигандтар: иондар, бейтарап молекулалар болатыны көрініп тұр. Кешентүзушінің айналасындағы шоғырланған лигандтар саны координациялық сан деп аталады. Жиі кездесетін координациялық сан мәндері 4 пен 6 одан кейінгілері 2 мен 8. Кешенді ионның заряды сыртқы сферадағы иондардың зарядының қосындысына тең, тек мәндері қарама-қарсы болады. Айталық, К₃[Fe(CN)₆] сыртындағы калий иондарының зарядының қосындысы +3, ал кешенді ионның заряды [+3+(-6)]=-3 егер кешентүзушінің заряды белгісіз болса оны қалғандарының зарядтарының қосындысын шығарып, оны теріс мәнді етіп қойса жеткілікті. Мысалы, Н₂[SiF₆] координациялық қосылыстағы кешен түзуші Si заряды [2∙(+1)+6(-1)]+4ке тең кешентүзушінің координациялық саны аса маңызды сипаттама болып саналады, өйткені ол кешеннің құрамы мен құрвлымын анықтайды. Жіктелуі. Координациялық қосылыстардың кешенді ионының заряды бойынша оларды катионды, анионды және бейтарап деп жіктейді. Орталықтағы оң ионның айналасына бейтарап молекулалар (H₂O, NH₃ т.б ) шоғырланғанда катионды кешенге жатады: [(Al(H₂O)₆]⁺³Cl₃, [Zn(NH₃)₄]⁺²Cl₂. Егер кешентүзушіні теріс зарядты аниондар: Cl⁻, F⁻, SO₄²⁻, OH⁻,CN⁻ т.б қоршаса анионды кешенге жатады: К₂[AlF₄]²⁻, Na[Al(OH)₄]⁻¹, K₂[SO₄]⁻², Li[Al(OH)₄]⁻¹. Егер кешен түзушінің айналасына өз ионымен қоса бейтарап молекулалардан тұратын лигандтар шоғырланса бейтарап кешендер түзіледі: [Pt(NH₃)Cl₂]⁰ Бұл жіктеу бойынша кешенді қосылыстың зарядтан ьасқа сипаты айқындалмайды. Атауы. Сыртқы сфералы бейтарап кешенді қосылыстардың атауы былайша құралады: квадрат жақшада орналасқан құраушылардың алдымен сандары көрсетілген теріс зарядты лигандтар ,ақырында кешен түзушінің өзі қосылып бүкіл атау бірге аталады. Мысалы, [Pt(NH₃)Cl₂] дихлородиамминплатина. Катионды кешендердің атауы катион-аниондық реттілікті сақтайды: алдымен катиондағылигандтарды солдан оңға қарай санын көрсете отырып атап, кешентүзушінің атау септіліктегі нұсқасын сақтап, жақшада рим сандарымен тотығу дәрежесін көрсетеді. Мысалы, [Al(H₂O)₆]Cl₃ - гексааквоаллюминийтрихлориді, [Co(NH₃)₄Cl]SO₄ монохлоротетраамминкобальт(III)сульфаты. Изомерия құбылысы кешенді қосылыстар химиясында да кең таралған. Құрамы бірдей бірақ құрылысы мен қасиеттері әртүрлі кешенді қосылыстар көптеп кездеседі.оларды өзара ерекшелігіне байланысты жіктейді
2* 9. Кристалдык өріс теориясының қолданылуын талдаңыз
Коссель
(1916ж) ұсынған электростатикалық модельдің
жалғасы болып табылады.КӨ теориясында
комп.қосылыстардағы байланысты иондық
деп қарастырады.1932 жылы неміс ғалымы
Бете ұсынған кристалдық өріс теориясы
кешен түзуші мен лигандтар арасында
таза электрстатикалық әрекеттесу болып
иондық,ион дипольдық байланыстар квант
механика тұрғысынан алғанда кешен
түзуші ядромен электрондардан тұратын
жүйе ретінде қарастырылады.Бастапқыда
кристалдық өріс теориясы кристалдық
заттардың қасиеттерін түсіндіруге
қолданылды,осыдан барып теорияның атауы
қалыптасты.Алайда теория қатты кристалдық
құрамды заттардан басқа кез келген
геометриялық дұрыс орналасқан бөлшектерден
құралатын жеке иондарға табысты
қолданылады.Мысалы, моноядролы d
элементтерінің түзетін кешендерге
кристалдық өріс теориясының негізгі
ережелерін қолданайық.Кешен түзуші d
элеметтің d деңгейшесіндегі 5 орбиталь
атом ядросының кеңестігіндігі түрліше
орналасқан.
 ,
орбитальі z қсінің бойында жинақталса
,
орбитальі z қсінің бойында жинақталса
 x және y осінің бойына шоғырланған. Ал
x және y осінің бойына шоғырланған. Ал
 орбитальдары x,y,z осьтерінің арасындағы
биссектрисалар бойында жинақталған.Бос
күйдегі атом немесе ионның бірдей
деңгейшесіндегі 5d орбитальдардың
энергиялары бірдей болады.Кешентүзуші
қосылысқа айналып лигандтармен
байланысқанда олар (анион немесе полюсті
молекула) электр өрісінің әсерінен
өзгеріске ұшырайды.Кристалдық өріс
теориясы октаэдр типтегі кешендерден
басқа тетраэдрлі,квадратты және сызықты
түріне де қолданылады.Мәселен,тетраэдр
пішінді кешендерде
орбитальдары x,y,z осьтерінің арасындағы
биссектрисалар бойында жинақталған.Бос
күйдегі атом немесе ионның бірдей
деңгейшесіндегі 5d орбитальдардың
энергиялары бірдей болады.Кешентүзуші
қосылысқа айналып лигандтармен
байланысқанда олар (анион немесе полюсті
молекула) электр өрісінің әсерінен
өзгеріске ұшырайды.Кристалдық өріс
теориясы октаэдр типтегі кешендерден
басқа тетраэдрлі,квадратты және сызықты
түріне де қолданылады.Мәселен,тетраэдр
пішінді кешендерде
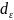 орбитальдар(
)
орбитальдар(
)
 (
( )
орбитальдармен салыстырғанда лигандтарға
жақынырақ орналасқан.Демек олардың
тебілуі күштірек болады да тетраэдр
пішінді кешендегі d-орбитальдардың
жіктелуі октаэдрлерде керісінше
болады.Осылайша кешен түзушінің
d-деңгейшесіндегі орбитальдар тетраэдрлік
пішінді (T) октаэдрге (0) қарағанда нашарлау
жіктеледі.Оның жіктелу энергиясы 2
еседей төмендейді.
)
орбитальдармен салыстырғанда лигандтарға
жақынырақ орналасқан.Демек олардың
тебілуі күштірек болады да тетраэдр
пішінді кешендегі d-орбитальдардың
жіктелуі октаэдрлерде керісінше
болады.Осылайша кешен түзушінің
d-деңгейшесіндегі орбитальдар тетраэдрлік
пішінді (T) октаэдрге (0) қарағанда нашарлау
жіктеледі.Оның жіктелу энергиясы 2
еседей төмендейді.
 Жазық квадратты кешендергі Z осінің
бойында орналасқан
орбиталіне тікелей әсер ететін лигандтар
болмағандықтан оның энергиясы төмен
қалпында қала береді.Керісінше
,
пен
Жазық квадратты кешендергі Z осінің
бойында орналасқан
орбиталіне тікелей әсер ететін лигандтар
болмағандықтан оның энергиясы төмен
қалпында қала береді.Керісінше
,
пен
 орбитальдарының жіктелуі күшейеді.
орбитальдарының жіктелуі күшейеді.
Сонымен қарапайым иондық модель комплектсі қосылыстардың түзілуін және кеңістіктегі құрылысын түсіндіре алады. Комплекс түзушінің Д- деңгейшесі тетраэдрлік квадратты және сызықты комплекстерде де жіктеледі.Тетраэдрлік комплестерде Дε – орбитальдар Ду- орбитальдарға қарағанда лигандтарға жақындау орналасқан, сондықтан олар қаттырақ тебіледі. Демек, тетраэдрлік комплексте Д-орбитальдардың жіктелуі октаэдрлік комплекстерге керіснше болады. Әртүрлі комплекстердегі ионның қоршауында Д-деңгейшенің жіктелуі:1-сфералық;2-сызықтық қоршауда;3-тетраэдрлік;4-жазық квадрат;5-октаэдрлік
2* 10. Кешенді қосылыстар изомериялық құрылысын талдаңыз
Изомерия құбылысы органикалық заттармен танысқаннан бері таныс ұғым. Ол кешенді қосылыстар химиясында да кең таралған. Құрамы бірдей бірақ құрылысы мен қасиеттері әртүрлі кешенді қосылыстар көптеп кездеседі. Оларды өзара ерекшелігіне байланысты жіктейді.
Гидраттық изомерия. Гидраттық изомерияда кешеннің құрамындағы су молекулалары түрліше орналасады. Мысалы, үш валентті хромның аквокешендері үштүрлі түр өзгеріске ие болады. Олардың бірінен – бірінің түсінде және ерітіндідегі электрөткізгіштігінде айырмашылығы айқын байқалады.

Бұлардың химиялық формуласының ішкі сферадағы су молекулаларының лигандтар санының өзгеруі айқын көрінеді. Олар сыртқы сферадағы хлор иондарымен орындарын алмастырып тұр. Мұны осы изомериялардың судағы ерітіндісіне күміс иондарын Ag+ қосқанда түзілетін тұнбаның массасы бастапқымен салыстырғанда 2 немесе 3 есе азаятыны арқылы да есептеп табуға болады.
Үш ерітіндінің электрөткізгіштігінен сыртқы сферада иондардың санының секірмелі азайғандығын көрсетеді. Мұндай жағдай кобальттың бромидінде де байқалады.
Иондардың изомериясы. Иондану изомерлерінің бірінен – бірінің айырмашылығы кешенді қосылыстар суда ерігенде әртүрлі иондарға диссоциациялануынан көрінеді. Бұл белгілі дәрежеде гидраттық изомерияға ұқсас келеді. Рас, онда су молекуласы әртүрлі функция атқарса, иондану изомериясында ондай қабілет иондарға тән. Мысалы, жалпы құрамы CoBrSO4 х 5H2O болатын қосылыстын 2 изомері бар:
қызыл – күлгін күлгін
Изомерлердің кешенді бөлігіндегі екі анион SO42- және Br сыртқы және ішкі сферада түрліше орналасатынын олардың тұнбасы бойынша да айыруға болады. Біріншісінде ақ түсті тұнба – барий сульфаты бөлінсе, екіншісінде бром ионы тұнбаға түспейді. Иондану изомерлерінің бұл түрі катионды типті кешенді қосылыстарға да тән. Олардың саны аз емес. Мысалы,
|
|
|
|
|
|
|
|
|
|
Байланыс изомериясы. Мұндай изомерлер кешентүзушіге лигандтар бірнеше тәсілдер арқылы байланысқанда түзіледі. Әдетте, мұндай лигандтар монодентатты әрі екіжақтыамбидентатты болып келеді. Мысалы, нитрит ионы NO2- азот және оттек атомдарының маңына шоғырлана алады. Ал тиоционат ион SCN азот және күкірт атомдарымен байланысады.
Байланыс изомериясын кобальт нитрокешенінен көруге болады:
сары ашық қоңыр
Екі изомердің ішкі сферасындағы екі анионның құрылымы екі түрлі болатындықтын екі түрліше қосылыстар түзіп отыр.
Осыған орай кешенді қосылыстың табиғаты өзгеріп біріншісі нитроқосылыстарға R-NO2 сәйкес келсе, екіншісі нитритті қосылыстарға R-O-N=O айналады.
Бертінге дейін әдебиетте байланыстық изомерлік жұптар тек нитроқосылыстарға тән деп келгенімен оған ұқсас R-SCN және R-NCS кешендер көпке танымал болып кетті.
Шоғырлану изомериясы. Шоғырлану изомерлері полиядролы кешенді қосылыстарға тән. Олардың құрылымындағы катиондық және аниондық кешенді иондардағы лигандтар әртүрліше орналасады. Мысалы
Шоғырлану изомериясының құрылысы оларды алу әдістері арқылы дәлелденеді:
Шоғырлану полимериясы. Шоғырлану (координациялану) изомериясының құрылысы шоғырлану полимериясымен тығыз байланысты. Олардың бірінен бірінің айырмашылығы кешентүзушінің жанына шоғырланған лигандтардың таралуымен бірге молекулалық массаларында өзгешеліктің болуында. Мысалы, қарапайым құрамы болатын кешенді полимерлер 4 түрлі пішінді иеленеді;
[Pt(
Шоғырлану полимерлері хром, родий және кейбір элементтердің кешенді қосылыстарына да тән.
Геометриялық изомерия. Координациялық теорияның авторы А. Вернердің айтуынша геометриялық изомерия кезентүзушімен байланысына тән лигандтардың кеңістікке әртүрлі орналасуы олардың санына тәуелді. Мысалы, орталық атом кешентүзушінің шоғырлану саны 4- ке тең болса, оның кеңістіктегі орналасуы квадрат, тетраэдр және пирамида пішінді бола алады. Егер лигандтың біреуі өзгеше AB3Eтипті болса, оның кеңістіктегі пішіні біреуі ғана бола алады. Ал лигандтар екі түрлі AB2E2 типті болып келсе квадрат пішіндесизомерлер цис-және транс- типті екі пішінге ие бола алады.мысаалы [Pt(NH3)2Cl2] бүтіндей ішкі сферадан тұратын шаршы кешеннің цис- изомері мен транс- изомерін алсақ:
цис – изомер транс - изомер
Сары түсті цис- изомердің аттас лигандтары шаршының көрші төбелерінде, ал ашық сары түсті транс- изомердің лигандтары қарама – қарсы төбелерінде орналасады.
2*11. Координациялық қосылыстардың магниттік қасиеттерін талдаңыз
Кристалдық өріс теориясы кешенді қосылыстардың магниттік қасиетке, түске ие болуын түсіндіре алады. Ол үшін Д орбитальдардың жіктелуіне сүйенеді. Д орбитальдағы электрондардың орналасу ретіне орай кешенді қосылыстардың магниттік қасиеттерін түсінуге жол ашады. Д орбитальдарда электрондардың орналасу реті олардың жіктелу энергиясы мен өзара жұптасу энергиясының шамасына тәуелді болады. Мұнда екі түрлі жағдай болуы мүмкін. Біріншісі, лигандтың тудыратын өрісі әлсіз болса , жіктелу энергиясынан аз болып шығады, яғни ∆˂р. Бұл жағдайда Д орбитальдардың бәрі алдымен бір электронмен , содан соң екіншісімен толығады. Екіншісі, лигандтың тудыратын өрісі күшті болса , жіктелу энергиясының шамасы электрондардың өзара жұптасуэнергиясынан асып кетеді., яғни ∆›р. Бұл жағдайда алдымен энергиясы төмен орбитальдар, содан соң жоғары энергиялы орбитальдар электрондармен толығады. Осы айтылған жағдайларға мысал ретінде үш валентті кобальттың фторокешені [CoF6]3- мен аммин кешенін [Co(NH3)6]3+ өзара салыстырайық.Со 3+ ионындағы алты Д электрондары өзара жұптасу үшін 251кДж\моль энергия қажет болады. Ал оның фторокешендегі жіктелу энергиясы 156 кДж\моль, аминкешендегісі 256 кДж\ моль құрайды. Бұдан байқалатыны фторокешеннің жіктелу энергиясының шамасы электрондардың жұптасу энергиясынан аз, олай болса мұндағы электрондар бірден ДЕ және Да орбитальдарына орналаса алады. Ал аминкешенде , керісінше жіктелу энергиясы электрондардың жұптасу энергиясынан үлкендеу, сондықтан олар Д Е орбитальдарына ғана жайғасады. Фторокешеннің төрт жалқы электроны бар, ал аминкешеннің электрондарының бәрі жұптасып келеді. Олай болса кобальтты фторокешен ионы көп спинді кешенге, ал аминкешені аз спиндіге жатады. Жалпы алғанда д дегейшесінің әлсіз жіктелетін лигандтардың кешендері көп спинді, ал күшті жіктелетіндері аз спинді болып келеді.
2* 12. Термохимияның бірінші және екінші заңдарын талдаңыз. Гесс заңының салдарын мысалдар келтіре отырып дәлдеңіз
Химиялық
үдерістердегі жылу эффектілерінің
басын біріктіретін термохимияның екі
заңы бар.Термохимияның бірінші заңы
Лавуазье-Лаплас заңы деп аталады. Жай
заттар қосылып күрделі зат түзгенде
бөлінетін жылу мөлшері сол күрделі зат
қайтадан жай заттарға ыдырағанда
сіңірілетін жылуға тең.Мысалы: H2 +F2=2HF,
 =
-128,4 ккал, 2HF=H2 + F2
=
128,4 ккал.Термохимияның бірінші заңы
былай айтылады: Тіке реакцмяның жылу
эффекті кері реакцмяның жылу эффектіне
тең,тек таңбасы қарама-қарсы.Лавуазье-Лаплас
заңының дұрыстығын қисындық жолменде
дәлелдеуге болады.Тіке реакцияның жылуы
кері реакцияның жылуынан аз болсын.Онда
осы реакцияны кезекпе-кез екі бағытта,жылу
эффектерінің айырмасына сай жоқтан бар
етіп тегін энергияға ие болып,сөйтіп,
“мәңгі қозғалтқыштың” көзі табылар
еді.Бірақ олай болмайтыны хақ.Энергияның
жалпы мөлшері өзгерместен сақталу үшін
екі ьағытта жүре алатын бір реакцияның
бірдей жағдайда алынған жылу эффектері
өзара тең болаты күмәнсіз.Термохимияның
екінші заңы орыс
ғалымы Г.И. Гесс ашқан. Бастапқы заттар
бірдей болғанымен одан шығатын өнімдерді
әртүрлі жолмен алуға болады.Осындай
бастапқы және соңғы заттар бірдей
болып,бірақ химиялыө реакция әртүрлі
сатылармен жүретін кезегі жылу мөлшерін
Гесс заңы анықтап береді:ол химиялық
реакция тікелей жүрсін,я бірнеше сатыда
өтсін.Бәрібір жылудың мөлшері тұрақты
болады.Яғни химиялық реакцияның жылу
эффекті оның жүру жолына тәуелді емес,тек
реагенттер мен өнімдердің күйіне
тәуелді.Бастапқы реагенттермен соңғы
өнімдердің күйі яғни қызуы T мен қысымы
P бірдей болып жабық жүйеде орналасқан
болса,Гесс заңының айтуынша ракцияның
жылу эффекті:∆H=∆H2+∆H3+∆H4=∆H5=∆H6+∆H7+∆H8
Гесс заңының пайдасы үлкен.Соның бірі
белгісіз реакциялардың жылу эффектірін
табу.Мысалы,көміртектің оттекте жанып,тек
бір ғана көміртек (II) оксидін CO түзуінің
жылуының тікелей тәжірибе жүзінде табу
қиын,өйткені CO әрі қарай тотығып CO2
айналып кете береді.Бірақ бізге
көміртектің толық жанғандағы,сол сияқты
CO-ның көмірқышқыл газына айналғандағы
жылу эффектері мәлім:
=
-128,4 ккал, 2HF=H2 + F2
=
128,4 ккал.Термохимияның бірінші заңы
былай айтылады: Тіке реакцмяның жылу
эффекті кері реакцмяның жылу эффектіне
тең,тек таңбасы қарама-қарсы.Лавуазье-Лаплас
заңының дұрыстығын қисындық жолменде
дәлелдеуге болады.Тіке реакцияның жылуы
кері реакцияның жылуынан аз болсын.Онда
осы реакцияны кезекпе-кез екі бағытта,жылу
эффектерінің айырмасына сай жоқтан бар
етіп тегін энергияға ие болып,сөйтіп,
“мәңгі қозғалтқыштың” көзі табылар
еді.Бірақ олай болмайтыны хақ.Энергияның
жалпы мөлшері өзгерместен сақталу үшін
екі ьағытта жүре алатын бір реакцияның
бірдей жағдайда алынған жылу эффектері
өзара тең болаты күмәнсіз.Термохимияның
екінші заңы орыс
ғалымы Г.И. Гесс ашқан. Бастапқы заттар
бірдей болғанымен одан шығатын өнімдерді
әртүрлі жолмен алуға болады.Осындай
бастапқы және соңғы заттар бірдей
болып,бірақ химиялыө реакция әртүрлі
сатылармен жүретін кезегі жылу мөлшерін
Гесс заңы анықтап береді:ол химиялық
реакция тікелей жүрсін,я бірнеше сатыда
өтсін.Бәрібір жылудың мөлшері тұрақты
болады.Яғни химиялық реакцияның жылу
эффекті оның жүру жолына тәуелді емес,тек
реагенттер мен өнімдердің күйіне
тәуелді.Бастапқы реагенттермен соңғы
өнімдердің күйі яғни қызуы T мен қысымы
P бірдей болып жабық жүйеде орналасқан
болса,Гесс заңының айтуынша ракцияның
жылу эффекті:∆H=∆H2+∆H3+∆H4=∆H5=∆H6+∆H7+∆H8
Гесс заңының пайдасы үлкен.Соның бірі
белгісіз реакциялардың жылу эффектірін
табу.Мысалы,көміртектің оттекте жанып,тек
бір ғана көміртек (II) оксидін CO түзуінің
жылуының тікелей тәжірибе жүзінде табу
қиын,өйткені CO әрі қарай тотығып CO2
айналып кете береді.Бірақ бізге
көміртектің толық жанғандағы,сол сияқты
CO-ның көмірқышқыл газына айналғандағы
жылу эффектері мәлім: ,
∆H1=Х ккал,
,
∆H1=Х ккал,
 ,
∆H2= -67,6 ккал
,
∆H2= -67,6 ккал
 ∆H3= -94,0 ккал
∆H3= -94,0 ккал

Бұлардың
басын біріктіріп бір түзудің бойына
орналастырсам,одан ∆Н3=∆Н1+∆Н2 екені
көрініп тұр. Іздеп отырған алғашқы
үдерістің жылу эффекті:
∆Н1=∆Н3-∆Н2=[-94-(-67,6)]=-26,4 ккал. Яғни графиктің
1 моль СО-ға дейін жанса, экзотермиялық
үдерістің нәтижесінде 26,4 ккал жылу
бөлінеді екен.Көміртек оксидіне екінші
оттек атомы қосылғанда 67,6 ккал
шығады.Бұдан көмірді толық жағудың
қаншалықты тиімді екендігі,алдымен
көмірді жартылай жағып,көміртек (II)
оксидінің жеке өзін отын реттінде
пайдалану мүмкіндігі көрініп
тұр.Металлургияда жоғары қызуда көміртек
оксидін әрі тотықсыздандырғыш,әрі отын
ретінде жұмсайтыны осыдан. Гесс заңы
бойынша химиялық реакцияның жылу эффекті
реагенттер мен өнімдердің физикалық
күйіне тәуелді делік.Оны тереңірек
түсіну үшін мынадай екі үдерісті
қарастырайық:
 +
+ -57,8ккал=
-57,8ккал= ,
+
-68,3ккал=
,
+
-68,3ккал= .
Бұл екі реакцияның айырмашылығы тек
бөлініп шыққан судың агрегаттық
күйінде:алғашқысында 1моль су буы,
екіншісінде 1моль сұйық су түзілген
жылу эффектілері осыған бола әртүрлі.
.
Бұл екі реакцияның айырмашылығы тек
бөлініп шыққан судың агрегаттық
күйінде:алғашқысында 1моль су буы,
екіншісінде 1моль сұйық су түзілген
жылу эффектілері осыған бола әртүрлі.
