
- •Периодический закон д. И. Менделеева
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •3. Как определить тип химической связи в веществе?
- •Билет № 2
- •Модели строения атома
- •Номенклатура
- •Гомологический ряд и изомерия
- •Физические свойства
- •Методы получения и химические свойства алканов.
- •3.Задача. Вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
- •Билет № 3
- •Теория химического строения органических соединений а.М. Бутлерова
- •Алкины. Строение, номенклатура, изомерия, физические свойства, получение
- •1. Номенклатура алкинов
- •2. Строение алкинов
- •3. Изомерия алкинов
- •4. Физические свойства и получение алкинов
- •Ионные уравнения
- •1. Если в результате реакции выделяется малодиссоциирующее вещество – вода.
- •2. Если в результате реакции выделяется нерастворимое в воде вещество.
- •3. Если в результате реакции выделяется газообразное вещество.
- •Билет № 4
- •Обратимые и необратимые химические реакции. Химическое равновесие и способы его смещения
- •1. Понятие прямой и обратной реакции
- •2. Константа равновесия
- •3. Обратимые и необратимые химические реакции
- •4. Факторы, влияющие на смещение равновесия
- •2.Спирты. Классификация спиртов. Предельные одноатомные спирты: строение и номенклатура
- •1. Названия спиртов (номенклатура июпак)
- •2. Физические свойства спиртов
- •II. Окисление
- •III. Реакции отщепления
- •1) Внутримолекулярная дегидратация
- •2) Межмолекулярная дегидратация
- •IV. Реакции этерификации
- •3. Гидролиз солей –
- •Состав, строение, свойства белков
- •Функции белков
- •Химические свойства белков
- •3. Типовые задачи на количество вещества , молярную массу и молярный объём
- •1. Основные положения теории электролитической диссоциации
- •2.Алкадиены
- •Классификация веществ. Химические свойства неорганических соединений основных классов
- •Расчеты концентрации растворенных веществ в растворах
- •Решение
- •Скорость химических реакции.
- •2. Классификация фенолов
- •3. Изомерия и номенклатура фенолов
- •4. Строение молекулы
- •5. Физические свойства
- •6. Токсические свойства
- •9. Химические свойства фенола (карболовой кислоты)
- •I. Свойства гидроксильной группы
- •Закончить уравнение возможных реакций. Указать окислитель
- •Билет № 12
- •Получение жиров.
- •Физические свойства.
- •Химические свойства.
- •Задача. Вычисление массовой доли вещества, находящегося в растворе. Формулу для вычисления массовой доли в общем виде можно записать так:
- •Пример: Рассчитайте массовую долю растворенного вещества, если при выпаривании 20 г раствора было получено 4 г соли.
- •Задача. Вычисление массовой доли вещества, находящегося в растворе. Формулу для вычисления массовой доли в общем виде можно записать так:
- •Пример: Рассчитайте массовую долю растворенного вещества, если при выпаривании 20 г раствора было получено 4 г соли.
- •Решение
- •1.1.1. Одновалентные радикалы
- •1.2. Насыщенные разветвленные соединения с одним заместителем
- •Углеводороды
- •Кислоты в свете представлений об электролитической диссоциации
- •Соли в свете представлений об электролитической диссоциации
- •Кислородсодержащие органические вещества
- •1. Понятие функциональной группы
- •2. Спирты
- •3. Карбонильные соединения
- •4. Карбоновые кислоты
- •5. Характеристика отдельных представителей
Расчеты концентрации растворенных веществ в растворах
• Количество
растворенного вещества ![]() :
:
= c•V,
где c – молярная концентрация растворенного вещества в моль/л, V – объем раствора в л.
• Масса растворенного вещества m(р.в.):
m(р.
в.) = m(р-ра)•![]() ,
,
где m(р-ра) – масса раствора в г, – массовая доля растворенного вещества. Обозначим в исходном (или неразбавленном) растворе величины c, V, m(р-ра), через с1, V1, m1(р-ра), 1, а в разбавленном растворе – через с2, V2, m2(р-ра), 2. Составим уравнения разбавления растворов. Левые части уравнений отведем для исходных (неразбавленных) растворов, а правые части – для разбавленных растворов. Неизменность количества растворенного вещества при разбавлении будет иметь вид:
![]()
Сохранение массы m(р. в.):
![]()
Количество растворенного вещества связано с его массой m (р. в.) cоотношением:
= m(р. в.)/M(р. в.),
где M(р. в.) – молярная масса растворенного вещества в г/моль. Уравнения разбавления (1) и (2) связаны между собой следующим образом:
с1•V1 = m2(р-ра)• 2/M(р. в.),
m1(р-ра)• 1 = с2•V2•M(р. в.).
Если в задаче известен объем растворенного газа V(газа), то его количество вещества связано с объемом газа (н.у.) отношением:
= V(газа)/22,4.
Уравнения разбавления примут соответственно вид:
V(газа)/22,4 = с2•V2,
V(газа)/22,4 = m2(р-ра)• 2/M(газа).
Если в
задаче известны масса вещества или
количество вещества, взятого для
приготовления раствора, то в левой части
уравнения разбавления ставится m(р.
в.) или
,
в зависимости от условия задачи.
Если
по условию задачи требуется объединить
растворы разной концентрации одного и
того же вещества, то в левой части
уравнения массы растворенных веществ
суммируются.
Довольно часто в задачах
используется плотность раствора ![]() (г/мл).
Но поскольку молярная концентрация с измеряется
в моль/л, то и плотность следует выражать
в г/л, а объем V –
в л.
Приведем примеры решения
«образцовых» задач.
(г/мл).
Но поскольку молярная концентрация с измеряется
в моль/л, то и плотность следует выражать
в г/л, а объем V –
в л.
Приведем примеры решения
«образцовых» задач.
![]() Задача
1. Какой
объем 1М раствора серной кислоты надо
взять, чтобы получить 0,5 л 0,1МH2SO4?
Задача
1. Какой
объем 1М раствора серной кислоты надо
взять, чтобы получить 0,5 л 0,1МH2SO4?
Дано:
с1 = 1 моль/л, V2 = 0,5 л, с2 = 0,1 моль/л.
Найти:
V1 = ?
Решение
V1•с1 = V2•с2,
V1•1 = 0,5•0,1; V1 = 0,05 л, или 50 мл.
Ответ. V1 = 50 мл.
Билет № 9
Скорость химических реакции.
Для достижения химического равновесия при протекании обратимых реакций требуется определенный период времени, зависящей от природы веществ, составляющих реакционную систему. Для характеристики используется величина - скорость химической реакции. Скорость реакции - это величина, показывающая как изменяется концентрация одного из веществ в единицу времени. Чтобы ускорить достижение состояния равновесия, требуется увеличить скорость реакции. Основными способами увеличения скорости реакции является повышение температуры, изменение концентрации, введение катализатора. 1.Влияние температуры. Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией - активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно,
химические реакции при высоких температурах протекают быстрее, чем при низких температурах |
Возрастание химические реакции при высоких температурах протекают быстрее, чем при низких температурах скорости реакции при нагревании в первом приближении подчиняется следующему правилу:
при повышении температуры на 10 0С скорость химической реакции возрастает в два - четыре раза. |
Зависимость скорости реакции от температуры определяется правилом Вант - Гоффа :
|
Правило Вант - Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. 2.Влияние катализатора. Катализаторы - это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождается в конце реакции. Влияние, оказываемое катализаторами на химические реакции, называется катализом.По агрегатному состоянию, в котором находятся катализатор и реагирующие вещества, следует различать: гомогенный катализ (катализатор образует с реагирующими веществами гомогенную систему, например, газовую смесь; гетерогенный катализ (катализатор и реагирующие вещества находятся в разных фазах; катализ идет на поверхности раздела фаз). 3.Влияние концентрации реагирующих веществ.При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением. Рассмотрим общее уравнение реакции: aA +bB = cC + dD. Для данной реакции кинетическое уравнение принимает вид:
|
Из кинетического уравнения уравнения нетрудно установить смысл коэффициента пропорциональности k, называемый константой скорости реакции. Она численно равна скорости реакции, когда концентрация каждого из реагирующих веществ составляют 1 моль/л. Константа скорости зависит от природы реагирующих веществ, но не зависит от их концентраций.
Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа: при изменении температуры на каждые 10 градусов скорость большинства реакций изменяется в 2-4 раза.
Математически правило Вант-Гоффа выражается так:
![]() (3.6)
(3.6)
где v(T2) и v(T1) - скорости реакций, соответственно при температурах Т2 и T1 (T2> T1);
γ-температурный коэффициент скорости реакции.
Значение γ для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2-4.
Физический смысл величины γ заключается в том, что он показывает, во сколько раз изменяется скорость реакции при изменении температуры на каждые 10 градусов.
Поскольку скорость реакции и константа скорости химической реакции прямопропорциональны, то выражение (3.6) часто записывают в следующем виде:
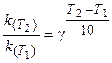 (3.7)
(3.7)
где k(T2), k(T1)- константы скорости реакции соответственно
при температурах T2 и T1;
γ -температурный коэффициент скорости реакции.
Фенол
Фенолы - производные ароматических углеводородов, в молекулах которых гидроксильная группа (- ОН) непосредственно связана с атомами углерода в бензольном кольце.

Фенол


