
- •5 Тарау. Атом және ядро физикасы
- •§30.Кванттық механика негіздері
- •30.1.Гейзенберг анықталмаушылық принципі
- •30.2.Шредингер теңдеуі
- •30.3.Еркін электрон қозғалысы
- •30.4.Потенциал “шұңқырдағы” электрон
- •30.5.Гармониялық осцилятор
- •§31.Атомдық физика
- •31.1.Резерфордың планетарлық моделі
- •31.2.Атомның ядролық моделі
- •31.3.Сутегі атомының спектрлері
- •31.4.Бор постулаттары
- •31.5.Бор теориясын сутегі атомына қолдану
- •31.6.Франк және Герц тәжірибесі
- •31.7.Кеңістіктік квантталу
- •31.8.Паули принципі
- •§32.Кванттық статистика негіздері
- •32.1.Антисимметриялы және симметриялы толқындық функциялар
- •32.2.Ферми-Дирак статистикасы
- •32.3.Бозе-Эйнштейн статистикасы
- •§33.Ядролық физика
- •33.1.Ядролық күштер
- •33.2.Атом ядросының модельдері
- •33.3.Ядроның байланыс энергиясы
- •33.4.Радиоактивтілік
- •33.5.Радиоактивтіліктің ыдырау заңы
- •33.6.Альфа-ыдырау
- •33.7.Бета-ыдырау
- •33.8.Гамма-сәулелері
- •Протондық радиоактивтілік
- •§34.Ядролық реакциялар
- •34.1.Ядролардың бөлінуі
- •34.2.Термоядролық реакциялар
31.2.Атомның ядролық моделі
Резерфорд
осы тәжірибесін қортындылай келе атомның
ядролық моделін ұсынды. Бұл модель
бойынша атомдағы барлық оң зарядтар
және атомның барлыққа дерлік массасы
кішкене көлемде – атом ядросында
жинақталған. Ядроның өлшемі шамамен
10-14![]() 10-15м.
Осы ядроны айнала жалпы заряды ядро
зарядына тең электрондар қозғалады.
Атомның өлшемдері шамамен 10-10
м.
10-15м.
Осы ядроны айнала жалпы заряды ядро
зарядына тең электрондар қозғалады.
Атомның өлшемдері шамамен 10-10
м.
моделі көрсетілген |
Бұл модель Күн жүйесіндегі планеталардың орналасуына ұқсас болғандықтан ядроның планетарлық моделі деп аталады. Резерфорд моделінің кемшіліктері: 1) бұл модель атомның тұрақтылығын түсіндіріп бере алмады. 2) бұл модель атом шығаратын сызықтық спектрлерді түсіндіріп бере алмады. |
31.3.Сутегі атомының спектрлері
Швейцар ғалымы Бальмер сутегі атомының сәуле шығару спектрін зерттей отырып, келесі заңдылықты ашты.
Бұл заңдылық Бальмер сериясы деп аталады:
![]() ,
,
мұндағы:
![]() -толқындық
сан,
-толқындық
сан,
![]() -
Ридберг тұрақтысы,
-
Ридберг тұрақтысы,
![]()
Бальмер
сериясы
![]() жиілік арқылы келесі түрде жазылады:
жиілік арқылы келесі түрде жазылады:
![]() .
.
Кейінгі тәжірибелер көрсеткендей сутегі спектрінде тағы да бірнеше спектрлер бар. Соның ішінде Лайман сериясы спектрдің ультракүлгін бөлігінде, ал басқа сериялар инфрақызыл бөлігінде жатады.
![]() -
Лайман сериясы,
-
Лайман сериясы,
![]()
![]() -
Пашен сериясы,
-
Пашен сериясы,
![]()
![]() -
Брэкет сериясы,
-
Брэкет сериясы,![]()
![]() -
Пфунд сериясы,
-
Пфунд сериясы,![]()
![]() -
Хэмфри сериясы,
-
Хэмфри сериясы,
![]()
мұндағы:
![]() -
Ридберг тұрақтысы.
-
Ридберг тұрақтысы.
Сутегі атомының барлық спектрлерін бір формуламен беруге болады. Бұл формула Бальмердің біріккен сериясы деп аталады:
![]()
мұндағы:
![]()
Кез-келген атомның сәуле шығару сызықтық спектрін екі функцияның айырмасы түрінде беруге болады. Бұл функциялар терм деп аталады.
![]()
мұндағы:![]()
31.4.Бор постулаттары
Дания ғалымы Бор Резерфорд моделіндегі кемшіліктерді түсіндіріп беретін келесі постулаттарды ұсынды:
Бордың бірінші постулаты (стационар күйлер постулаты):
Атом белгілі бір тұрақты дискретті күйлерде болады. Бұл күйдегі атом сәуле шығармайды және жұтпайды.
Импульс моментінің квантталу ережесі. Атомдағы электронның импульс моменті тек белгілі бір дискретті мәндерді қабылдайды, яғни квантталады.
![]()
Бордың екінші постулаты (жиіліктер ережесі):
Атом бір тұрақты күйден екіншісіне өткенде сәуле шығарады немесе жұтады.
![]()
1)
![]() болғанда атом сәуле шығарады.
болғанда атом сәуле шығарады.
2)
![]() болғанда атом сәуле жұтады.
болғанда атом сәуле жұтады.
31.5.Бор теориясын сутегі атомына қолдану
Сутегі
атомында электрон ядроның айналасында
Кулондық тартылу күшінің әсерінен
радиусы
![]() -ге
шеңберлік орбитамен қозғалады. Сондықтан
электонды осы орбитада ұстап тұратын
центрге тартқыш күш электрон мен ядро
арасындағы Кулондық күшке тең болады:
-ге
шеңберлік орбитамен қозғалады. Сондықтан
электонды осы орбитада ұстап тұратын
центрге тартқыш күш электрон мен ядро
арасындағы Кулондық күшке тең болады:
 .
.
Импульс моментінің квантталу ережесін ескерсек, алатынымыз:
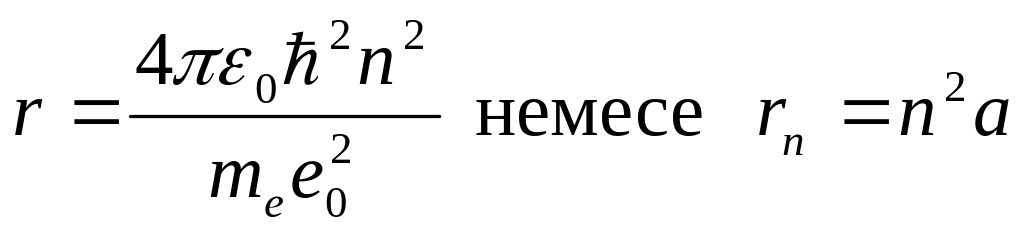 ,
,
мұндағы:
![]()
Сутегі атомындағы электронның орбитасы тек дискретті мәндерді қабылдайды, яғни квантталады.
![]() тең болғанда сутегі
атомындағы электронның бірінші
орбитасының мәні алынады:
тең болғанда сутегі
атомындағы электронның бірінші
орбитасының мәні алынады:
![]() .
Бұл мән бірінші Бор радиусы деп аталады.
.
Бұл мән бірінші Бор радиусы деп аталады.
Сутегі атомының стационар күйінің энергиясы:
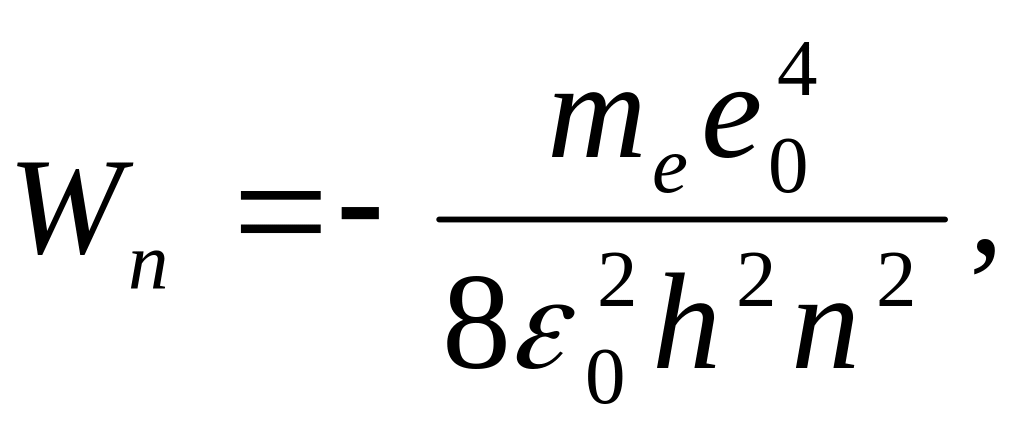
мұндағы:
![]() -бас
кванттық сан. Бас кванттық сан атом
энергиясының деңгейін анықтайды. n=1
атомның негізгі күйі, n>1 атомның қозған
күйі деп аталады.
-бас
кванттық сан. Бас кванттық сан атом
энергиясының деңгейін анықтайды. n=1
атомның негізгі күйі, n>1 атомның қозған
күйі деп аталады.
Сутегі атомының энергиясы тек дискретті мәндерді қабылдайды, яғни квантталады.

 Суретте
сутегі атомының
Суретте
сутегі атомының