
Лекции 9-10. Буферные системы.
Буферные системы – совокупность нескольких веществ в растворе, сообщающих ему буферные свойства, т.е. способность противостоять изменению активной реакции среды (pH) при разбавлении, концентрировании раствора или при добавлении к нему небольших количеств сильной кислоты или щёлочи.
Буферные системы широко распространены в природе: они находятся в водах мирового океана, почвенных водах и особенно в живых организмах, где выступают в качестве регуляторов, поддерживающих активную реакцию среды на определённых условиях, необходимых для нормального протекания жизненных процессов. Буферные системы обеспечивают состояние кислотно-основного равновесия, соответствующего норме – протолитический гомеостаз. Смещение протолитического равновесия в кислую область вызывает ацидоз, в щелочную – алкалоз. Постоянство pH биологических жидкостей, тканей и органов обусловлено наличием нескольких буферных систем, входящих в состав этих биообъектов. Буферные системы проявляют свои буферные свойства в некотором диапазоне значений pH (≈2 единицы) – называемом зона буферного действия.
Состав буферных систем.
Буферные системы подразделяются на два основных типа.
Слабая кислота и её анион, т.е. комбинация слабой кислоты и её соли с катионом сильного основания.
Слабое основание и его катион. Например, аммонийная буферная система NH3/NH4+ в растворе NH3 и NH4Cl.
Особый “подкласс” буферных систем представляют буферные системы, образованные из ионов и молекул амфолитов – аминокислотные и белковые буферные системы. Некоторые примеры буферных систем приведены в таблице 1.
Таблица 1.
I. Слабая кислота и её анион HA/A- |
|||
Название |
Состав |
Протолитическое равновесие |
Зона буферного действия |
Ацетатная |
|
|
pH=3,8-5,8 |
Гидро-карбонатная |
|
|
pH=5,4-7,4 |
Фосфатная |
|
|
рН=6,2-8,2 |
Гемогло-биновая |
|
|
рН=7,2-9,2 |
Оксигемо-глобиновая |
|
|
рН=6,0-8,0 |
II. Слабое основание и его катион B/BH+ |
|||
Аммонийная |
|
|
pH=8,2-10,2 |
PH буферных систем.
Рассмотрим в качестве примера систем I типа ацетатную буферную систему.
В водных растворах компоненты этой системы подвергаются электролитической диссоциации.
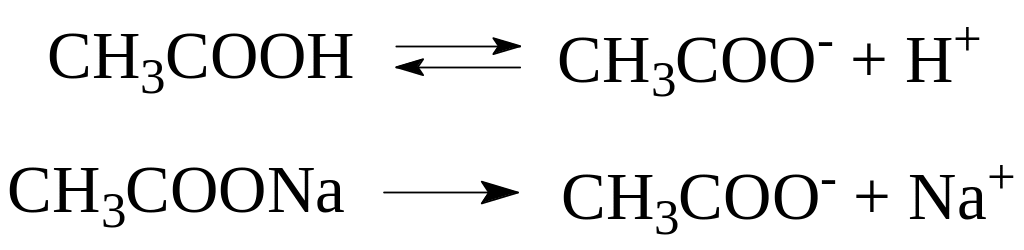
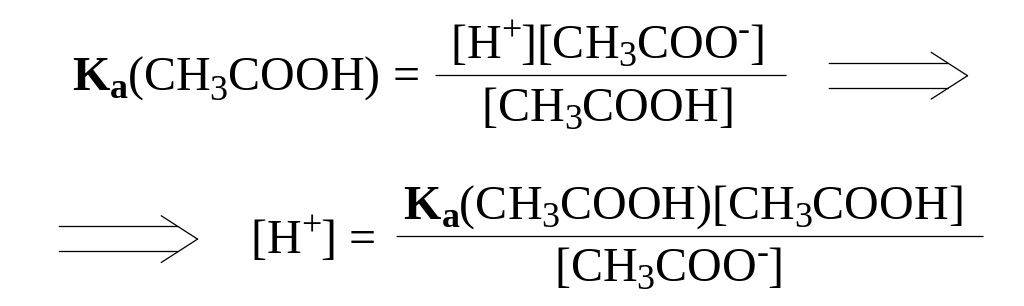
Т.к. степень диссоциации слабой уксусной кислоты значительно понижается в присутствии аниона CH3COO-, а соль как сильный электролит диссоциирует практически нацело, [CH3COOH] и [CH3COO-] можно заменить практически им равными и легко определяемыми величинами C(CH3COOH) и C(CH3COONa).
Тогда
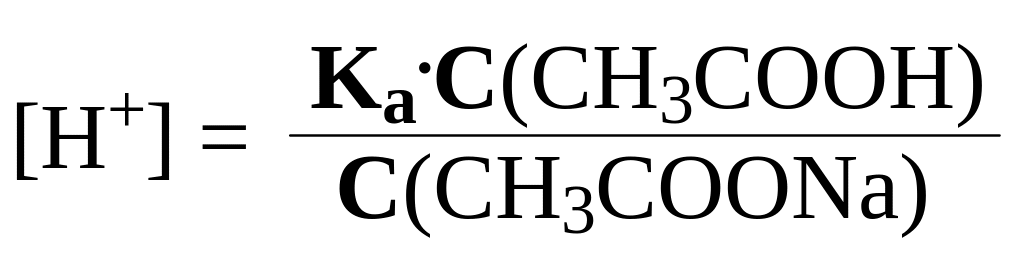 ,
т.е.
,
т.е.
![]() и, следовательно,
и, следовательно,
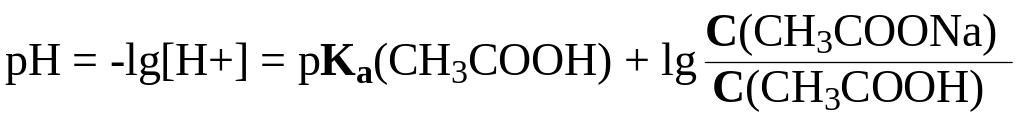 .
.
А в общем виде для систем первого типа HA/A- величина pH определяется по уравнениям 1 или 1а.
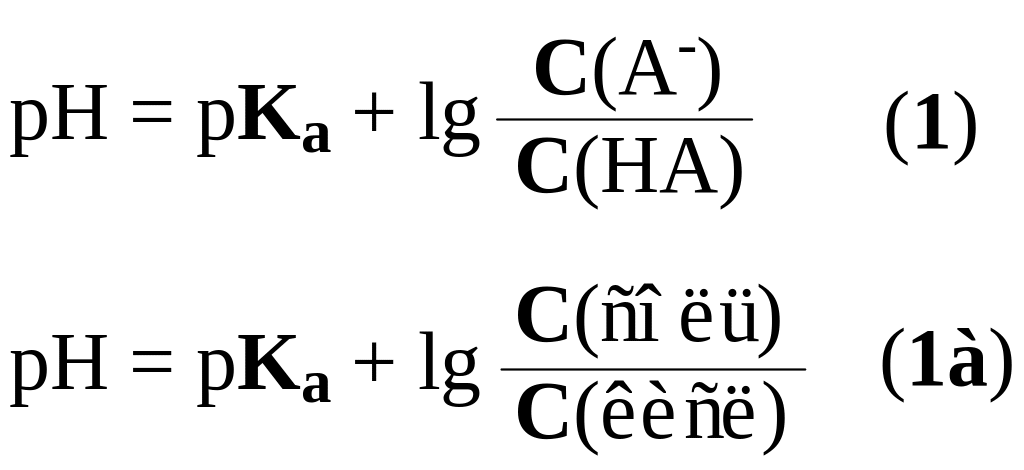
Для буферных систем второго типа B/BH+ гидроксильный и водородный показатели рассчитываются по уравнениям 2, 2а, 3, 3а.
![]()
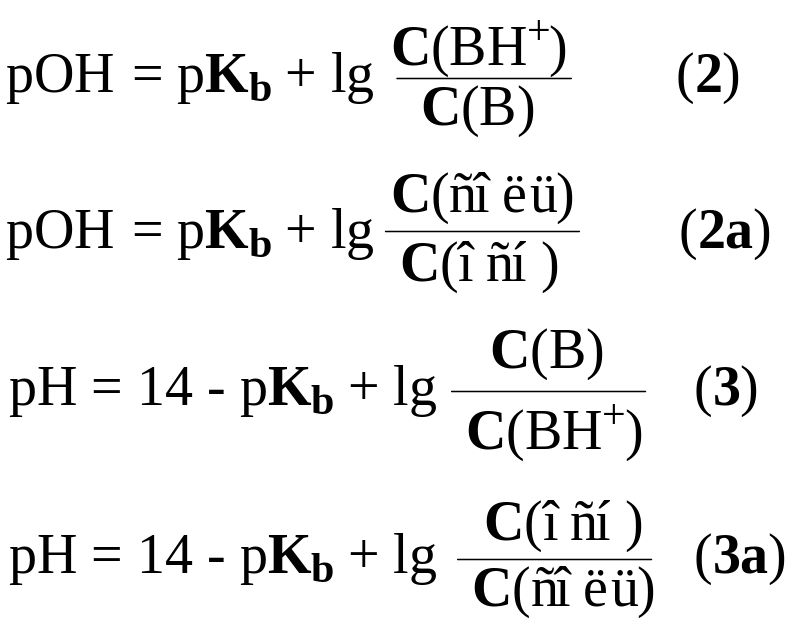
Уравнения 1-3 объединены именем авторов – уравнением Гендерсона – Гассельбаха. (Henderson, Lawrence Joseph, 1848-1942, биохимик, США. Hasselbalch, Karl Albert, 1874-1962, биохимик, Дания).
Из уравнений 1-3 следует вывод – величина pH буферных растворов определяется природой кислоты или основания, входящих в состав буферной системы (pKa, pKb) и соотношением концентраций или количеств компонентов. Это позволяет готовить буферные растворы с заданным значением pH смешиванием растворов кислоты и соли (основания и соли). pH этих растворов вычисляют по уравнениям 4 и 5.
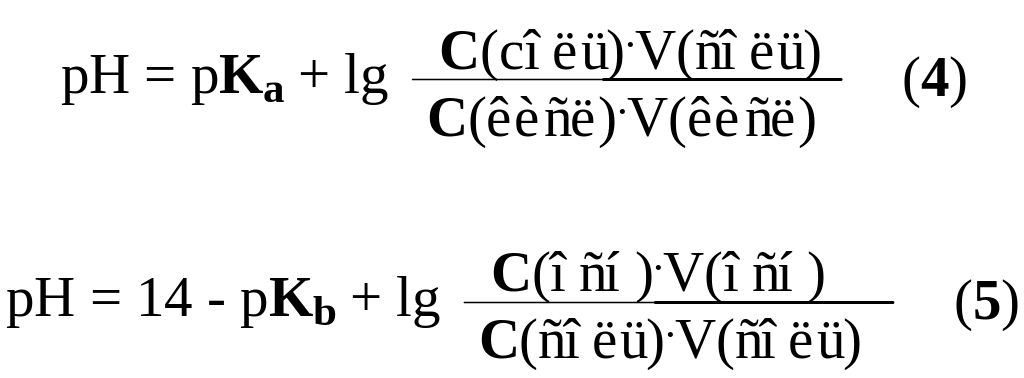
где C(соль), С(кисл), C(осн), V(соль), V(кисл), V(осн) – соответствующие характеристики исходных растворов.
Если концентрации компонентов буферных систем больше 0.1, то в уравнениях Гендерсона-Гассельбаха необходимо учитывать коэффициенты активности.
