
Лекція № ароматичні сполуки (арени)
Найпростішим представником одноядерних ароматичних вуглеводнів є бензен С6Н6.
Вперше бензол був здобутий М. Фарадеем у 1825 р. з конденсованих залишків світильного газу, який утворюється в процесах переробки кам’яного вугілля.
 У
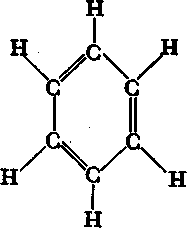
1865 р. А. Кекулє запропонував формулу у
вигляді циклу з шести атомів Карбону з
розташованими по черзі простими та
подвійними зв’язками. Пізніше було
доведено, що ці зв’язки рівноцінні (А.
Ладенбург, 1874 р. та
Е.
А. Врублевський, 1878 р.).
У
1865 р. А. Кекулє запропонував формулу у
вигляді циклу з шести атомів Карбону з
розташованими по черзі простими та
подвійними зв’язками. Пізніше було
доведено, що ці зв’язки рівноцінні (А.
Ладенбург, 1874 р. та
Е.
А. Врублевський, 1878 р.).
У відповідності до сучасних уявлень, основаних на даних квантової хімії та фізико-хімічних досліджень, молекула бензену являє собою правильний плоский шестикутник. Усі карбонові атоми знаходяться у стані sр2-гібридізації. При цьому кожний атом Карбону утворює три -зв’язки (один С – Н два С – С), які лежать в одній площині під кутом 120° один до одного (рис.1), і надає одну р-орбіталь для утворення замкненої спряженої системи, електронна густина в якій розподілена (делокалізована) між карбоновими атомами та сконцентрована головним чином над і під площиною -скелета молекули .
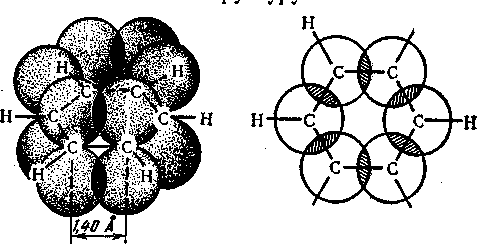
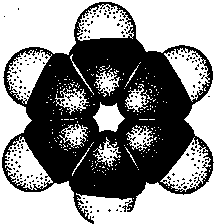
Утворення таких систем (ароматичного секстету) є енергетично вигідним. Встановлено, що спряження в циклі бензину призводить до зменшення енергії на 150 кДжмоль. Таким чином, в молекулі бензину немає простих і подвійних зв’язків, а є ароматичний зв’язок.
Сукупність специфічних властивостей бензену, а саме висока стабільність, інертність в реакціях приєднання та схильність до реакцій заміщення, одержала назву ароматичність, або ароматичні властивості.
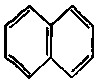
У 1931 р. німецький вчений Е. Хюккель на підставі квантово-хімічних розрахунків за допомогою методу МО сформулював правило стабільності циклічних спряжених систем, котре являє собою теоретично обгрунтований метод визначення їх ароматичності. Згідно з цим правилом, критерієм ароматичності органічної сполуки є наявність в його структурі плоского циклу, що вміщує замкнену спряжену систему, яка включає (4n + 2) -електронів, де n = 0, 1, 2, 3 і т. д. До найбільш поширених ароматичних систем, які містять б-електронів (n = 1), відноситься бензен і його похідні. Правило Хюккеля застосовується і до систем з конденсованими ядрами, такими, як нафталін, антрацен і фенантрен:
![]()
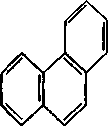
нафталін 10-електронів антрацен 14- електронів фенантрен 14- електронів
(n =2) (n =3) (n =3)
Номенклатура та ізомерія
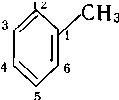
За замісниковою номенклатурою ІЮПАК одноядерні арени розглядають як продукти заміщення бензену: метилбензен, етилбензен, вінілбензен і т. д. При наявності в бензеновому кільці двох і більше замісників їх положення вказують цифрами. Нумерацію атомів карбону здійснюють таким чином, щоб замісники мали найменші номери. У дизаміщених бензенах поряд із цифровим позначенням положень замісників застосовують також префікси: орто- (о-) положення — 1,2; мета- (м-) положення — 1,3 та пара-(п-) положення — 1,4.
Крім систематичних назв в ряді одноядерних аренів збереглися і тривіальні назви: толуол, ксилол, кумол та ін. Нижче наведено деякі представники аренів (тривіальні назви подано в дужках):
Н3С—СН—СН3 СН=СН2
![]()
![]()
![]()
метилбензен (толуол) етилбензен ізопропілбензен (кумол) вінілбензен (стирол)
Одновалентні радикали ароматичних вуглеводнів мають загальну назву арили (Аг)
![]()
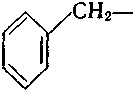
![]()
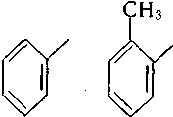
феніл- о-толіл- м-толіл- бензил о-фенілен
Дизаміщені похідні бензену існують у трьох ізомерних формах, які мають різне розміщення замісників у кільці (ізомери положення). Крім того, для гомологів бензену характерна ізомерія, зумовлена різною кількістю замісників у бензеновому кільці.
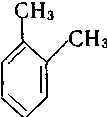
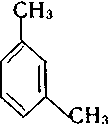
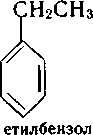
1,2-диметилбензен 1,3-диметилбенен
(о-ксилол)
