
- •1. Галогендеу процестерінің классификциясы және термодинамикалық сипаттамасы. Көмірсутектерді радикалды-тізбекті галогендеу: механизм, талғампаздық.
- •2. Сұйықтық фазада хлорлау технологиясы. Процестің жағдайлары және реакторлар түрлері.
- •4. Электрофильді орныбасу механизмі арқылы арендерді ядроға хлорлау. Бензолды хлорлау технологиясы.
- •5. Электрфилды орынбасу механизмы арқылы арендерді ядроға хлорлау. Нафталинды хлорлау технологиясы.
- •6. Электрфилды орынбасу механизмы арқылы арендерді ядроға хлорлау. Фенолды хлорлау технологиясы.
- •7. Фреондар. Фреон-12 өңдіру технологиялық сызбанұсқасы.
- •8. Фреондар. Метан мен этиленді бірігіп хлорфторлау.
- •9. Глицеринің дихлоргидринінен эпохлоргидринді алу технологиясы.
- •10. Спирттермен фенолдарды сілтілік гидролиз арқылы өндіру.
- •13. Этерификация процестерінің химиясы және теориялық негіздері. Реакция жағдайлары мен катализаторлар. Этерификациялайтын агенттер. Алкоголиз, ацидолиз, қайта этерификациялау.
- •14. Амидтеу реакциясы. Амидтерді дегидратация арқылы нитрилдерды алу.
- •15. Нитрилдерді гидролиздеу және этерификациялау. Метилметакрилатты алу технологиясы.
- •20. Процессы алкилирования в химической технологии бав
- •Механизм реакции алкилирования аренов по Фриделю-Крафтсу представляет собой обратимое электрофильное замещение (se):
- •Катализаторы в процессах алкилирования:
- •5. Катиониты
- •Условия проведения с-алкилирования
- •22. Акрилонитрилды ацетиленнен және синил қышқылынан алу. Сілтілік винилдеу технологиясы.
- •23. Кремний арқылы алкилдеу. Кремнийорганикалық заттарды тура синтездеу. Процестердің химизмы.
- •24. Алюминий арқылы алкилдеу. Реакцияның жағдайлары мен алкилдеу өнімдері.
- •25. Алюмоорганикалық заттарды тура синтездеу. Үшэтилалюминий алудың сызбанұсқасы.
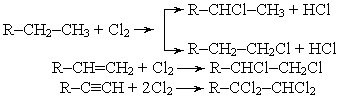
1. Галогендеу процестерінің классификциясы және термодинамикалық сипаттамасы. Көмірсутектерді радикалды-тізбекті галогендеу: механизм, талғампаздық.
ГАЛОГЕНИРОВАНИЕ (галоидирование), введение галогена в молекулу орг. соединения. Осуществляют путем р-ций замещения (заместительное галогенирование) или присоединения (присоединительное галогенирование). Заместительное галогенирование. При действии галогенов на насыщ. углеводороды (металепсия) процесс протекает при инициировании светом по свободнорадикальному цепному механизму, напр.:
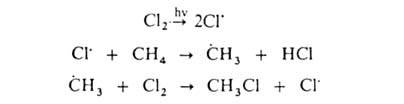
По
свободнорадикальному механизму идет
также галогенирование углеводородных
цепей жирноароматич. соединений. В
присут. к-т Льюиса р-ция протекает по
электроф. механизму, напр.:
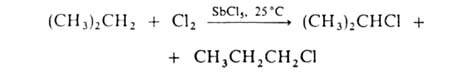
Галогенирование алифатич. карбоновых к-т в-положение проводят с помощью С12 или Вг2 в присут. красного Р (Гелля-Фолъгарда-Зелинского реакция). Замещениеводородных атомов в алифатич. и жирноароматич. карбонильных соед. идет через присоединение галогена к енольной форме, напр.:
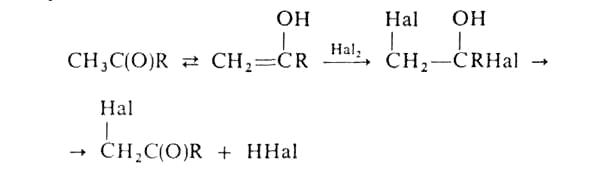 Действием
N-галогенамидов, гл. обр. N-бромсукцинимида,
в присут. пероксидов осуществляют
свободнорадикальное галогенирование
олефинов, жирноароматич. и гетероароматич.
соед. по метальной или метиленовой
группе, соседней с двойной связью или
циклом (Воля - Циглера реакция). Замещение
атомов Н на F с образованием полифторзамешенных
соед. проводят путем электрохим.
фторирования в безводном HF (р-ция
Саймонса), действием CoF3 и др. Заместительное
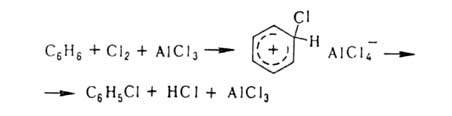
галогенирование в ядро ароматич. и
гетероароматич. соед. протекает по
механизму электроф. замещения; обычно
его осуществляют с использованием
катализаторов (гл. обр. апротонных или
протонных к-т), напр.:
Действием
N-галогенамидов, гл. обр. N-бромсукцинимида,
в присут. пероксидов осуществляют
свободнорадикальное галогенирование
олефинов, жирноароматич. и гетероароматич.
соед. по метальной или метиленовой
группе, соседней с двойной связью или
циклом (Воля - Циглера реакция). Замещение
атомов Н на F с образованием полифторзамешенных
соед. проводят путем электрохим.
фторирования в безводном HF (р-ция
Саймонса), действием CoF3 и др. Заместительное
галогенирование в ядро ароматич. и
гетероароматич. соед. протекает по
механизму электроф. замещения; обычно
его осуществляют с использованием
катализаторов (гл. обр. апротонных или
протонных к-т), напр.:
Если в ядре этих соед. присутствуют пассивирующие заместители, процесс можно проводить действием катиона галогена, образующегося из молекулярного галогена и соли Ag в среде сильной протонной к-ты (р-ция Биркенбаха-Губо-Уотерса), напр.:
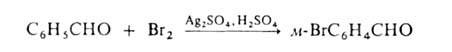
Замещение на галоген атомов, отличных от водорода, или группы атомов осуществляется чаще всего по нуклеоф. механизму. В алифатич. соед. для замены атомов галогенов (гл. обр. С1 или Вr) на иод используют Nal (Финкелъштапна реакция), а на фтор-SbF3 (р-ция Свартса). Группы ОН замещают на хлор или бром действием соответствующих галогеноводородов, тригалогенидов или оксигалогенидов фосфора, а также тионилгалогенидов, а на фтор-действием диэтил-1,1,2-трифтор-2-хлорэтиламина или SF4. Карбоксильную группу замещают на С1, Вг или I действием на серебряные соли карбоновых к-т соответствующего галогена (Бородина - Хунсдиккера реакция]. Заменой карбонильного кислорода в альдегидах или кетонах на галоген (напр., с помощью РС15, PBr5, SF4, MoF6) получают геминальные галогензамещенные. В ароматич. ряду для получения галогензамсщеиных используют замену групп NH2 на С1, Вr или I каталитич. разложением соответствующих солей диазония в присут. порошка Сu (Гаттермана-Коха реакция)или действием солей Сu (Зандмепера реакция), а на F-разложением гидрофторидов диазония (Шимана реакция). Для галогенирования ароматич. и гетероароматич. соед. используют также р-цию замещения (в т.ч. обмен галогенов), протекающую по механизму присоединения-отщепления с промежут. образованием анионныхкомплексов, напр.: Легкость заместительного галогенирования действием галогенов уменьшается в ряду F " С1 > Вr > I. Напр., для гомолитич. галогенирования метана до СН3На1 изменение энтальпии в указанном ряду составляет соотв. -418, -105, -31 и + 54 кДж/моль. Из-за высокой экзотермичности фторирование проводят при низких т-рах и разбавлении F2 азотом, а чаще вместо F2 используют фторсодержашие соединения. Иодирование действием I2, как правило, идет с трудом и к тому же резко замедляется из-за обратимости р-ции. Поэтому процесс ведут обычно в присут. окислителей (напр., HgO, HNO3), окисляющих выделяющийся HI до I2, либо солей серебра, связывающих анион I- в виде нерастворимой соли и одновременно обеспечивающих генерирование галогенирования.
Присоединительное галогенирование. К ароматич. и гете-роароматич. соед. галоген присоединяется, как правило, по радикальному механизму под действием света или при нагр., напр.:
![]()
Если цикл активирован, р-ция может протекать по ионному механизму, к-рый включает стадию присоединения аниона галогена к промежуточно образующемуся в процессе электроф. замещениякомплексу, напр.:
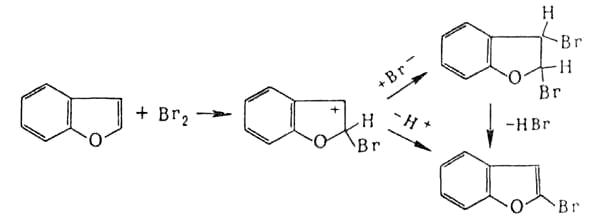 Присоединение
галогенов по кратной связи происходит
по электроф. или радикальному механизму.
Его можно осуществлять действием
галогсноводородов (см. Гидрогалогенирование),
межгалогенных соед. (напр., ClBr, СП) или
гипогалогенитов. В случае электроф.
присоединения может нарушаться правило
Марковникова, что обусловлено образованием
промежут. мостикового катиона ф-лы I,
напр.
Присоединение
галогенов по кратной связи происходит
по электроф. или радикальному механизму.
Его можно осуществлять действием
галогсноводородов (см. Гидрогалогенирование),
межгалогенных соед. (напр., ClBr, СП) или
гипогалогенитов. В случае электроф.
присоединения может нарушаться правило
Марковникова, что обусловлено образованием
промежут. мостикового катиона ф-лы I,
напр.
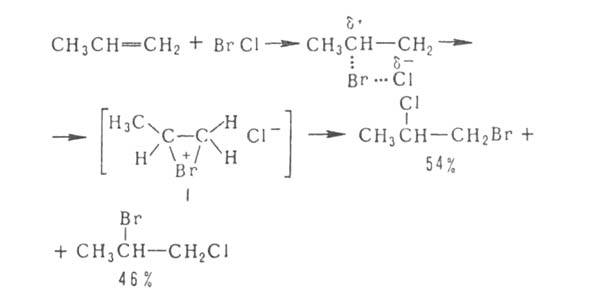 :
Способность галогенов образовывать
такие промежут. катионы возрастает в
ряду: F " С1 < Вr < I. Для введения в
молекулу атома F широко используют
варианты сопряженного присоединения
аниона F- и связанного с ним катиона по
кратной связи в среде HF, напр.:
:
Способность галогенов образовывать
такие промежут. катионы возрастает в
ряду: F " С1 < Вr < I. Для введения в
молекулу атома F широко используют
варианты сопряженного присоединения
аниона F- и связанного с ним катиона по
кратной связи в среде HF, напр.:
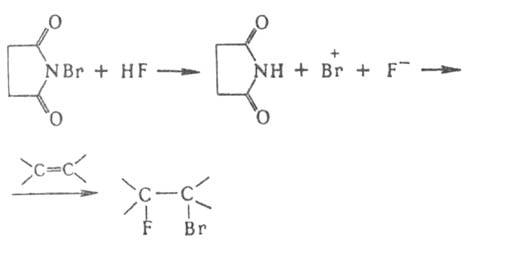
Среди процессов галогенирования широкое распространение получили процессы хлорирования углеводородов. Их ценные свойства и доступность элементарного хлора, необходимого для их получения, способствовали развитию производства хлорорганических соединений-
Фотохимическое
хлорирование - процесс хлорирования,
ускоряемый действием света. Элементарный
механизм этого процесса заключается в
активации молекул реагирующих веществ
при поглощении фотонов. Под действием
лучистой энергии хлор диссоциирует на
атомы:
![]() которые
затем взаимодействуют с углеводородом
(RH). При этом образуется свободный
углеводородный радикал R- и отщепляется
хлористый водород:
которые
затем взаимодействуют с углеводородом
(RH). При этом образуется свободный
углеводородный радикал R- и отщепляется
хлористый водород:
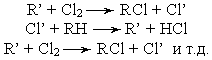 Углеводородный
радикал реагирует с другой молекулой
хлора и образует хлорпроизводные
углеводорода и один атом хлора и т. д.т
Таким образом, хлорирование углеводородов
принадлежит к цепным реакциям.
Углеводородный
радикал реагирует с другой молекулой
хлора и образует хлорпроизводные
углеводорода и один атом хлора и т. д.т
Таким образом, хлорирование углеводородов
принадлежит к цепным реакциям.
