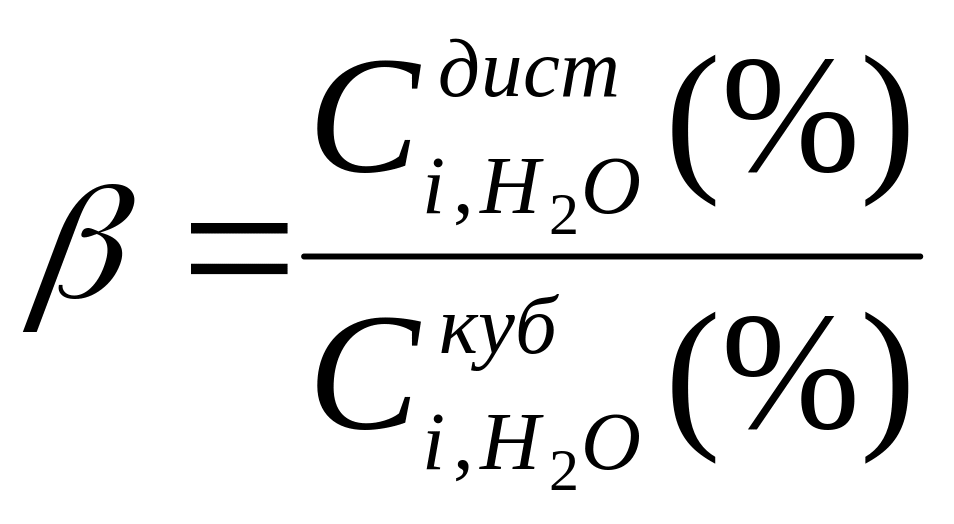- •Лабораторна робота 1
- •Вимірювання розходу рідини з використанням рівняння Бернуллі
- •Опис лабораторної установки
- •Хід виконання експерименту
- •Розрахунок технічних параметрів гідравлічного пресу
- •Опис завдання
- •Розв’язок
- •Розрахунок параметрів транспортування рідини по трубопроводу незмінного перерізу між двома ємностями
- •Хід роботи
- •Розміри конструктивних елементів теплообмінника:
- •Трубний простір
- •Результати відбору проб і титрування
- •Параметри екстракції (деякі значення наведені для порівняння)
- •Параметри титрування (деякі значення наведені для порівняння)
Результати відбору проб і титрування
№ |
|
, мл |
, мл |
|
|
|
0 |
0 |
|
|
|
Х |
X |
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
5 |
|
|
|
|
|
|
6 |
|
|
|
|
|
|
9. Всі результати ретельно перевірити і заповнити всі ячейки таблиці 2.
10. На основі даних таблиці 2 побудувати наступні графічні залежності: (а) об’єм відігнаного дистиляту як функція часу , процентний вміст води у кубовій рідині та у дистиляті (b), в усередненому дистиляті (c) як функція часу , , .
11. Розрахувати коефіцієнти розподілу
води між паровою і кубовою фазами
для різних моментів часу і побудувати
графік (d) залежності
![]() .
.
12. За вказівкою викладача знайти на
графіку (c) часовий діапазон,
у якому відганяється дистилят заданих
параметрів (вміст води більший, або
рівний певної величини, наприклад 1,04![]() ,
1,07
,
1,1
і т.д.)
,
1,07
,
1,1
і т.д.)
13. Знайшовши той же часовий проміжок на
графіку (а), визначити загальний об’єм
дистиляту
![]() і його частку
і його частку
![]() ,
яку можна відігнати в умовах даної
роботи для виконання умов, поставлених
у п.12.
,
яку можна відігнати в умовах даної
роботи для виконання умов, поставлених
у п.12.
КОНТРОЛЬНІ ЗАПИТАННЯ
1. Рівновага та швидкість масообмінних процесів. Закони Коновалова, та фазової рівноваги.
2. Фракційна перегонка, перегонка з парою, ректифікація у харчових технологіях.
3. Апаратурне оформлення перегонки та її різновидностей.
СПИСОК ЛІТЕРАТУРИ
1. Касаткин А,Г. Основные процессы и аппараты химической технологии. - М.: Химия, 1971. - С. 496 - 508.
2. Солтис М., Закордонський В. Теоретичні основи процесів хімічної технології: Навч. посібник. Львів: ЛНУ, 2002. С.176-200.
3. Гончаров А.І., Середа І. П. Хімічна технологія: Підр. Київ: Вища школа, 1979. Частина. І. С. 154-162.
4. Ю. М. Плаксин, Н. Н. Малахов, В. А. Ларин. Процессы и аппараты пищевых производств. – М.: КолосС, 2007. – С. 484-507.
Таблиця 2. Результати проведення простої перегонки
№ |
Час, (с) |
, М |
|
|
|
, мл |
, мл |
|
, М |
|
0 |
0 |
|
|
|
|
|
Х |
Х |
Х |
Х |
1 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
Продовження табл. 2. (Пояснення до розрахунків величин, позначених (*) – у формулах під графіками)
№ |
Час, (с) |
|
|
|
|
|
|
|
0 |
|
|
|
|
|
Х |
Х |
Х |
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
![]() ,
,


a b c d
У продовженні таблиці 2 заносяться розрахункові концентрації води у суміші, розраховані з концентрацій кислоти.
![]() ,
,
![]() ,
,
![]()
Лабораторна робота 7.
Ознайомлення з процесом міжфазного масоперенесення на прикладі рідинної екстракції
Мета роботи: ознайомити студентів з різновидом неперервного екстракційного масообміну між двома рідкими фазами у варіанті протитечії.
Екстракційні процеси розповсюджені у технологічних схемах, зокрема, на харчових виробництвах. Одним з найбільш відомих різновидів екстракційних процесів є додаткове вилучення рослинної олії з сировини (соняшник, оливки тощо) за допомогою екстракції органічними розчинниками. Зокрема, для цього застосовується звичайний бензин, у якому рослинна олія добре розчинна. В ході екстракції олія вилучається з сировини, далі бензин-олійна суміш піддається перегонці, бензин відганяється, а нелетка олія збирається і передається на товарну реалізацію. Зібраний і сконденсований бензин знов повертається для наступних екстракцій.
Також екстракційні процеси широко використовують для виробництва прянощів, алкогольних напоїв та парфумерних продуктів.
Основний кількісний показник процесу екстракції – коефіцієнт розподілу екстрагованої речовини між фазами (екстрагентом та вихідною фазою):
![]() .
.
Значення Кр залежить від природи екстрагенту та вихідної фази, температури, рН середовища, присутності інших речовин тощо.
Ефективне проведення екстракції вимагає дотримання певних вимог:
екстрагент повинен бути спорідненим до екстрагованою речовини;
екстрагент повинен мати селективність – вилучати переважно бажану екстраговану речовину навіть у присутності можливих домішок;
екстрагент повинен бути слабкорозчинним у рідині, з середовищі якої відбувається екстракція;
екстрагент повинен забезпечувати легке відділення від середовища, з якого відбувається екстракція (наприклад, значно відрізнятись густиною);
екстрагент повинен бути хімічно інертним по відношенню до всіх речовин, з якими контактує;
відділення екстрагенту від екстрагованою речовини повинно відбуватись легким методом (наприклад, відгонкою).
Маса речовини, що екстрагувалась протягом певного часу може бути розрахована за рівнянням:
![]() .
(*)
.
(*)
У цьому рівнянні М – маса екстрагованої
речовини, КМ – коефіцієнт
масопередачі,
![]() - середня різниця концентрації речовини,
яка екстрагується, F – поверхня
контакту фаз,
- час екстракції. Отже, для даного процесу
екстракції інтенсифікація можлива
декількома шляхами: збільшення поверхні
та часу контактування фаз (екстрагенту
і вихідної речовини), збільшення
коефіцієнту масопередачі (наприклад,
за рахунок нагрівання), збільшення
(наприклад, за рахунок збільшення
концентрації речовини, що екстрагується
у вихідній фазі, або відведення її з
екстрагенту).
- середня різниця концентрації речовини,
яка екстрагується, F – поверхня
контакту фаз,
- час екстракції. Отже, для даного процесу
екстракції інтенсифікація можлива
декількома шляхами: збільшення поверхні
та часу контактування фаз (екстрагенту
і вихідної речовини), збільшення
коефіцієнту масопередачі (наприклад,
за рахунок нагрівання), збільшення
(наприклад, за рахунок збільшення
концентрації речовини, що екстрагується
у вихідній фазі, або відведення її з
екстрагенту).
Всі описані прийоми використовуються зокрема і у харчових виробництвах з метою збільшення ефективності екстракції.
Величину можна розрахувати як середнє логарифмічне виходячи з концентрації речовини, яка екстрагується, у вихідній фазі та у екстрагенті за рівнянням:
 .
(**)
.
(**)
У цьому рівнянні Сп і Ск – концентрації речовини, яка екстрагується у екстрагенті на вході і на виході з екстракційної колони; Сп* і Ск* - концентрації цієї ж речовини у екстрагенті, які рівноважні концентраціям речовини у вихідній фазі. Іншими словами, для умов даної роботи, де оцтова кислота екстрагується з толуолу водою, Сп і Ск – концентрації оцтової кислоти у толуолі на вході і на виході з колони, а Сп* і Ск* - ті концентрації оцтової кислоти у воді, які б утворились після стабілізації процесу його вилучення з толуольних розчинів з тими концентраціями, що присутні у початку і у кінці колони.
ХІД ВИКОНАННЯ РОБОТИ
Увага! Категорично забороняється виливати толуольні розчини у каналізацію! Їх слід збирати у окремому посуді у повернути лаборанту після виконання роботи.
Схема експериментальної установки наведена на рисунку. Для виконання роботи необхідно:
1. Заповнити лійку-дозатор (3) розчином оцтової кислоти у толуолі. Тримаючи кран (7) закритим, відкрити кран лійки (3) і обережно заповнити лінію подачі толуольного розчину в екстракційну колону (1) так, щоб 1-2 мл розчину потрапило всередину колони, а у лінії подачі не лишилось бульбашок повітря. Після цього кран (3) закрити.
2. Наповнити ємність (9) дистильованою водою. Привідкрити кран (10) і обережно заповнити колону (1) дистильованою водою так, щоб вона почала витікати через переливний пристрій у збірник (11), після чого кран (10) закрити.
3. Настроїти режим роботи колони. Для цього обережно відкриваючи крани (3) і (10) добитися заданих викладачем розходів руху водної і толуольної фази. Розходи водної і толуольної фази вимірюються шляхом реєстрації об’єму водної фази, що збирається у бюретці (11) і толуольної, що збирається у бюретці (6) за певний час. Також розхід толуольної фази може задаватись шляхом встановлення проміжку між окремими краплями толуолу, що проходять крізь колону. Приблизний режим роботи екстракційної колони такий: 12-20 крапель толуолу за хвилину і 40-100 крапель води за хвилину. Зверніть увагу на те, що толуол, який надходить у мірну бюретку (6) може захоплювати з собою невелику кількість води. Це нормальне явище, однак слід за допомогою лаборанта відрегулювати положення переливного коліна перед ємністю (11) так, щоб об’єм води у ємності (6) був не більше, ніж приблизно чверть загального об’єму рідини, що туди надійшла.
4. Після того, як виконавець пересвідчився у стабільності роботи колони (проміжок між краплями толуолу у колоні приблизно однаковий), необхідно злити рідини, що накопичились у ємностях (6) і (11) і запустити секундомір.

5. В ході роботи 3-5 раз точно виміряти число крапель, що проходять через екстракційну колону протягом 3 хв. Результати занести у таблицю 1. Також, 3-5 раз точно виміряти час проходження краплею через колону. Результати занести у таблицю 1.
6. Після досягнення в
збірниках (6) чи (11) кількостей розчинів,
вказаних викладачем, крани (3) та (10)
закрити, зупинити секундомір, зафіксувавши
повний час екстракції
![]() .
Виміряти кількості розчинів у ємностях
(6) і (11) V6(к) і V11(к)
і занести їх у таблицю 1.
.
Виміряти кількості розчинів у ємностях
(6) і (11) V6(к) і V11(к)
і занести їх у таблицю 1.
7. Злити вміст збірнику (11) у окрему посудину. У ту ж саму посудину злити невелику частину води, що накопичилась нижній частині збірнику (6) за рахунок її захоплення толуольними краплями. У окрему посудину злити толуольну фазу, що зібрана у ємності (6). Добре збовтати рідини в обох посудинах та визначити концентрацію оцтової кислоти у кожній з них шляхом прямого титрування лугом по фенолфталеїну. Титрування кожної рідини провести тричі і визначити середні дані. Окремо взяти пробу вихідного розчину оцтової кислоти і теж відтитрувати її, визначивши вміст оцтової кислоти. Результати титрування занести у таблицю 2. Приблизні об’єми проб для титрування такі: вихідний толуольний розчин – 2-3 мл, кінцевий толуольний розчин з ємності (6) – 3-5 мл, водний розчин з ємності (11) – 20-30 мл.
8. Привести у порядок робоче місце і здати його лаборанту.
Таблиця 1