
- •1. Процестің теориялық негіздері
- •2. Шикізат, өнімдер мен материалдардың қысқаша сипаттамасы
- •3. Зерттеу сызбасын және өту параметрлерін таңдау және негіздеу.
- •Лампалық әдіспен күкірт құрамын анықтау
- •Потенциометриялық әдіспен
- •Зерттеуге қажетті жабдықтарды таңдау және негіздеу
- •Қондырғыдағы қауіпсіздік шаралары және еңбекті қорғау
- •Қолданылған әдебиеттер
КІРІСПЕ
Мұнай - көмірсутектер қоспасы болатын, жанатын майлы сұйықтық; қызыл-қоңыр, кейде қара түске жақын, немесе әлсіз жасыл-сары, тіпті түссіз түрі де кездеседі; өзіндік иісі бар; жерде тұнбалық қабатында орналасады; пайдалы қазбалардың ең маңызды түрі.
Негізінен алғанда көмірсутектерінен (85 % -ға дейін) тұратын бұл заттар дербес үйірімдер шоғыры түрінде жекеленеді: метанды, нафтенді және ароматты (хош иісті) тізбектер. Оның құрамында оттегі, азот, күкірт, асфальтты шайыр қосындылары да кездеседі.
Мұнайдың түсі қызғылт, қоңыр қошқыл, кейде ол ашық сарғыш түсті, ақшыл болып та келеді. Мысалы, Әзірбайжанның Сурахана алқабында ақшыл түсті мұнай өндіріледі. Мұнай судан жеңіл, оның меншікті салмағы 0,65-0,95 г/см3. Мұнай өз бойынан электр тоғын өткізбейді. Сондықтан ол электроникада изолятор (айырушы) ретінде қолданылады. Осы кезеңде мұнай құрамынан екі мыңнан астам халық шаруашылығына керекті заттар алынып отыр: бензин, керосин, лигроин, парафин, көптеген иіссу түрлері, кремдер, парфюмериялық жұмсақ майлар, дәрі-дәрмектер, пластмасса, машина дөңгелектері т.б. Ол қуатты әрі арзан отын — бір тонна мұнай үш тонна көмірдің, 1,3 тонна антрациттың, 3,3 тонна шымтезектің қызуына тең.
Көмірсутектермен қатар мұнай құрамында тағы басқа заттар да бар. Мырышы бар - H2S, меркаптандар, моно- және дисульфидтер, тиофендер мен тиофандар полициклдіктермен бірге т.б. (70-90% қалдық өнімдерде шоғырланады); азоттызаттар – негізінен пиридин, хинолин, индол, карбазол, пиррол және порфириндер (үлкен бөлігі ауыр фракциялар мен қалдықтарда шоғырланады) гомологтары; қышқылды заттар – нафтен қышқылы, фенолдар, смолалы-асфальтты т.б. заттар (әдетте жоғары қайнайтын фракциларында кездесетін). Элементтік құрамы (%): С – 82-87, Н – 11-14,5, S – 0,01-6 (сирек – 8-ге дейін), N - 0,001—1,8, O — 0,005—0,35 (сирек – 1,2-ге дейін) және т.б. Барлығы мұнай құрамында 50-ден аса элементтер табылған. Мысалы, жоғарыдағылармен қоса V(10-5 — 10-2%), Ni(10-4-10-3%), Cl (іздерінен бастап 2·10-2%-ға дейін) т.с.с. Әр зат әр кен орнында әр мөлшерде кездесетіндіктен орташа химиялық қасиетттер жайлы тек шартты түрде ғана айтуға болады.
Мұнай дүние жүзілік жанар-жағар май-энергетикалық балансында орасан зор үлеске ие: оның адамзат пайдаланатын қуат көздері ішінде 48% алады. Болашақта бұл көрсеткіш мұнай өндірудің қиындай беруінен, және атом және басқа қуат көздерін пайдалануының өсуінен кеми береді.
Химия мен мұнай-химия өнеркәсіптерінің қарқынды дамуына байланысты мұнайға деген сұраныс жанар-жағар майлар үшін ғана емес, синтетикалық каучук, синтетикалық талшықтар, пластмасс, жуу құралдарын, пластификатор, бояғыштар т.б. (әлемдік өндірістің 8%-нан астамы) өндіру шикізат көздері үшін өсуде. Осыларды шығаруға бастапқы заттар ретінде көп қолданылатындары: парафиндік көміртектер – метан, этан, пропан, бутан, пентан, гексан, және жоғарымолекулярлықтар (10-20 атомды молекулалы көміртектер), циклогексан; ароматты көміртектер – этилен, пропилен, бутадиен; ацетилен.
Мұнай өнімдері – көмірсутектер мен олардың туындыларының қоспасы; мұнай мен мұнай газдарынан алынатын жеке химиялық қосылыстар. Мұнай өнімдері отын, майлар, битумдар, ауыр көмірсутектер және әр түрлі мұнай өнімдері сияқты негізгі топтарға бөлінеді. Отын негізіндегі мұнай өнімдеріне көмірсутекті газдар мен бензин, лигроин, керосин, дизель отыны, мазут, т.б. жатады. Мұнайға серік газдар пайда болуы жөнінен табиғи газдарға жатады. Мұнайға серік газдар химиялық өңдеуге арналған және жеке көмірсутектер – этан, пропан, н-бутан, т.б. бөлініп алынады. Ал олардан қанықпаған көмірсутектер алады. Мұнай – молекулалық массалары әр түрлі, қайнау температуралары да бірдей емес көмірсутектердің қоспасы болғандықтан, айдау арқылы оны жеке фракцияларға (дистиляттарға) бөледі, мұнайдың құрамында С5 – Сn көмірсутектері бар және 40-200°С аралығында қайнайтын бензин құрамында С8 -С14 көмірсутектері болатын 150-200°С аралығында қайнайтын лигроин, құрамында С12-С18 көмірсутектері болатын және 180-300°С аралығында қайнайтын керосин алады, бұлардан кейін газойль алынады. Бұның бәрі – ашық түсті мұнай өнімдері. Бензин ұшақ пен көліктердің поршенді двигательдері үшін жанармай ретінде қолданылады. Лигроин трактор үшін жанармай болады. Керосин – трактор, реактивті ұшақтар мен зымырандардың жанармайы. Ал газойльден дизель жанармайы өндіріледі. Мұнайдан ашық түсті өнімдерді бөліп алғаннан кейін қара түсті тұтқыр да қоймалжың сұйықтық қалады, ол – мазут. Қосымша айдау арқылы мазуттан автотрактор майы, авиация майы, дизель майы, т.б. жағармайлар алады. Мазутты өңдеп жағармай алумен қатар оны химиялық әдіспен өңдеу арқылы бензинге айналдыруға болады, бу қазаны қондырғыларында сұйық отын ретінде пайдаланылады. Мұнайдың кейбір сорттарынан қатты көмірсутектер қоспасы – парафиндер алынады. Қатты және сұйық көмірсутектерді араластырып вазелин алады. Табиғи газ – жер қойнауында анаэробты органикалық заттардың ыдырауынан пайда болған газдар қоспасы.
Әр түрлі мұнай өнімдеріне мұнай коксы, күйе, мұнай пиролизінің әр алуан өнімдері (бензол, толуол, ксилол, т.б.), асидолдар, деэмульгаторлар, хлорпарафиндер, т.б. жатады. Мұнай өнімдерінің сапасы физикалық және химиялық қасиеттеріне байланысты бағаланады.
Курстық жұмыстың мақсаты, мұнай және мұнай өнімдерінің химиялық құрамын, мұнай құрамындағы күкіртті қосылыстарды анықтау. Мұнай және мұнай өнімдеріндегі күкіртті қосылыстарды анықтау әдісін жобалау.
1. Процестің теориялық негіздері
Күкірт мұнайда және мұнай өнімдерінде кең таралған гетероэлемент болып табылады. Оның мұнай құрамындағы мөлшері 5-6%-ке дейін, 14%-ға дейінгі аралықта болады.
Мұнай мен газ конденсаттарының күкіртті қосылыстары көбінесе меркаптандардан, сульфидтерден және ашық тізбекті дисульфидтерден, күкірттен, күкіртсутектен, циклді және гетероциклді қосылыстар мен олардың гомологтарынан тұратын күрделі қоспа.

Күкірт. Күкірт(ағылш.Sulfur), S – элементтердің периодтық жүйесінің VІ тобындағы химиялық элемент; атомдық номері - 16, атомдық массасы - 32,06. Тұрақты 4 изотопы бар. Сондай-ақ жасанды жолмен алынған 6 изотопы белгілі.
Күкірттің жер қыртысындағы салмақ мөлшері 0,05%, теңіз суында 0,08 – 0,09%. Күкірт біздің заманымыздан 2000 жыл бұрын белгілі болған.
Қалыпты жағдайда күкірт сары түсті, бейметалл. Табиғатта бос күйінде және сульфидті (мыс, пирит, галенит, антимонит, т.б.), сульфатты (гипс, ангидрит, барит, мирабилит, т.б.), т.б. минералдар түрінде кездеседі. Бос күйіндегі күкіртті тау жыныстарынан балқыту арқылы алады.
Сульфид минералдардың тотығуынан пайда болатын күкірт кендері көбінесе сульфид кендерінің үстіңгі қабатында болады. Бұл жағдайда күкірттің пайда болатын реакциясы келесідей болады:
RS + Fe2(SО4) 3 = 2FeS0 4 + RS04 + S.
Күкірттің бірнеше кристалдық түрлері белгілі, оның ішіндегі орнықтылары ромбылық α-күкірт және моноклинді β-күкірт. Күкірттің тығыздығы 2,07 г/см3 (α-түрі) және 1,96 г/см3 (β-түрі), балқу температурасы 112,8°С, қайнау температурасы 444,6°С, жылу өткізгіштігі 0,208 Вт/(м·град). Қарапайым суда ерімейді, бензолда жақсы ериді, қыздырғанда молекуласындағы атом саны бірте-бірте кемиді: S8→ S6→ S4→ S2 соңында 2000°С-тан жоғары қыздырғанда күкірт буында жеке атомдар пайда болады. Салқындатқанда осы процесс кері айналып полимерлену құбылысы жүреді. Күкірт II, IV, VI - валентті бола алады, ал тотығу дәрежелері -2,0, +4, +6 болып келеді. Азот, йод, алтын, платина және инертті газдардан басқа элементтердің бәрімен әрекеттеседі. Күкірт металдармен реакцияда болғанда өте көп жылу бөлініп шығады. Оттекпен бірнеше оксид түзеді. Күкірт полиметалдық кендер, газ және мұнайды тазалау кезінде олардан қосымша өнім ретінде алынады.
Балқаш, Шығыс Қазакстан облысында сульфидтер (ZnS, PbS, FeS2, т.б.) күйінде болса, сульфаттары (CaS04· 2Н20 - ғаныш (гипс), Na2S04·10Н20 - мирабилит, FeS04· 7Н20 - темір купоросы) т. б. болады.
Күкірт қосылыстары мұнайда және тас көмірде де кездеседі. Күкірт жай зат ретінде мұнайда еріген күйде болады. Мұнайды қыздырғанда (айдау процесінде) күкірт біртіндеп көмірсутектермен әрекеттеседі (әсіресе ароматты көмірсутектермен):
2RH + 2S→ R−S−R + H2S.
Күкірт негізінен химия өнеркәсібінде күкірт қышқылын алу үшін пайдаланылады, сондай-ақ қағаз, резина, сіріңке жасауда, тоқыма өнеркәсібінде мата ағартуға, дәрі-дәрмек, косметикалық препараттар дайындауда, пластмасса, қопарғыш заттар, тыңайтқыш, улы химикаттар алуда кеңінен қолданылады.
Күкіртті сутек, сульфидтер. Күкіртті сутек – өзіне тән жағымсыз иісті (шіріген жұмырткаиісіндей), түссіз, улы газ.
Күкіртті сутек суда нашар ериді. Нәтижесінде екі негізді, әлсіз күкіртті сутек қышқылы (лакмус пен метилоранжды қызартатын) түзіледі. Оның тұздары сульфидтер деп аталады.
Күкіртті сутек қышқылы сатылы диссоциацияға түседі.Сілтілік және сілтілік жер металдары суда жақсы ериді. Ауыр металдардың сульфидтері суда аз ериді немесе ерімейді.
Күкірттің сутекті қосылысы күкіртті сутек, ол көбінесе вулкан газдарында, табиғи шипалы сулардың құрамында кездеседі (барлық Арасан) және органикалық заттар шірігенде бөлінеді.
Күкіртті сутек қышқылы қышқылдарға тән барлық қасиеттерді көрсетеді: 1) активтік қатарында сутекке дейін тұрған металдармен әрекеттесіп сутегі бөледі:
H2S +Mg = MgS + Н2↑
2) негіздік оксидтермен тұз және су түзеді:
H2S + ҒеО = FeS↓ + Н20
3) негіздермен әрекеттесіп тұз және су түзеді:
H2S + 2NaOH = Na2S + 2Н20
4) тұзбен әрекеттескенде суда ерімейтін жаңа тұз және жаңа қышқыл түзіледі
H2S + Pb(N03)2 = PbSl + 2HN03
Бұл реакцияның жүру себебі PbS ерімейтін зат болғандықтан, көбінесе әлсіз қышқыл (H2S) күшті қышқылды (HN03) оның тұзынан ығыстыра алмайды.
2Н+ + S2- + Pb2+ + 2N03 = PbS↓ + 2Н+ + 2N03
Бұл реакцияның толық иондық теңдеуі.
Күкіртті сутек пен оның тұздарын анықтау үшін суда да, қышқылда да ерімейтін қара түсті PbS түзілу реакциясы қолданылады: Pb2+ + S2 -> PbS↓ кыскартылған иондык теңдеуі. Басқа сульфидтерінің де түстері бар. Мысалы, ZnS - ақ, MnS - қызғылт.
Тотығу-тотықсыздану реакцияларында күкіртті сутек қышқылы және оның тұздары тек тотықсыздандырғыш болады. Оның себебі кұрамындағы күкірт ең төмен тотығу дәрежесінде болады.
Қолданылуы H2S - емдік қасиеті бар, буын ауруларын емдеуде күкіртті сутек ванналарында пайдаланылады
Күкірт оксидтері. Күкірт екі түрлі оксид түзеді: S (IV) оксиді - SO2 (күкіртті газ немесе күкірттің диоксиді), бұл түссіз, тұншықтырғыш өткір иісті газ. Күкірт (VI) оксиді, күкірт ангидриді - SО3, ұшқыш, түссіз сұйықтық. SО3 +17°С температурада қатты зат. Олар суда жақсы ериді, нәтижесінде күкіртті қышқыл H2SО3 және күкірт қышқылы H2SО4 түзіледі, олай болса, бұлар қышқылдық оксидтер болып табылады.
SO2+H2О=H2SО3
SO3+H2О=H2SО4
Зертханада күкіртті ауада жандырғанда күкірт (IV) оксидін (ауа тартқыш шкафта) алуға болады. Сол сияқты бұл оксидті натрий сульфитінің кристалына, қышқыл ерітіндісін қосып та алады:
Күкірттің жануы
S+O2=SO2
Na2SO3+HCl=2NaCl+H2O+SO2↑
Өндірісте сульфидтерді жандыру арқылы:
2ZnS+3O2=2ZnO+2SO2↑
2SO2+O2↔2SO3↑
1) негіздік оксидпен әрекеттесіп тұз түзеді:
SO2+Na2O=Na2SO3
SO3+Na2O=Na2SO4
2) негізбен әрекеттескенде тұз және су түзіледі:
SO2+2NaOH=Na2SO3+H2O
SO3+2NaOH=Na2SO4+H2O
Күкірт (IV) оксиді тотығу-тотықсыздану реакцияларында әрі тотықтырғыш, әрі тотықсыздандырғыш; себебі күкірттің тотығу дәрежесі аралық мәнде (+4) болады.
SO2 ағартқыш ретінде және зиянды микроағзалардан көкөніс қоймаларын тазартады.
Тиолдар (меркаптандар) – құрылысы RSH, мұндағы R – молекулалық массалары әртүрлі көмірсутектердің барлық түрінің (алкандардың, цикландардың, арендердің, гибридті) орынбасары. Олардың өте жағымсыз иісі бар. Олардың осы қасиеті қалалар мен ауылдарды газбен қамтамасыз етуде газ құбырының дұрыс жұмыс істемей тұрғандығын ескерту үшін қолданылады. Тұрмыстық газ одоранты ретінде этилмеркаптан қолданылады. Мұнайдағы меркаптанды күкірттің мөлшері оның жалпы мөлшерінің 0,1-15% құрайды. Мұнайдың бензин фракциясындағы меркаптандар басқа күкіртті қоспаларға қарағанда көп болады. Фракцияның қайнау температурасы өскен сайын олардың мөлшері азаяды.
Химиялық қасиеттері бойынша меркаптандар спирттерге ұқсас, бірақ –SH тобындағы сутек атомы қозғалғыш, сондықтан меркаптандар негіздермен оңай, тіпті металл оксидтерімен, оның ішінде сынап оксидімен әрекеттеседі:
2R−SH + HgO → (RS)2Hg + H2О.
Осыған байланысты олардың меркаптандар аталуы.
Меркатандар негізінен бензин және керосин фракцияларында кездеседі. Олардың мұнайдағы мөлшері көп емес. Барлығына дерлік күкіртті қосылыстар (күкірттің жалпы құрамы 0,89%) меркаптандар болып табылады және бензин фракциясында концентрленеді.
Метилмеркаптан (метантиол) – қайнау температурасы 5,9°C болатын газ. Этилмеркаптан және өте жоғары молекулалы гомологтары – суда ерімейтін сұйықтық. С2-С6 меркаптандарының қайнау температурасы 35-140°C. Меркаптандар жағымсыз иісті болып келеді. Төмен молекулалы көрсеткіштерінде де бұл жағымсыз иіс интенсивті, яғни өте кіші концентрациясында (С2Н5SH 0,6·10-4 ÷ 2·10-6 %) сезіледі. Олардың бұл қасиеті қаланы газбен жабдықтау практикасында газ жолының қателігі туралы ескертуге қолданылады. Олар тұрмыстық газ құрамына сорғыш тартпа ретінде қосылады.
Мұнай құрамындағы меркаптандар жақсы зерттелген. Мұнай құрамынан көптеген осы кластағы жеке қосылыстар, яғни С1-ден С8-ге дейінгі көміртек атомы санына байланысты біріншілік, екіншілік, үшіншілік және моноциклді меркаптандар анықталған. Мысалы:
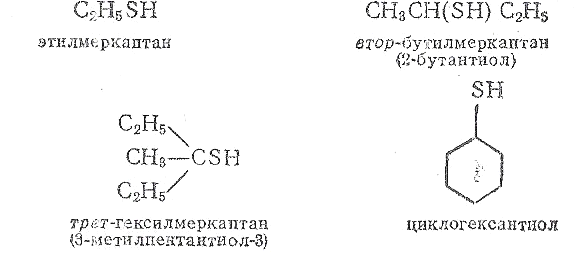
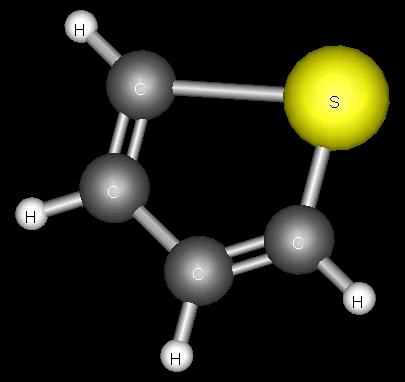
Тиофен –гетероциклді қосылыс. Балқу температурасы – 38,3°С, қайнау температурасы 84,1°С, тығыздығы 1,06 г/см3 (20°С-та), суда нашар, органикалық еріткіштерде жақсы ериді. Химиялық қасиеті жағынан ароматты көмірсутектерге ұқсас. Тиофенді алғаш 1882 ж. неміс химигі В.Мейер (1848 – 1897) тас көмір қара майынан бөліп алып, физикалық-химиялық қасиеттерінінің бензолға өте ұқсас екендігін анықтаған. Техникалық бензолдың құрамында 0,5%-ға дейін тиофен болады. Тиофен бензол иісті, түссіз сұйықтық; нитрлеу, сульфирлеу және галогендермен орын басу реакцияларына түседі. Тотықтырғыштардың әсеріне тұрақты. Өнеркәсіпте тиофенді бутанды күкіртпен 600°С температурада әрекеттестіру арқылы алады. Тиофен туындылары: нитротиофен коррозияингибиторлары (тежегіштер) ретінде, сульфотиофен медицинада, полимерлері винил полимерлерінің пластификаторлары ретінде қолданылады.
Тиофен және оның туындылары орташа және жоғары қайнайтын мұнай фракцияларында кездеседі. Олар барлық күкіртті қосылыстардың 45-84% құрайды. Қазіргі кезде әртүрлі алкилтиофендер теңдестірілген, олар 2-, 3-метил-, 2-, 3-этил және көбінесе 2н- мен 2-изопропилтиофендер болып табылады.Диорынбасқандардан 2,3-, 2,4-, 2,5- және 3,4-диметилтифендерді атауға болады. Три- және тетраорынбасқан тиофендер метил-, этилтуындылары болып табылады. Елеулі көп кезедесетіні – циклоалкилтиофендер.
